高血压合并T2DM并发DR患者血清Nesfatin-1表达与糖脂代谢、BMI的关系研究*
2022-04-29方向明叶文春赵姝洁漆晓玲
高 莉,方向明,叶文春,赵姝洁,黄 婧,漆晓玲
电子科技大学医学院附属绵阳医院·绵阳市中心医院内分泌科,四川绵阳 621000
高血压及2型糖尿病(T2DM)均是临床最常见的基础性疾病,二者合并将增加血压及血糖控制难度,增加患者疾病负担[1]。伍堪清[2]研究表示,高血压合并T2DM患者并发视网膜脱落、冠心病、高脂血症的比例远高于单纯T2DM患者,推测高血压将加重T2DM相关并发症。糖尿病视网膜病变(DR)由糖尿病导致的视网膜小血管损伤所致,DR可造成不同程度的视力损伤,是糖尿病常见并发症[3]。糖脂代谢紊乱是糖尿病及其相关并发症的主要发病因素,随着医学研究的不断发展,黄亚博等[4]研究发现,血清摄食抑制因子-1(Nesfatin-1)可调节血糖,并与糖代谢、胰岛素抵抗(IR)有着密切联系。本研究探讨高血压合并T2DM并发DR患者血清Nesfatin-1表达与糖脂代谢及体质量指数(BMI)的关系,旨在为DR致病机制的探究提供新方向,现报道如下。
1 资料与方法
1.1一般资料 选取2017年1月至2020年6月本院收治的50例高血压合并T2DM未并发DR患者(A组)和72例高血压合并T2DM并发DR患者(B组)作为研究对象,B组患者根据视网膜病变程度,将其分为非增殖性DR患者33例(B1组)与增殖性DR患者39例(B2组)。诊断标准:高血压诊断参照2010年中国高血压防治指南[5],T2DM参照文献[6]诊断标准,DR的诊断及分期参照全国眼底协作组制定的糖尿病视网膜诊断标准(1998年)[7]。纳入标准:(1)各组患者分别符合上述诊断标准;(2)可配合完成实验且临床资料完整。排除标准:(1)合并其他系统性疾病;(2)合并恶性肿瘤;(3)合并全身感染;(4)参与研究前3个月内有手术史及创伤史。A组男23例,女27例,年龄53~85岁,平均(68.45±13.58)岁;B组男40例,女32例,年龄61~87岁,平均(70.30±15.52)岁。本研究经医院伦理委员会批准,参与者知情且同意参与本研究。
1.2方法 血液标本采集及处理:研究对象入院时采集其外周空腹静脉血5 mL,3 000 r/min高速离心10 min,分离上层血清,置于-80 ℃冰箱中保存待用。血清Nesfatin-1水平检测:采用酶联免疫吸附试验(ELISA)检测待测样本中Nesfatin-1水平,试剂盒购自武汉华美科技有限公司,严格按照试剂盒相关标准进行检测,最后分别以标准品Nesfatin-1水平对数与相应的吸光度(A值)对数作为横坐标与纵坐标,绘制标准曲线,读取检测样本中Nesfatin-1水平。实验室生化指标检测:取研究对象空腹静脉血5 mL,采用美国Bakerman CX4全自动生化分析仪检测血糖及血脂相关指标,包括空腹血糖(FPG)、糖化血红蛋白(HbA1c)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。体质量指数(BMI)检测:BMI=体质量(kg)/身高2(m2)。胰岛素抵抗指数(HOMA-IR)计算:HOMA-IR=空腹血糖(FPG)×空腹胰岛素(FPI)/22.5。正常个体HOMA-IR<2.69,HOMA-IR水平越高,提示胰岛素抵抗程度越严重。

2 结 果
2.1A组及B组临床参数及实验室指标比较 B组高血压病史及糖尿病病史显著长于A组,FPG、HbA1c、HOMA-IR及BMI水平均显著高于A组,HDL-C水平显著低于A组(P<0.05)。B2组高血压病史及糖尿病病史均显著长于B1组,HDL-C水平显著低于B1组,HOMA-IR及BMI水平均显著高于B1组(P<0.05)。见表1。
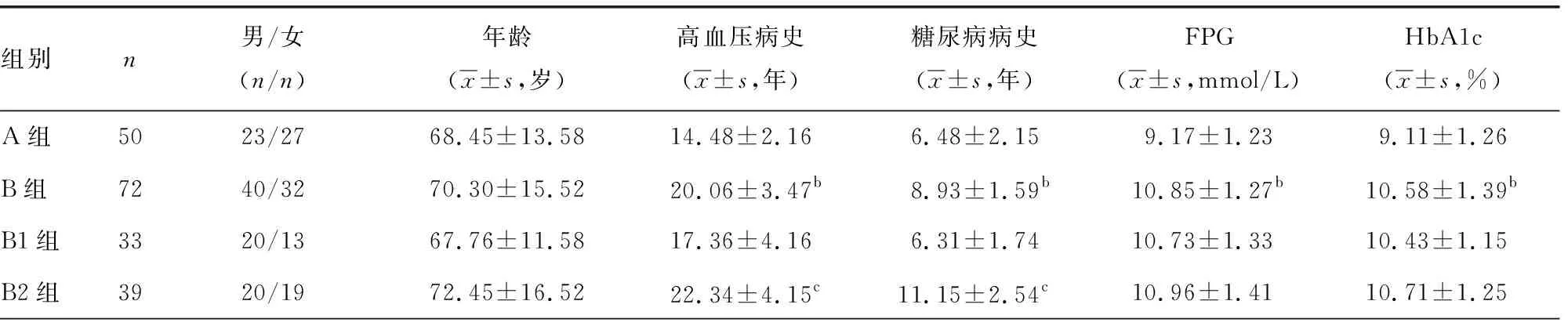
表1 A组及B组临床参数及实验室指标比较

组别nTG(x±s,mmol/L)TC(x±s,mmol/L)HDL-C(x±s,mmol/L)LDL-C(x±s,mmol/L)HOMA-IR(x±s)BMI(x±s,kg/m2)A组502.61±0.435.21±0.871.21±0.272.93±0.513.15±0.6323.47±3.25B组722.58±0.375.17±0.831.07±0.23b3.05±0.545.82±1.16b26.27±3.69bB1组332.62±0.365.13±0.791.11±0.153.01±0.475.06±1.4325.21±4.03B2组392.54±0.415.21±0.851.03±0.17c3.09±0.516.46±1.54c27.17±3.67c
2.2A组及B组血清Nesfatin-1水平比较 A组、B组、B1组、B2组血清Nesfatin-1水平分别为(1.46±0.36)、(1.00±0.16)、(1.16±0.23)、(0.87±0.14)μg/L,B组血清Nesfatin-1水平低于A组,且随着DR程度的加重,血清Nesfatin-1水平下降(P<0.05)。
2.3血清Nesfatin-1水平与其他临床参数的相关性分析 相关性分析提示,B组患者血清Nesfatin-1水平与其糖尿病病史、HOMA-IR及BMI呈负相关,与HDL-C水平呈正相关(P<0.05)。见表2。

表2 血清Nesfatin-1水平与其他临床参数的相关性分析
2.4各因素对DR的非条件Logistic回归分析 Logistic多元回归分析显示,HOMA-IR、BMI是影响高血压合并T2DM发生DR的独立危险因素,血清Nesfatin-1水平是其保护因素。见表3。

表3 各因素对DR的非条件Logistic回归分析
3 讨 论
DR是导致糖尿病患者视力下降甚至丧失的主要因素。积极防控并治疗DR,对改善患者生活质量具有重要意义。本研究结果发现,与A组患者相比,B组患者高血压及糖尿病疾病程更长,提示基础性疾病病程可能是影响DR发生的因素之一。比较两组糖脂代谢相关指标发现,B组患者FPG、HbA1c、HOMA-IR及BMI水平更高,HDL-C水平更低。提示糖脂代谢及胰岛素抵抗水平也影响着DR的发生。B1组和B2组有高血压及糖尿病病史、HDL-C、HOMA-IR及BMI水平比较差异有统计学意义(P<0.05)。提示糖尿病病史、糖脂代谢、IR及BMI与DR的发生、发展存在关系。
视网膜微血管受损,细胞外基质生成、血管细胞增殖及细胞因子的改变将导致视网膜最终脱落,DR与糖尿病病史、血压、血糖、血脂等多因素相关,但目前关于DR的具体致病机制尚不明确[8-10]。Nesfatin-1是一种摄食相关胃肠调节肽,广泛分布于消化中枢系统及外周组织中,可调节摄食及能量代谢[11-12]。YANG 等[13]利用高脂喂养的大鼠进行实验发现,注射Nesfatin-1可有效降低大鼠体内血糖水平,并指出,Nesfatin-1可促进胰岛素受体AMPK/AKt/TORC2通路磷酸化,增强机体胰岛素敏感性,进而维持血糖平衡。由于DR的发生与糖代谢相关,故推测Nesfatin-1与DR也有着密切联系。本研究发现,与A组比较,B组患者血清Nesfatin-1水平明显下降,且随着DR程度的加重,血清Nesfatin-1水平也随之下降。证实Nesfatin-1可能与DR相关。
B组患者血清Nesfatin-1水平与其糖尿病病史、HOMA-IR及BMI水平呈负相关,与HDL-C水平呈正相关,提示Nesfatin-1与糖尿病病史、IR水平、脂代谢及BMI关系密切。Logistic多因素回归分析提示,HOMA-IR、BMI是高血压合并T2DM患者发生DR的独立危险因素,而血清Nesfatin-1水平是其保护因素,说明血清高水平Nesfatin-1将降低高血压合并T2DM患者并发DR的危险性。GONZALEZ 等[14]研究发现,高糖环境下,Nesfatin-1促进胰岛素分泌的功能较低糖环境中高,Nesfatin-1与胰岛素生物行为密切相关。NAKATA等[15]研究发现,Nesfatin-1可激活小鼠胰岛β细胞中L型钙离子通道,促进钙离子内流,进而促进胰岛素分泌。本研究发现,血清Nesfatin-1是高血压合并T2DM并发DR的保护因素,可能与高水平Nesfatin-1可提高机体胰岛素敏感性,有效调节血糖,减轻糖尿病相关并发症发生风险有关。
