不同核酸提取试剂盒对血浆游离DNA提取效果的比较*
2022-04-29方仲表沈伟锋饶焕新章余旋潘志文
方仲表,沈伟锋,饶焕新,章余旋,潘志文,吴 欧△
1.浙江树人大学树兰国际医学院,浙江杭州 310015;2.中翰盛泰生物技术股份有限公司,浙江杭州 311100;3.浙江省肿瘤医院,浙江杭州 310022
游离DNA(cfDNA)是一种片段化的胞外核苷酸片段,主要以游离形式存在于血液之中或以蛋白质结合形式附着于细胞表面。在1948年研究者首次发现了血液cfDNA的存在[1-2]。目前肿瘤组织样本是检测肿瘤基因突变位点的主要材料,但其在临床上存在取材困难、患者依从性差、检测周期长等诸多不足。而外周血因其具有无创伤性和实时检测的绝对优势,且与组织检测结果的一致性可达80%以上[5]。因此,近年来,血浆中的cfDNA在肿瘤的液体活检领域被广泛应用[3-5]。由于血浆中游离DNA片段较短,含量极低,且易于降解[6],如何高效提取cfDNA成为亟待解决的难题。目前市面上血浆cfDNA提取试剂盒较多,但是不同试剂盒的提取方法和提取效率上存在差异。硅胶膜吸附柱法和磁珠法是目前主流的cfDNA提取手段[7-8]。本研究选取了市场上较有代表性的Qiagen公司的Circulating Nucleic Acid kit(硅胶膜吸附柱法,以下简称Qiagen)和北京天根生化科技有限公司生产的大体积游离核酸提取试剂盒(磁珠法,以下简称天根),从cfDNA提取浓度、纯度,人表皮生长因子受体(EGFR)基因突变阳性检出率、重复性等方面评估两种提取试剂盒的性能表现,以期为临床上对人EGFR突变基因的检测提供更经济、有效的商品化试剂盒的选择提供依据。
1 资料与方法
1.1一般资料 收集浙江省肿瘤医院肺癌晚期患者的血浆样本100例,且院方已使用厦门艾德生物医药科技股份有限公司生产的人EGFR突变基因检测试剂盒检测出血浆样本的突变位点。
1.2仪器与试剂 磁珠法大体积游离核酸提取试剂(北京天根生化科技有限公司,货号:DP-710);硅胶膜吸附住法Circulating Nucleic Acid kit(德国Qiagen公司,货号:55114);人EGFR突变基因检测试剂盒(多重荧光PCR法)由杭州中翰盛泰生物技术股份有限公司提供(批号:EGF2011002);NanoDrop超微量紫外分光光度计(美国Thermo公司);ABI 7500实时荧光定量PCR仪(美国Thermo公司);高速离心机(美国Thermo公司)。
1.3方法
1.3.1cfDNA提取 医院收集到肺癌晚期患者外周血样本后,立即离心分离血浆。用Qiagen和天根试剂盒分别进行提取。(1)Qiagen提取步骤:取1.5 mL离心管依次加入蛋白酶K、2 mL血浆样本、裂解ACL缓冲液,振荡混匀后在60 ℃下裂解孵育30 min,添加缓冲液ACB振荡混匀并在冰上孵育5 min,将混合物放入QIAamp Mini色谱柱的试管延长器中使裂解物完全通过色谱柱,在色谱柱依次上样缓冲液ACW1、ACW2、无水乙醇,取下色谱柱置于心得采集管中在56 ℃下孵育10 min,丢弃采集管并将色谱柱置于1.5 mL洗脱管中,加入50 μL 洗脱缓冲液AVE,室温孵育3 min,离心1 min洗脱核酸并将溶液转移保存。(2)天根提取步骤:取1.5 mL离心管依次加入2 mL血浆、裂解液、蛋白酶 K、磁珠,涡旋振荡混匀后室温孵育20 min,将离心管置于磁力架上去除液体,加入750 μL缓冲液GDF混匀并置于磁力架去除液体,加入750 μL漂洗液PWG振荡混匀并置于磁力架去除液体,加入50 μL洗脱缓冲液TBC,56 ℃孵育5 min,将核酸溶液转移并保存。
1.3.2提取后cfDNA浓度、纯度检测 取12例血浆样本用Qiagen和天根提取cfDNA,使用超微量紫外分光光度仪对cfDNA进行浓度、纯度检测,每例样本重复测3次,具体操作步骤按照超微量紫外分光光度仪标准操作规程进行。对测得提取后cfDNA的浓度、纯度进行统计学分析,评价两试剂盒在提取cfDNA浓度、纯度方面的优劣。
1.3.3荧光定量PCR法(qRT-PCR)分析EGFR基因突变检出情况 采用人EGFR突变基因检测试剂盒(多重荧光PCR法),通过ABI 7500定时荧光定量PCR仪,检测两种试剂盒提取后的cfDNA的EGFR基因突变检测情况。具体步骤按照人EGFR突变基因检测试剂盒(多重荧光PCR法)说明书进行。扩增条件:95 ℃ 5 min;95 ℃ 1 s,70 ℃ 20 s,65 ℃ 20 s,共15个循环;95 ℃ 1 s,70 ℃ 20 s,60 ℃收集荧光信号30 s,共30个循环。用ABI 7500 software(v2.3)分析结果。
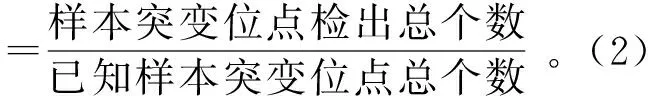

2 结 果
2.1Qiagen、天根两种游离核酸提取试剂盒的基本情况 见表1。

表1 游离核酸提取试剂盒基本情况
2.2核酸浓度及纯度的比较 由表2可知,与Qiagen相比,天根试剂盒提取后样本NO.2的核酸浓度比较差异无统计学意义(P>0.05),其余样本的核酸浓度显著降低,差异有统计学意义(P<0.05)。两种试剂盒所提取的cfDNA纯度数据见表3。Qiagen试剂盒提取出的cfDNA的A260/A280比值为1.8~2.2,而天根试剂盒提取得到的cfDNA的A260/A280比值均明显低于1.7,蛋白质污染严重。
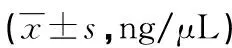
表2 两种试剂盒提取的cfDNA的浓度
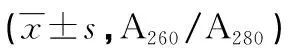
表3 两种试剂盒提取的cfDNA纯度
2.3扩增结果分析
2.3.1阳性检出率结果对比 表4结果显示,Qiagen试剂盒提取的血浆cfDNA突变位点检出结果与已知突变位点信息一致,突变位点阳性检出率为100%。天根试剂盒提取的血浆cfDNA中,样本NO.2的突变位点19del,样本NO.5的突变位点T790M,样本NO.9的突变位点G719X出现漏检,突变位点阳性检出率为85%。所有样本的IC基因均被检出。从结果中可以表明Qiagen试剂盒在阳性检出率方面要优于天根试剂盒。
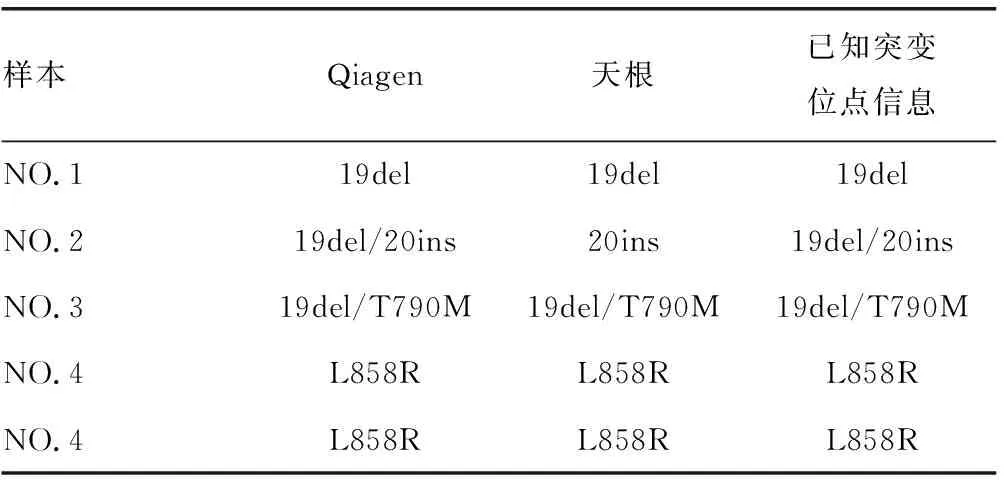
表4 两种试剂盒提取cfDNA突变位点的阳性检出率
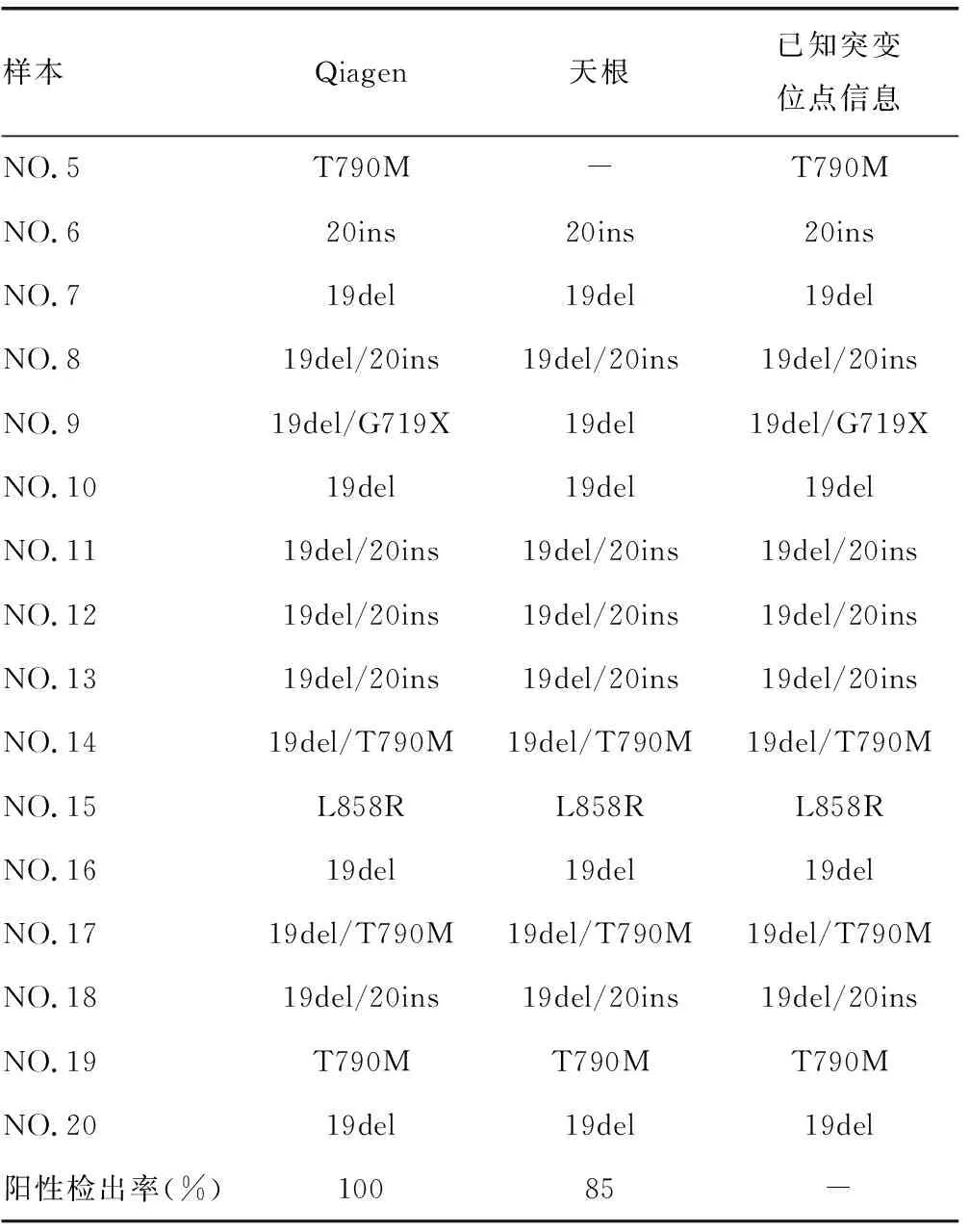
续表4 两种试剂盒提取cfDNA突变位点的阳性检出率
2.3.2重复性结果对比与分析 通过两试剂盒提取的cfDNA检出指标Ct值的CV值来分析两种不同试剂盒对EGFR基因突变的重复性的影响。见表5。结果表明,Qiagen试剂盒提取的cfDNA的检出结果Ct值的CV值均小于5%,而天根试剂盒的样本NO.1中19del检测结果的Ct值的CV值大于5%。
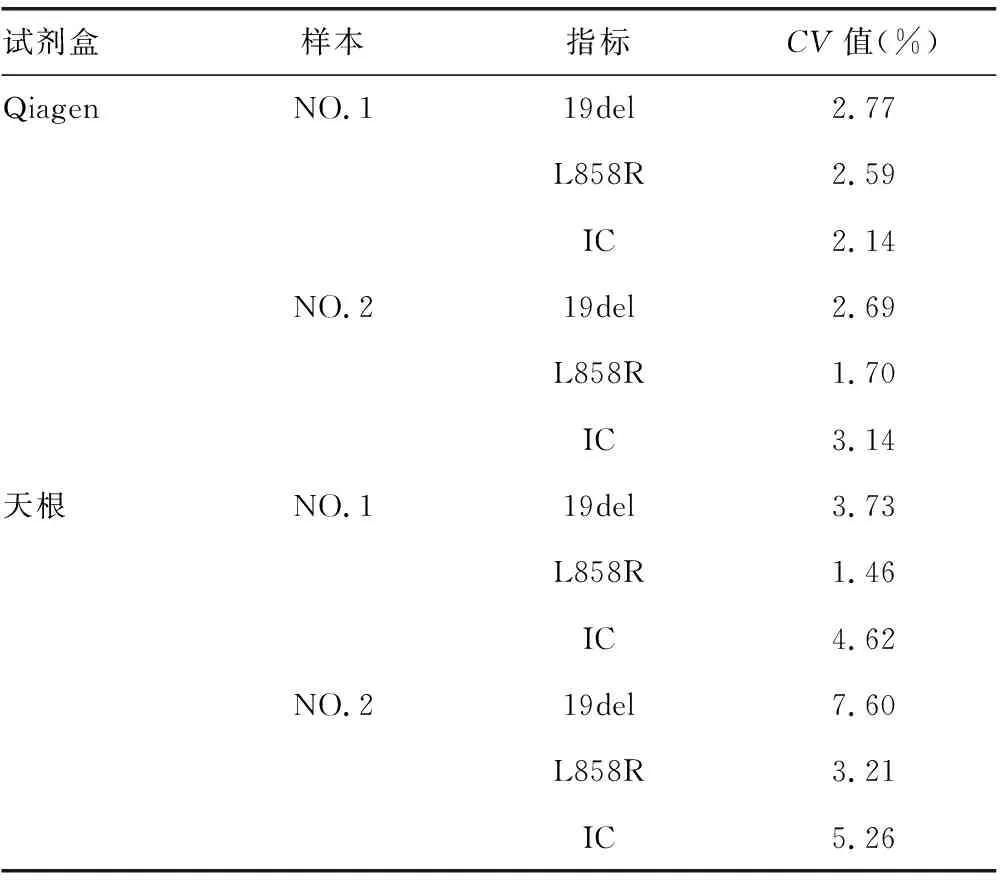
表5 cfDNA检出指标Ct值的重复性结果
3 讨 论
液体活检,特别是对cfDNA的分析,已经成为肿瘤学中一种很有前景的非侵入性诊断方法[9]。因其无创性的特点,cfDNA作为“液体组织”已显示出了非常重要的临床应用前景[10-11]。非小细胞肺癌(NSCLC)是最常见的肺癌亚型[12]。EGFR基因是NSCLC患者的肿瘤发生发展过程中的驱动基因,NSCLC患者中常见的EGFR突变类型是19号外显子缺失突变(19del)和21号外显子L858R点突变,除此以外,还有T790M点突变和20号外显子插入突变(20ins)等类型[13]。研究表明,25%的NSCLC患者就诊时已是晚期,此时进行手术诊断或连续活检可能无法完成[15],因此,通过液体活检的方法,从血液中提取cfDNA可作为检测体基因突变的可行替代方法。通过获取血液(血浆)样本中cfDNA并检测其EGFR基因突变状态来评估NSCLC患者的情况,对NSCLC患者的诊断和检测具有预后价值[14-15]。
然而,目前对cfDNA的定量检测仍然面临问题及争议,缺乏规范和标准化的流程[16],cfDNA的提取方法和定量方法也是决定实验误差的主要因素[17]。有研究表明,不同的提取方法及使用不同提取试剂盒在提取cfDNA的效率上存在很大差异[18-19]。因此,本研究采集了多例肺癌晚期患者的血浆样本,且医院已提供的了该血浆样本中EGFR突变基因的突变位点信息。采用Qiagen和天根分别提取血浆样本中的cfDNA,再通过人EGFR突变基因检测试剂盒(多重荧光定量PCR法)分析两种试剂盒提取血浆中cfDNA的提取效果。通过比较目前市场上具有代表以上两种提取试剂盒(分别代表硅胶膜吸附柱法和磁珠法)的提取性能,建立评价cfDNA提取优劣的方法,为cfDNA在临床EGFR突变基因检测选取更经济、有效的cfDNA提取试剂盒提供依据。
本研究首先对试剂盒基本情况进行了评价。在成本方面,Qiagen试剂盒单人次的价格虽要高于天根试剂盒,但在提取时间方面,Qiagen试剂盒在手提时长方面耗时要少于天根试剂盒。且相关资料表明,在需要提取大量样本cfDNA且均为人工提取的情况下,Qiagen试剂盒的QIAamp Mini色谱柱可以通过真空泵抽取液体显著节省提取时间。
cfDNA提取优劣可以通过多种方面进行评价[18-19]。本研究则在cfDNA提取浓度、纯度,EGFR突变基因阳性检出率、重复性方面对两种试剂盒所提取的DNA质量进行评价分析。在cfDNA浓度、纯度检测方面,采用超微量紫外分光光度仪对多例血浆样本中提取得到的DNA进行检测分析。提取浓度方面的结果表明,Qiagen提取的大部分样本中cfDNA浓度要显著高于天根。A260/A280比值可以用于表示DNA的纯度,质量较好的DNA纯度A260/A280比值应为1.8~2.0,比值小于1.8时,则可能存在蛋白质或酚类的污染;大于2.0时,则可能存在RNA或异硫氰酸胍残留[20]。提取纯度方面的结果表明,Qiagen提取的cfDNA纯度有部分结果达到了1.8~2.0,其余结果均在2.0左右,且不超过2.1,表明提取中虽存在轻微的RNA污染,但提取的cfDNA纯度较好;天根提取的cfDNA纯度均低于1.7,表明其提取过程中均存在严重的蛋白质或多糖污染。由于cfDNA本身提取难度较大,而Qiagen在提取过程中仍有部分结果达到了理想区间,因此,Qiagen在提取纯度方面要优于天根。总体而言,Qiagen试剂盒提取出的cfDNA品质更好。
人EGFR突变基因检测试剂盒(多重荧光PCR法)用于体外定性检测人非小细胞肺癌患者经福尔马林固定的石蜡包埋组织样本或血浆样本中的人类EGFR突变基因。qRT-PCR因其具有灵敏度高、特异性强、操作简单且耗时短等优势,广泛应用于临床疾病的诊断和评估[21-22]。本研究根据qRT-PCR对cfDNA扩增结果的Ct值进行分析。Ct值即循环阈值,表示每个反应管内的荧光信号到达设定的域值时所经历的循环数,它与起始模板的浓度负相关[21]。因此,若Ct值越小,则表明提取效率越高。Cut-off值表示阳性和阴性结果的临界值,是判断检测结果的标准。在本研究中,cfDNA的EGFR突变位点扩增结果的Ct值小于Cut-off值则表示该突变位点检出结果呈阳性。本研究用Qiagen和天根对20例血浆样本分别进行cfDNA提取,共提取40次,用RT-qPCR进行扩增。结果显示,Qiagen和天根提取的血浆cfDNA突变位点阳性检出率分别为100%和85%,表明Qiagen提取的cfDNA阳性检出率要优于天根。
良好的重复性是检测系统在进行其他方法学验证实验的前提[23]。因此,除提取浓度、纯度和EGFR突变基因阳性检出率之外,重复性也是判断试剂盒性能的重要指标。本研究结果显示,Qiagen提取的血浆cfDNA中,EGFR突变位点19del和L858R及IC通道的Ct值的CV值均小于5%,表明Qiagen试剂盒提取重复性和稳定性高,随机误差小;天根提取的血浆cfDNA中,有部分CV值超过5%,表明天根的提取重复性和稳定性要劣于Qiagen。
综上所述,本研究在cfDNA提取浓度、纯度,EGFR突变基因的阳性检出率、重复性方面综合评估了两种试剂盒的cfDNA提取效果,研究结果表明,Qiagen试剂盒在以上几项性能的表现上均要优于天根试剂盒。
