醉金香葡萄愈伤细胞悬浮培养基优化促进白藜芦醇的合成
2022-04-29王晓惠王泽建肖慈英刘泽波郭美锦庄英萍
王晓惠, 王泽建, 肖慈英, 刘泽波, 郭美锦, 庄英萍
( 华东理工大学生物反应器工程国家重点实验室,上海 200237)
白藜芦醇(Resveratrol,简称Res)是一种非黄酮类多酚有机化合物,别名芪三酚[1],它最初是从白藜芦(Veratrum grandiflorumO. Loes)[2]中分离出来的,同时也发现其存在于日本虎杖(Fallopia japonica)中[3],目前已知至少有34 科、69 属、100 种不同的植物可产生白藜芦醇[4]。葡萄中的白藜芦醇具有抗真菌活性[5-6],而在叶片和浆果中,它作为一种植物抗毒素,是植物在应对压力(例如创伤或病原体侵袭)时产生的[7]。根据有效的数据研究结果,白藜芦醇具有抗癌[8]、抑菌[9]、抗炎症[10]、保护心血管[11-12]等多种生理功能,已被广泛应用于保健品、化妆品和食品等领域[13]。近年来白藜芦醇因为其潜在的健康益处[14],成为了许多医学和植物生理学研究的焦点[15]。目前,用于营养保健品、化妆品和特定药物用途的反式白藜芦醇的需求不断增长,这使得开发快速和可持续的白藜芦醇生产工艺成为了亟待解决的难题[15]。生物技术的使用将成为大规模生产反式白藜芦醇的有效手段,开发微生物或植物细胞表达生产白藜芦醇效率快、成本低、操作容易,避免了从植物中提取工艺的大量切割和抽提工作,是生产反式白藜芦醇可行的替代方法。
葡萄愈伤细胞悬浮培养制备白藜芦醇的主要优点是无需对植物细胞进行基因修饰,因为所用葡萄细胞呈组成型,能在响应胁迫下产生反式白藜芦醇,另外也可通过添加诱导剂来促进葡萄愈伤细胞防御并诱导其合成和分泌反式白藜芦醇。通过诱导悬浮培养过程中的葡萄愈伤细胞,能够促进细胞表达足够量的反式白藜芦醇,而且并不需要提供基因工程改造菌表达时的二苯乙烯类物质前体。近年来,利用植物细胞来生产反式白藜芦醇已成为研究的热点[16]。
本文利用筛选得到的醉金香葡萄愈伤细胞悬浮培养基制备白藜芦醇,研究了影响葡萄活性成分表达的显著因素,并进一步获得了显著因素的最佳营养配制条件,以提高醉金香悬浮细胞中白藜芦醇的表达效率。
1 材料与方法
1.1 原料和试剂
1.1.1 植物细胞及来源 以醉金香葡萄愈伤细胞为研究对象,该细胞由本实验室从不同品种葡萄外植体中诱导并筛选得到,并储存于华东理工大学国家生化技术研究中心(上海)。
1.1.2 实验仪器 Agilent 1 100 series 型高效液相色谱(美国Agilent Technologies Inc.),SHZ-D(Ⅲ)型循环式真空泵(上海予华公司),ZHWY-3 212 型旋转式摇床(上海智城公司),YXQ-LS-S 型压力蒸汽灭菌器(博讯实业有限公司医疗设备厂(上海)),GZX-9 420 MBE 型鼓风烘箱(华连医疗器械),酶标仪(美国Thermo 公司),METTLER TOLEDO FE38 型电导率仪,AL204 型分析天平,pH 计(梅特勒-托利多(中国))、(梅特勒-托利多(中国))。
1.1.3 培养基
(1)组培瓶培养基(g/L):B5 培养基 3.21,蔗糖30,6-苄氨基嘌呤(6-BA) 0.000 2,萘乙酸(NAA)0.004,聚乙烯吡咯烷酮(PVP)2。pH 5.8~6.0。
(2)初始摇瓶悬浮培养基(g/L):B5 培养基 3.21,蔗糖 30,PVP 2。pH 5.8~6.0。
1.2 培养方法
1.2.1 愈伤组织的诱导 取醉金香葡萄外植体(幼嫩的茎段),并剪成长1 cm 的茎段接到含有激素(6-BA和NAA)的半固体组培瓶培养基中进行愈伤细胞的诱导,培养基pH 值为6.0,25 ℃条件下静置暗处培养。注意将茎段平放,使茎段两端的伤口充分接触到培养基,直到培养基中长出胚性愈伤组织为止。
1.2.2 愈伤组织继代培养 在无菌条件下选取质地松散的愈伤细胞颗粒分成小块转接到半固体营养基中进行继代。若愈伤表面有较多的非胚性白色毛状物,可用解剖刀将其刮掉然后再进行切块培养。
1.2.3 愈伤组织摇瓶悬浮培养 在无菌条件下选取质地松散、长势较好、无褐化的愈伤组织,首先在组培瓶中轻轻将其夹碎,然后转移至摇瓶培养基中,按照15%接种量将细胞鲜重(Fresh Cell Weight,FCW)接种培养,在26 ℃,115 r/min 转速下振荡培养6 d,培养过程中光照、黑暗交替进行。继代时用12 目(1 400 μm)细胞筛筛除大的细胞团,将细小均一的单细胞继续继代培养。
1.3 参数检测
1.3.1 愈伤组织鲜重(FCW)和干重(DCW)的测定葡萄细胞培养结束时,将摇瓶中悬浮细胞培养液用8 μm 滤膜抽滤,并用超纯水冲洗细胞3 次,抽滤至滤纸不再滴水后,取细胞进行称量获得愈伤细胞的鲜重(Fresh Cell Weight,FCW),将抽滤后的鲜重细胞置于105 ℃烘箱中干燥,24 h 后恒重后称量愈伤细胞的干重(Dry Cell Weight,DCW)。
1.3.2 总糖测定 采用3,5-二硝基水杨酸(3,5-Dinitrosalicylic acid,DNS)法测定。
1.3.3 电导率测定 使用电导率仪测定培养液的电导率,电导率可表征培养液中离子浓度响应值。
1.3.4 白藜芦醇含量检测 标准曲线的绘制:准确称取 10.0 mg 白藜芦醇标准品(色谱级,纯度99.6%),用10 mL 70%(体积分数,下同)甲醇溶解,制成质量浓度为1.0 mg/mL 的标准品溶液,然后用70%甲醇分别将其稀释至 100、200、300、400、500、1 000 μg/L,用0.22 μm 滤膜将有机相过滤,供高效液相色谱仪分析。流动相:体积分数为0.05%的磷酸(A)和乙腈(B);乙腈的洗脱条件:0~40 min,5%~41%;40~42 min,41%~80%;42~45 min,80%~5%;45~55 min,5%~5%;色谱条件:检测波长 307 nm,流速 1 mL/min,进样量10 μL,柱温40 ℃。色谱柱:Water Symmetry C18 柱(250 mm×4.6 mm,5 μm)。
1.4 实验方法
1.4.1 单因素实验 本次单因素实验分别对培养基中的营养成分和诱导剂、激素等进行了研究与优化:碳源(葡萄糖、蔗糖、果糖、乳糖、麦芽糖以及甘露醇)添加量为30 g/L;氮源(蛋白胨、水解酪蛋白(CH)、酵母提取物)添加量为550 mg/L;前体与诱导剂苯丙氨酸(Phe)、茉莉酸甲酯(MeJA)、环糊精、水杨酸(SA),添加量分别为55 mg/L、55 μmol/L、55 mg/L、55 mg/L;激素NAA、6-BA、2, 4-氯化苯氧乙酸(2,4-D)、激动素(KT),添加量分别为3、0.6、3、0.6 mg/L;激素组合NAA+6-BA、2,4-D+KT、NAA+KT、2,4-D+6-BA,添加量分别为3、0.6、3、0.6 mg/L。
1.4.2 Plackett-Burman 设计 该实验设计是一种以不完全平衡块(Balanced incomplete blocks)为原理的部分因子设计法[17]。根据单因素实验的结果,参考原培养基成分,从中选取8 个因素进行P-B 试验[18]。每个因素设定两个水平(高浓度和低浓度分别表征为1 和-1),各个浓度设计见表1。
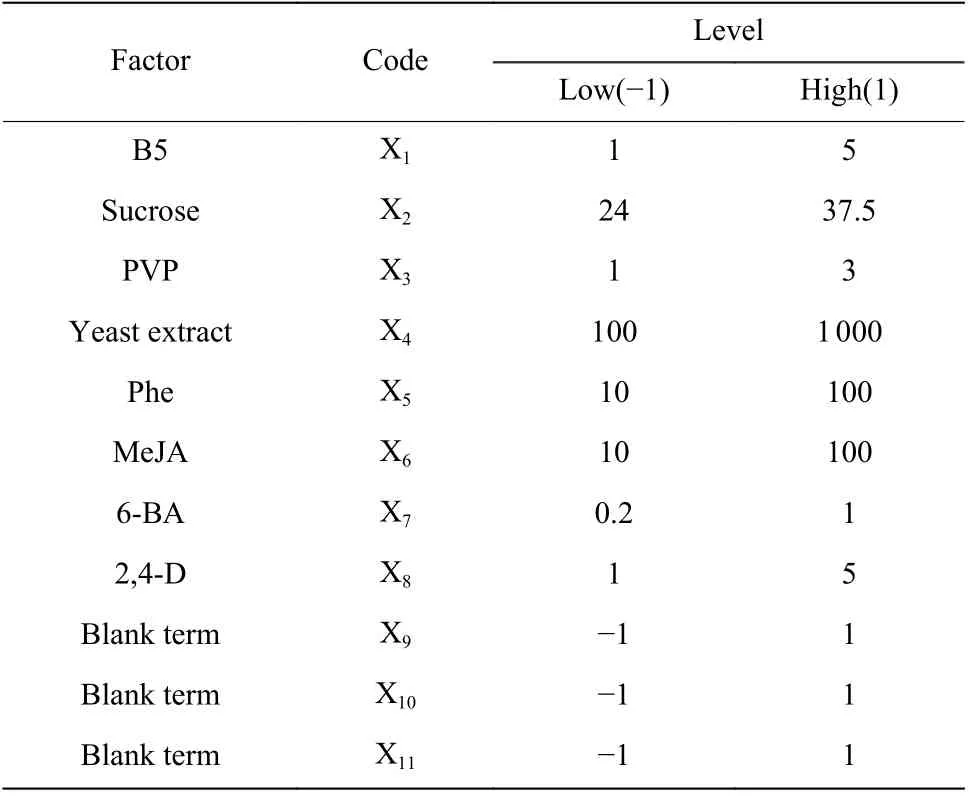
表1 Plackett-Burman 培养组分和水平Table 1 Culture components and levels in Plackett-Burman
1.4.3 响应面设计 基于Plackett-Burman 实验设计和最陡爬坡实验的结果,采用中心组合设计来分析3 个关键影响因素之间的交互配比关系,得到最优的培养基营养条件。以Plackett-Burman 实验结果得到的3 个显著因子为设计因素,以最陡爬坡实验得到的浓度作为中心点,每个因素设有-1.68、-1、0、1、1.68这5 个水平(表2)。
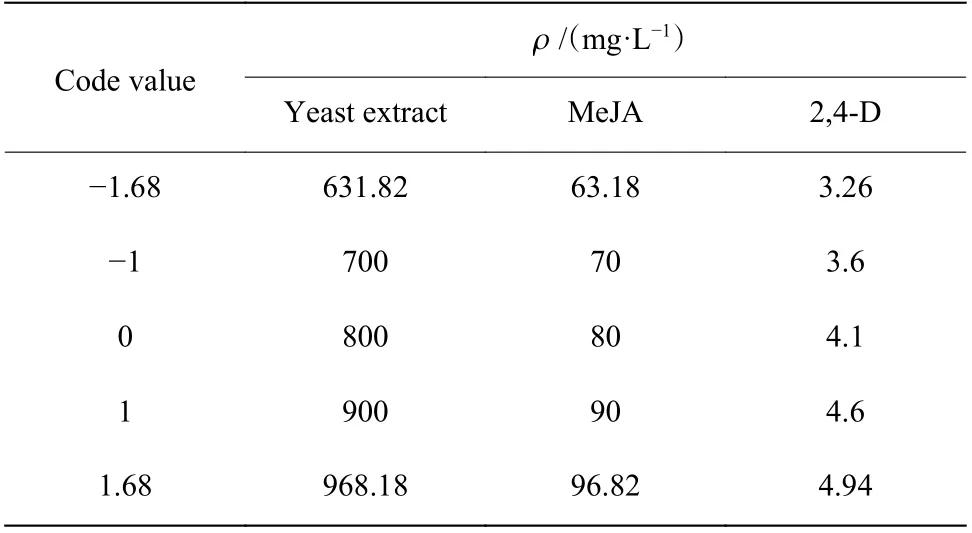
表2 Central-Composite 设计的因素水平Table 2 Factors and levels of central-composite design
2 结果与讨论
2.1 单因素实验考察基质对细胞生长和产物合成的影响
2.1.1 不同碳源对葡萄悬浮细胞生长及次级代谢产物的影响 碳源对植物细胞的生长起着非常关键的作用,是植物细胞生理代谢过程中的最主要能量来源。碳源种类对植物悬浮细胞自身的生长和次级代谢产物的积累都有重要影响。考察了不同的碳源底物包括葡萄糖、蔗糖、果糖、乳糖、麦芽糖以及甘露醇对醉金香葡萄细胞悬浮培养生长以及白藜芦醇合成的影响情况,实验结果见图1。在6 种不同的碳源培养基中,经过培养后,添加蔗糖和葡萄糖的培养基中的电导率比较低,其中以蔗糖为碳源的培养基中电导率最低,为515 μS/cm;而以甘露醇为碳源的培养基中电导率最高,为2 806 μS/cm。培养基中电导率越低,说明葡萄细胞利用无机盐营养底物越充分。研究结果显示,在蔗糖底物培养基中细胞干重最大,为13.35 g/L;而以甘露醇作为碳源底物的培养基中生物量最低。根据培养基上清液中的残糖浓度和葡萄细胞对底物的利用度可以看出,经过7 d 的培养后,以蔗糖为碳源底物的培养基中剩余总糖含量最低,蔗糖利用度达到了76.4%;而以甘露醇为底物碳源时糖利用度只有16.6%。产物检测结果显示,以蔗糖为碳源底物时单位细胞白藜芦醇的生成量(59.18 μg/g)最高。实验结果显示,与葡萄糖相比,果糖作为碳源尽管不利于菌体的生长速率,但白藜芦醇的合成速度和积累量明显高于葡萄糖底物,白藜芦醇的合成有可能与葡萄糖浓度过高情况下的代谢抑制有关。醉金香葡萄细胞对麦芽糖、甘露醇和乳糖的利用速率较低,白藜芦醇的合成较差,含量均低于10 μg/g。
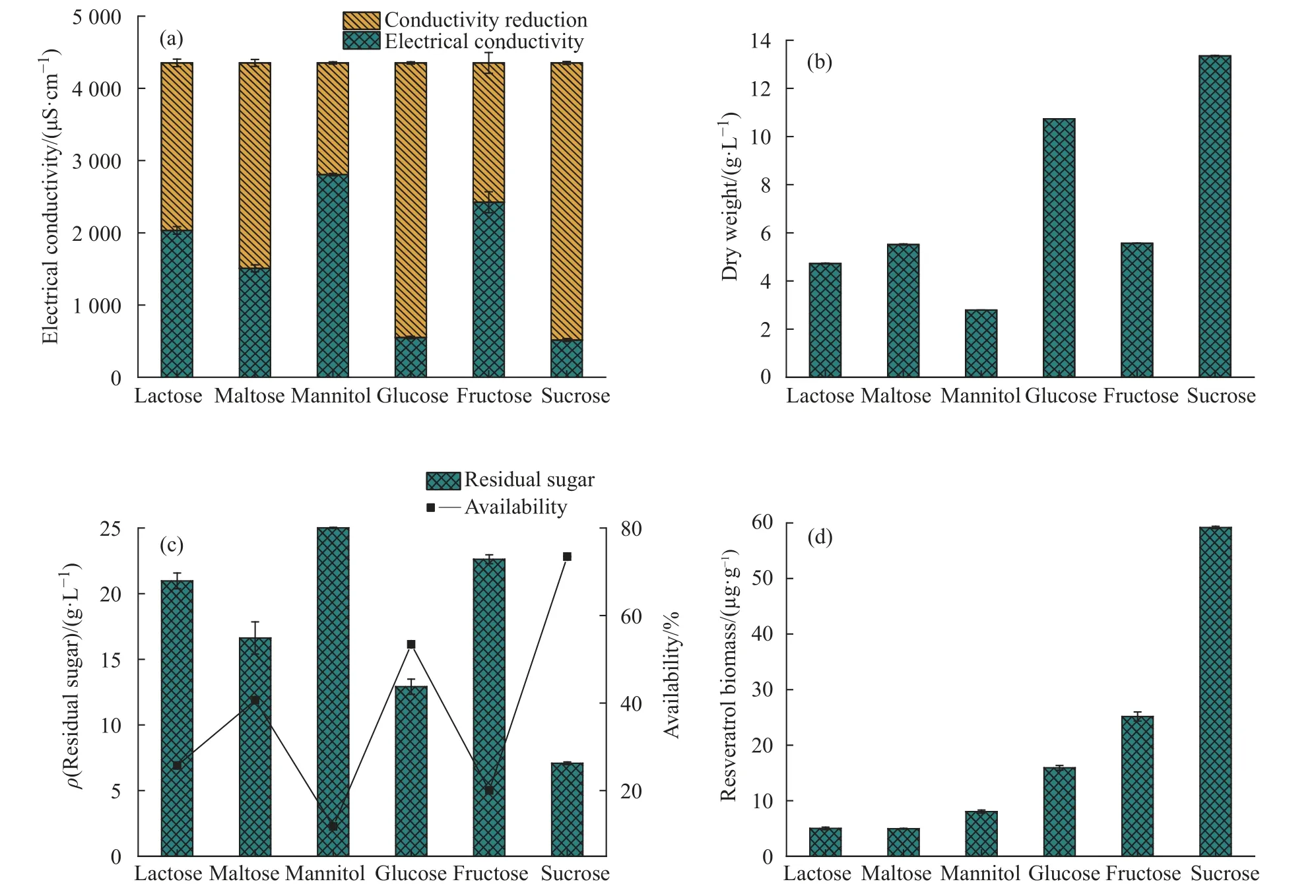
图1 不同碳源底物对醉金香葡萄细胞生长及产物合成的影响Fig. 1 Effects of substrates with different carbon sources on cell growth and production of Vitis vinifera
蔗糖作为一种碳源,它不仅可以为醉金香葡萄细胞提供能量来源,还能更好地起到调节培养基的渗透压的作用。蔗糖被细胞分解缓慢生成葡萄糖和果糖,可能在一定程度上解除了葡萄糖高浓度下的抑制作用。综上所述,选择蔗糖作为葡萄悬浮细胞后续培养的底物碳源。
2.1.2 不同有机氮源对葡萄悬浮细胞生长及次级代谢产物的影响 氮源是细胞生长的营养物质,培养基中氮源的含量直接影响细胞的生长情况进而最终影响次级代谢产物的合成。因此,选择适合葡萄细胞生长的氮源至关重要。考察了不同的有机氮源底物包括蛋白胨、水解酪蛋白、酵母提取物对醉金香葡萄细胞悬浮培养生长以及白藜芦醇合成的影响情况,实验结果见图2。在初始培养基中添加酵母提取物、蛋白胨和水解酪蛋白等氮源底物对细胞生长都有不同程度的促进作用。各实验组培养后培养基中的电导率水平相差不大,当以酵母提取物作为氮源底物时培养基中残留的电导率最低,为410 μS/cm,与对照组中的电导率(458.5 μS/cm)基本一致,各培养基中的生物量也相差不大。在初始培养基中添加了酵母提取物后,最终葡萄细胞的干重达到了15 g/L,是对照组中葡萄细胞干重(13.44 g/L)的1.12 倍。除此之外,以酵母提取物作为氮源底物时,糖的消耗量最大、糖的利用度最高(达到82.95%)。

图2 不同氮源底物对醉金香葡萄细胞生长及产物合成的影响Fig. 2 Effects of substrates with different nitrogen sources on cell growth and production of Vitis vinifera
单位菌体的产物合成结果显示,与对照组中白藜芦醇表达量(60.50 μg/g)相比,添加酵母提取物(白藜芦醇表达量147.35 μg/g)和水解酪蛋白(白藜芦醇表达量130.90 μg/g)作为氮源底物对白藜芦醇的合成促进效果最强,分别是对照组的2.43 倍和2.16 倍。添加了这3 种有机氮源后,对醉金香葡萄细胞的生长和白藜芦醇的合成都产生了积极的促进作用。本实验选择对葡萄细胞生长和产物合成效果较好的酵母提取物作为葡萄悬浮细胞的有机氮源底物。
2.1.3 不同前体物质和诱导剂对葡萄悬浮细胞生长及次级代谢产物的影响 白藜芦醇作为茋类次生代谢产物,在植物体内是通过苯丙氨酸代谢途径合成的。苯丙氨酸是合成白藜芦醇途径中的关键前体,添加适量的苯丙氨酸会促进白藜芦醇的积累[19]。环糊精、水杨酸、茉莉酸甲酯是细胞培养过程中经常添加的诱导剂。本文考察了苯丙氨酸、茉莉酸甲酯、环糊精、水杨酸对醉金香葡萄细胞悬浮培养生长以及对白藜芦醇合成的影响情况,实验结果见图3。在初始培养基中添加苯丙氨酸、水杨酸和环糊精后,培养液中的电导率和对照组基本一致,但添加茉莉酸甲酯组的培养液中,离子消耗量最少,电导率最高,为2 724 μS/cm,其生物量最低,茉莉酸甲酯呈现出对醉金香葡萄细胞生长的明显抑制作用。水杨酸的添加也会对醉金香葡萄细胞生长呈现一定的抑制作用。图3 结果表明苯丙氨酸和环糊精对葡萄细胞的生长有较好的促进作用,添加苯丙氨酸组的细胞干重最高。培养后白藜芦醇含量对比结果表明苯丙氨酸、茉莉酸甲酯、水杨酸和环糊精对白藜芦醇的积累有不同程度的促进作用,其中添加茉莉酸甲酯的实验组的单位细胞白藜芦醇含量最高,培养结束时达到了1 012.88 μg/g,相比于对照组的52.42 μg/g,提高了约18 倍。茉莉酸甲酯作为一种重要的细胞调节因子,往往参与种子萌发、根生长、果实成熟和衰老等发育过程,同时也是对生物和非生物胁迫的防御反应。已有文献表明用茉莉酸甲酯处理后茉莉酸生物合成和次生代谢相关基因的表达上调[20]。

图3 不同前体和诱导剂对醉金香葡萄细胞生长及产物合成的影响Fig. 3 Effects of different precursors and inducers on cell growth and production of Vitis vinifera
综上分析,选择苯丙氨酸作为醉金香葡萄悬浮细胞后续培养的前体物质,并选用茉莉酸甲酯作为有效诱导剂。
茉莉酸甲酯作为一种化学诱导子, 能够促进植物细胞防御应答、次级代谢产物合成以及影响细胞的生长,诱导子的添加时间也至关重要。在醉金香葡萄细胞培养周期的第0、2、4、6 d 添加55 μmol/L的茉莉酸甲酯,考察茉莉酸甲酯的添加时间对葡萄细胞生长和代谢的影响,结果见图4。在第0、2 d(延滞期)、4 d(对数生长初期)、6 d(对数生长后期)分别添加茉莉酸甲酯,得到的葡萄细胞干重分别为对照组干重(13 g/L)的76.0%、80.7%、91.5%、99.0%,可见在细胞生长后期添加茉莉酸甲酯对其自身的生长影响最小。而且根据HPLC 检测结果,在第6 d 添加茉莉酸甲酯,单位细胞白藜芦醇含量最高,为1 483 μg/g,说明茉莉酸甲酯与葡萄悬浮细胞的生长时期具有密切关系,在生长后期接受茉莉酸甲酯诱导信号的能力最强。在后续实验中将茉莉酸甲酯的添加时间调整到细胞生长对数后期进行。

图4 茉莉酸甲酯添加时间对醉金香葡萄细胞生长及产物合成的影响Fig. 4 Effect of adding time of MeJA on the cell growth and product synthesis of Vitis vinifera
2.1.4 不同激素类型和激素组合对葡萄悬浮细胞生长及次级代谢产物的影响 生长素和分裂素在一个适当比例下可以维持细胞良好的生长和胚性状态,其浓度水平也影响次级代谢产物的合成。考察了激素类型(NAA、6-BA、2,4-D、KT)、激素组合(NAA+6-BA、2,4-D+KT、NAA+KT、2,4-D+6-BA)对醉金香葡萄细胞悬浮培养生长以及白藜芦醇合成的影响情况,实验结果见图5。在含有单个激素的培养基中,葡萄细胞的干重和单位细胞白藜芦醇的含量均低于同时含有两种激素的培养基,可见细胞分裂素和细胞生长素的组合使用对葡萄细胞的影响更显著。培养液中添加不同的激素组合后,培养基的电导率差异明显。其中NAA+6-BA 的电导率(605.5 μS/cm)最低,葡萄细胞干重(15.55 g/L)最大。但葡萄细胞生长量和速率的高低与代谢产物合成之间不存在正相关关系。对白藜芦醇含量检测结果表明,含有激素的培养基无论是单个激素还是激素组合,都对白藜芦醇的合成起到了促进作用。其中2,4-D+6-BA 实验组的单位细胞白藜芦醇含量最高,达到了329.45 μg/g,比对照组(54.86 μg/g)提高约5 倍。综上所述,选择2,4-D+6-BA 激素组合用于后续醉金香葡萄悬浮细胞培养生产白藜芦醇的过程。

图5 不同激素类型和激素组合对醉金香葡萄细胞生长及产物合成的影响Fig. 5 Effect of different hormone types and combinations on cell growth and production of Vitis vinifera
2.2 多因素水平Plackett-Burman 筛选试验
以单位葡萄细胞中白藜芦醇含量作为评价指标。Plackett-Burman 试验结果如表3 所示,使用Design-Expert 软件对数据进行分析,得到实验设计方差分析结果,见表4,该模型P=0.000 5<0.05,表示该模型显著。因素影响的大小排序:MeJA>2,4-D>Yeast extract>PVP>6-BA。选 择Yeast extract(X3)、MeJA(X5)、2,4-D(X6)3 个因子进行最陡爬坡试验。
Plackett-Burman 各实验组中葡萄细胞的生长量和对底物的利用情况如图6 所示。和对照组干重(13 g/L)相比,其中第3、5、7、8、9、12 组培养结束时,收获的葡萄细胞干重大于对照组,第7 组的干重最高,为16.9 g/L,剩余几个组的干重都小于对照组,第11 组的干重最低。产物测定结果(表3)表明,单位葡萄细胞中白藜芦醇含量与葡萄细胞生物量呈现负相关的关系。第7 组的单位葡萄细胞中白藜芦醇含量最低,为301.20 μg/g,相比于只添加蔗糖的初始培养基中白藜芦醇含量(59.18 μg/g)提高了409%;相比于本次 Plackett-Burman 实验对照组中白藜芦醇含量降低了67%。根据对单位细胞白藜芦醇含量最高的第11 组的实验分析,单位细胞白藜芦醇含量的差异源于茉莉酸甲酯添加量的差异,添加量越多,诱导产生的白藜芦醇含量越高,相反,则会限制葡萄细胞自身的生长。而且结合模型显示(表4),茉莉酸甲酯是最显著的因素,可见茉莉酸甲酯的添加对葡萄细胞的生长和次级代谢产物的合成产生了重要的影响。
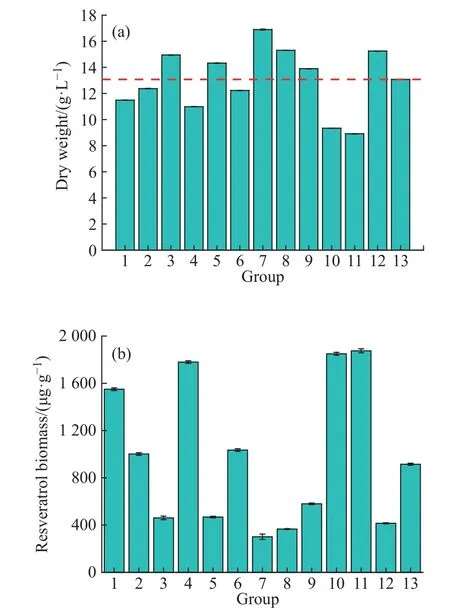
图6 Plackett-Burman 各实验组中白藜芦醇含量和醉金香葡萄细胞生长情况Fig. 6 Resveratrol biomass and cell of Vitis vinifera in Plackett-Burman experimental groups
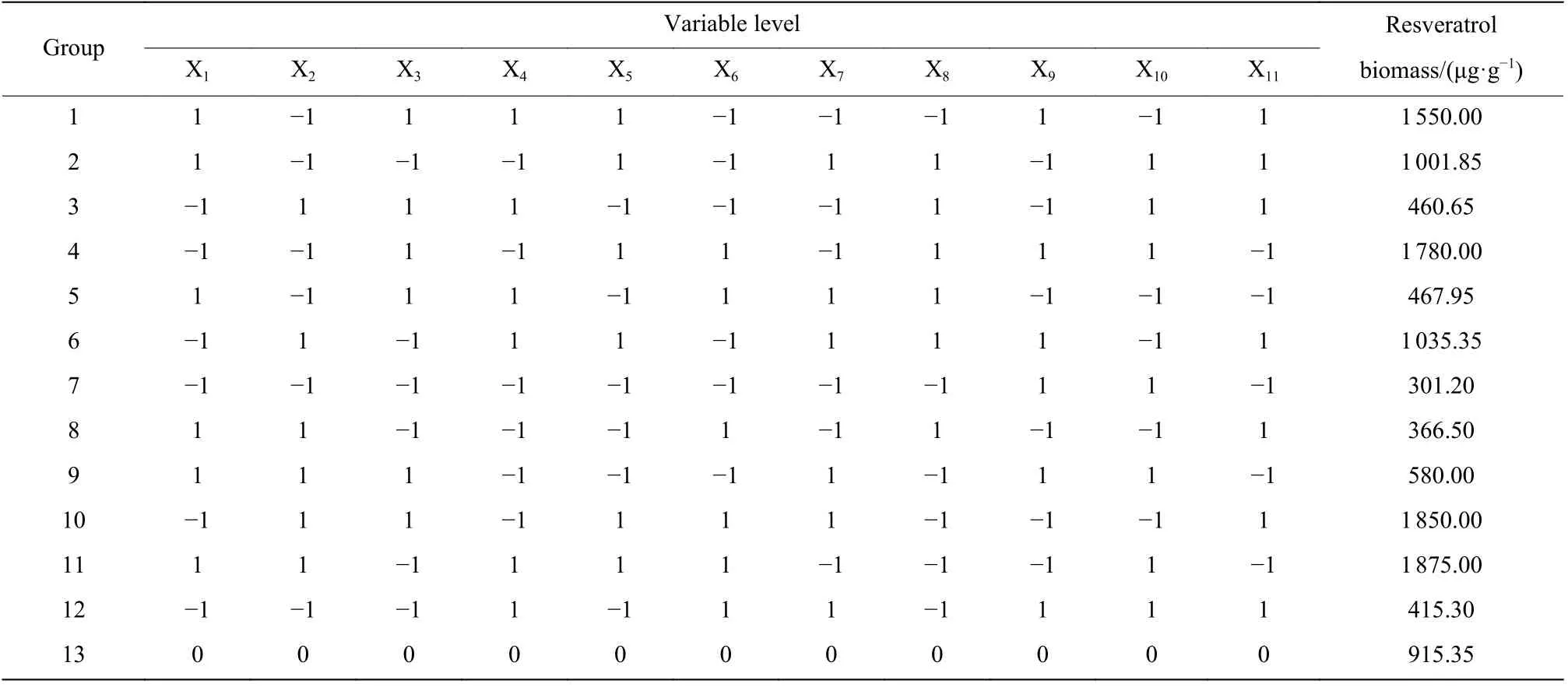
表3 Plachett-Burman 设计试验结果Table 3 Experiment results in Plackett–Burman design
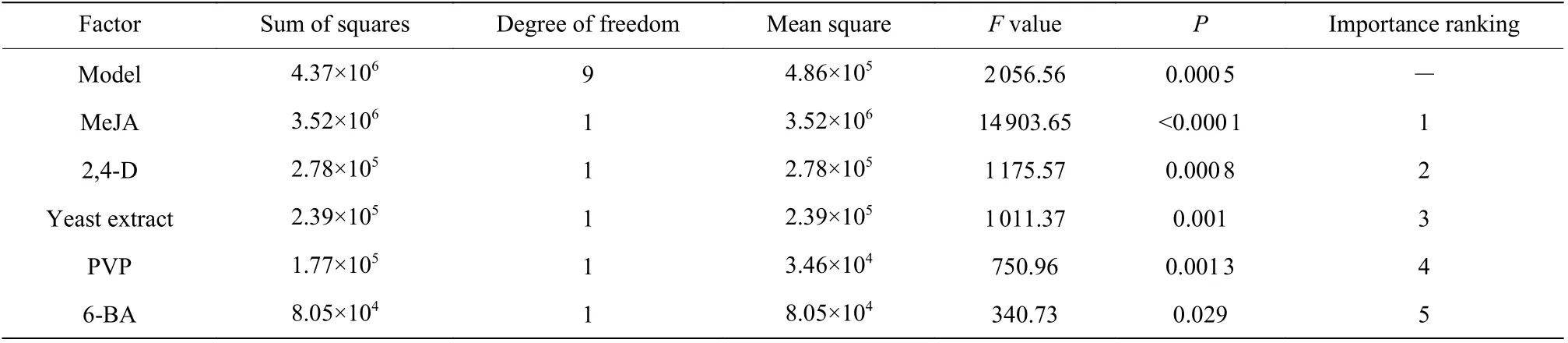
表4 Plachett-Burman 设计各因数效应分析Table 4 Regression results for the Plackett-Burman design
2.3 最陡爬坡实验
在Plackett-Burman 实验的基础上对 3 个最显著因素进行浓度爬坡试验(表5),结果显示:当酵母提取物、茉莉酸甲酯和2,4-D 的质量浓度分别为800 mg/L、80 μmol/L 和4.10 mg/L 时,单位细胞白藜芦醇的生物量达到了最大值(3 100μg/g),因此,选取该组浓度作为中心组合实验的中心点,进一步考察 3 个因子的浓度最优组合。

表5 最陡爬坡实验设计及结果Table 5 Design and result in steepest ascent path
2.4 Central-Composite 中心组合实验
通过中心组合设计(表2),考察了酵母提取物、茉莉酸甲酯和2,4-D 对醉金香葡萄细胞的最优化浓度配比。对实验结果(表6)进行统计分析,获得了以单位细胞白藜芦醇含量为目标函数的二次项线性回归方程、进行了各显著因子之间的三维响应面分析[21],并对得到的方程做方差分析和显著性检验(表7)。使用 Design Expert 8.0 软件进行数据分析,得到三元二次回归方程:Y=3 278.06-26.00A+88.01B-4.80C+211.43AB-31.72AC-12.35BC-258.71A2- 356.01B2-435.33C2。该方程的相关系数R2=0.940 1,线性拟合程度良好。P<0.000 1,说明该模型显著而有效,其中酵母提取物和茉莉酸甲酯在模型中影响最为显著。

表6 CCD 响应面设计及结果Table 6 Design and result of the central composite experiment
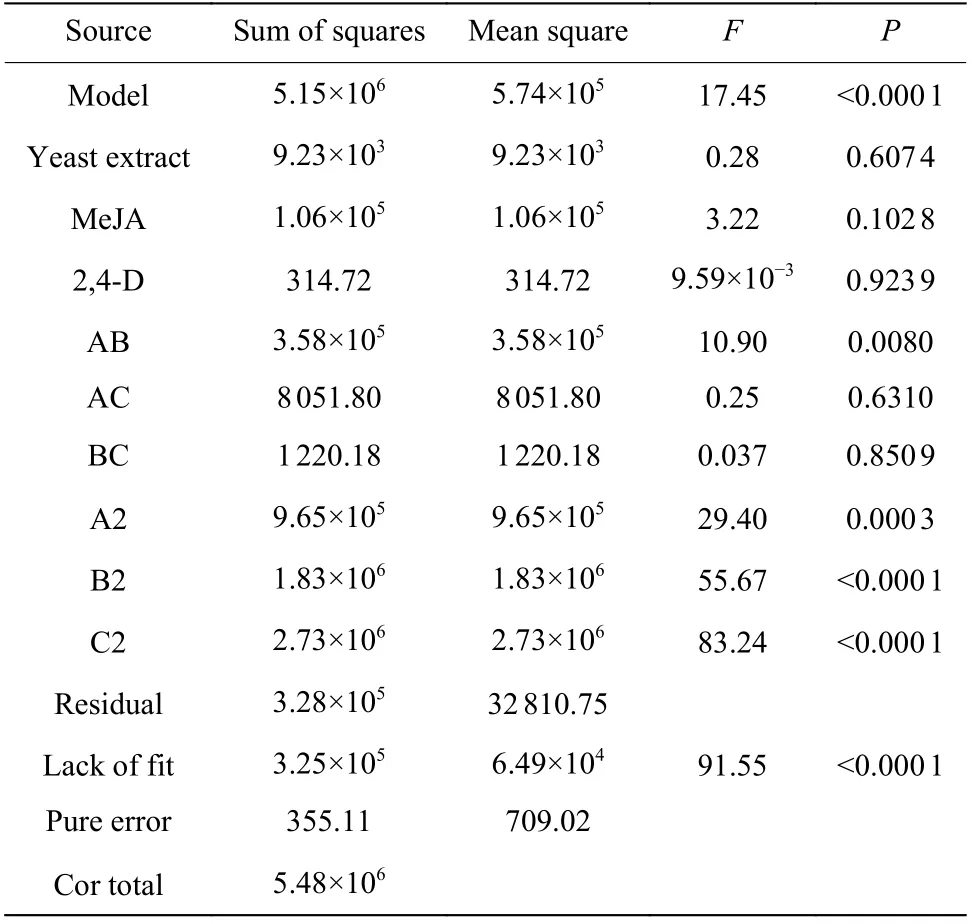
表7 CCD 试验方差分析Table 7 Variance analysis of central-composite design
酵母提取物、茉莉酸甲酯和2,4-D 这3 个因素中两两相互作用对白藜芦醇合成的影响结果见图7。其中酵母提取物与茉莉酸甲酯交互作用显著,当酵母提取物添加量在较低水平时,得到与较高的单位细胞白藜芦醇含量对应的茉莉酸甲酯的添加浓度为70 μmol/L;当酵母提取物添加质量浓度增加到900 mg/L 时,与单位细胞白藜芦醇最大含量对应的茉莉酸甲酯添加浓度为90 μmol/L。由此可知,酵母提取物与茉莉酸甲酯的交互作用呈正相关,在最合适范围内,调节酵母提取物与茉莉酸甲酯的关系可促进葡萄悬浮细胞合成白藜芦醇。除此之外,从等高线图可以看出图形呈椭圆形,交互作用显著[22]。根据上述分析及响应面软件预测,葡萄悬浮细胞最佳培养条件为:酵母提取物和茉莉酸甲酯以及2,4-D 的最优化浓度分别为900 mg/L、84.22 μmol/L和4.08 mg/L,预测单位细胞白藜芦醇的最高含量为 3 057.32 μg/g。
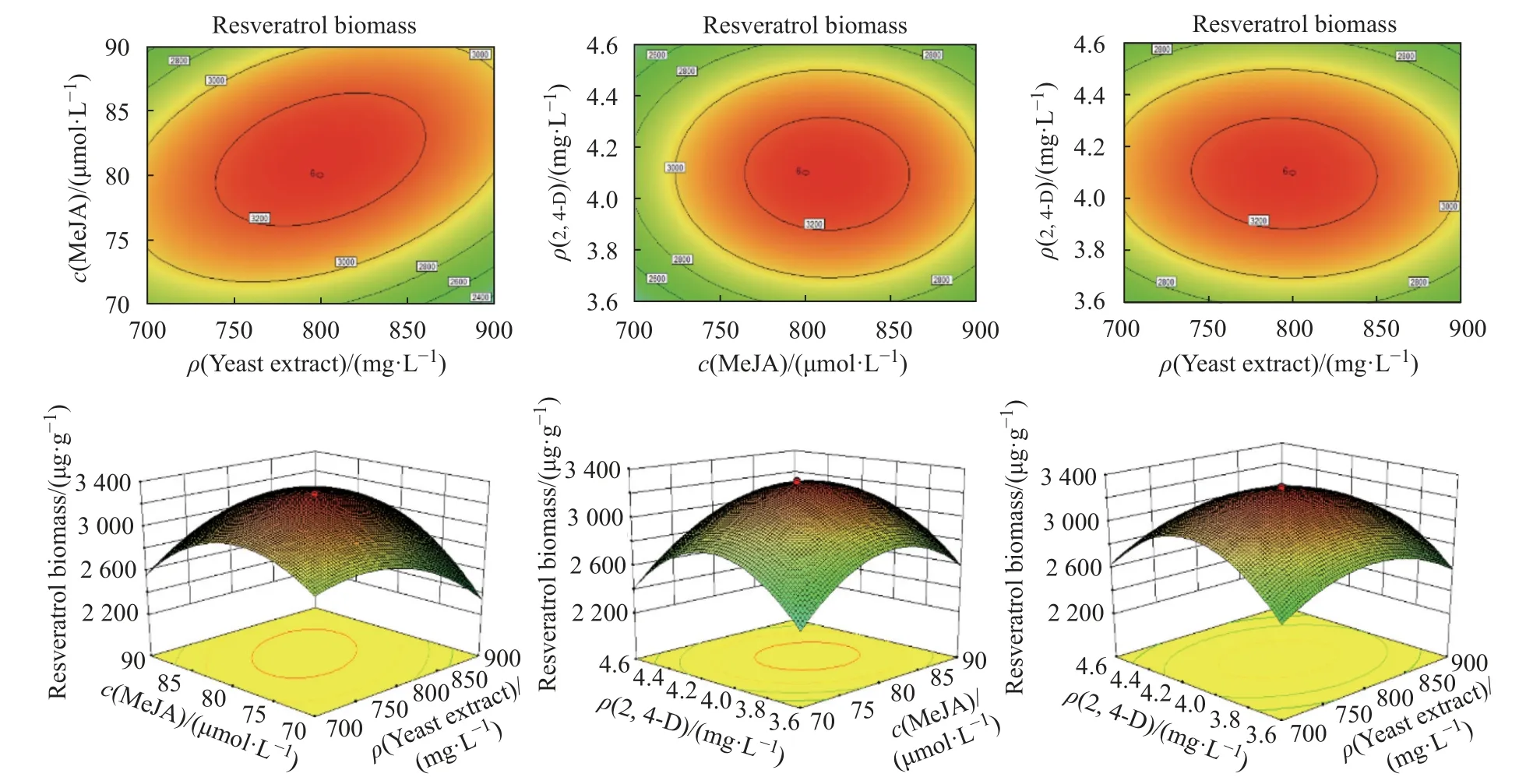
图7 酵母提取物、茉莉酸甲酯和2,4-D 交互作用对白藜芦醇合成影响的响应面和等高线Fig. 7 Response surface and contour of the interaction of yeast extract, methyl jasmonate and 2,4-D on resveratrol synthesis
为验证该模型预测的可靠性,在最优培养条件(结合实际培养条件,调整最优条件为酵母提取物900 mg/L、茉莉酸甲酯84 μmol/L、2,4-D 4.1 mg/L)下进行 3 次平行试验。结果显示,醉金香葡萄悬浮细胞经过培养后得到的单位细胞白藜芦醇含量为(3 026.64 ±56)μg/g,与响应曲面拟合所得方程的预测值相近,说明该模型较为合理,醉金香葡萄悬浮细胞合成白藜芦醇的含量明显提高,比优化之前提高了 51.13 倍,为后续深入研究葡萄悬浮细胞的功能特性及植物细胞的进一步生产应用提供了良好的研究基础。
3 结束语
白藜芦醇是多种药理作用植物的次生代谢产物。通过诱导植物细胞培养物,特别是葡萄的细胞培养物,可能会提供足够量的反式白藜芦醇且不需要用基因工程菌改造而直接利用植物细胞生产二苯乙烯类物质。本文通过统计学的实验设计对醉金香葡萄细胞的生长和次级代谢产物白藜芦醇的表达进行了培养基营养条件的优化,获得了醉金香葡萄悬浮细胞的最佳生长和代谢条件。在500 mL 摇瓶中及优化后的条件下进行验证实验,单位葡萄细胞的白藜芦醇表达量达到了(3 026.64±56)μg/g,与预测值吻合,较优化前提高了51.13 倍。
本文为深入分析葡萄悬浮细胞的功能特性提供了研究基础,也为通过葡萄悬浮细胞工艺进一步放大生产白藜芦醇等物质奠定了较好的基础。为实现可持续生产反式白藜芦醇和其他重要中间化合物,有必要对植物细胞的大规模培养工艺进行进一步优化,最终形成工业生产规模的高效生产工艺[15]。
