烷烃为底物合成槐糖脂发酵过程供氧控制优化
2022-04-29田锡炜庄英萍王泽建
刘 畅, 陈 阳, 田锡炜, 庄英萍, 储 炬, 王泽建
( 华东理工大学生物反应器工程国家重点实验室, 生物工程学院,上海 200237)
槐糖脂(Sophorolipids, SLs)是最具应用潜力的生物表面活性剂之一,具有高生物降解、低毒等特性,广泛应用于食品、化妆品、制药和石油工业中[1]。Candida bombicola(C.bombicola)是目前研究最为广泛的槐糖脂生产菌株[2]。槐糖脂是具有多种结构的混合物,由亲水的槐糖和含有16~18 个碳原子的疏水羟基脂肪酸按物质的量之比1∶1 组成[3],可以分为酸型和内酯型两种[4],其中乙酰化和非乙酰化、羟基脂肪酸链长度、脂肪酸不饱和度等因素对槐糖脂的结构和性能有所影响[5-9]。目前,因为化学方法生产的表面活性剂会带来一系列严重的生态问题[10-11],因而利用微生物源生产槐糖脂等表面活性剂的方法得到迅速发展,并从不同方面进行优化实现了槐糖脂的高效合成[12-14]。
葡萄糖、乳清、大豆糖蜜等可以作为槐糖脂合成的亲水性底物,而油脂、脂肪酸、烷烃等可以作为其合成的疏水性底物[15-16]。石油烃是石油的主要成分,其中大量的烷烃会对环境造成持续性污染[17],并严重危害人类健康[18]。正十六烷是常见的石油烃污染源,目前主要以物理法、化学法和生物法修复石油污染[19]。由于生物法具有绿色无污染、成本低等优点,因此,通过菌株利用烷烃合成槐糖脂,能够有效实现烷烃的降解,同时获得特定性能的槐糖脂产物。
槐糖脂合成是一个高耗氧的过程,氧气主要用于葡萄糖分解代谢、疏水性底物分解代谢和槐糖脂合成代谢。Guilmanov 等[20]通过对分批发酵合成槐糖脂过程中氧传质的研究,发现当氧传质速率在50~80 mmol/(L·h)时,槐糖脂产率最高,达到1~1.5 g/(L·h)。滕丽丽[21]通过基因工程手段提高菌株对氧气的亲和力,虽然在低供氧条件下提高了槐糖脂的产量,但在正常供氧条件下对槐糖脂产量的提高影响有限,表明槐糖脂的合成与胞内的多种因素有关。文献[22-23]认为在槐糖脂合成过程中,疏水性底物羟基化的P450 单加氧酶是主要限速步骤[22-23],而且葡萄糖和疏水性底物的氧化往往需要消耗大量的氧气以产生能量,因此探究不同供氧水平下槐糖脂生产菌株胞内代谢通量分布对深入认识细胞的氧代谢特性,优化发酵过程溶氧控制策略具有重要意义。
本文以正十六烷作为疏水性底物合成C16槐糖脂,并通过调节不同生产阶段的供氧水平,从宏观代谢差异结合胞内代谢通量和关键酶活性差异的整合分析,深入考察氧代谢对槐糖脂合成的影响,从而实现最适供氧水平下的槐糖脂发酵。
1 实验部分
1.1 材料和试剂
1.1.1 菌株及来源 假丝酵母菌C.bombicolaATCC 22 214 购于广州市菌株保藏中心,菌株在甘油质量分数为20%的甘油管中保存于-80 ℃冰箱中。
1.1.2 培养基和培养条件
(1)种子培养基(g/L):葡萄糖 50,KH2PO41,(NH4)2SO44,MgSO4·7H2O 0.5,玉米浆 10。
(2)发酵培养基(g/L):葡萄糖100,KH2PO41,(NH4)2SO44,MgSO4·7H2O 0.5,玉米浆 10。培养基经过115 ℃高温高压蒸汽灭菌30 min。
1.2 培养方法
种子培养在1 L 的挡板摇瓶中进行,加入200 mL培养基,在转速和温度分别为200 r/min 和25 ℃的摇床中培养48 h。
槐糖脂培养在5 L 的发酵罐中进行,初始体积为2.5 L,接种量为2.9%(体积分数),OD600为80。发酵温度为25 ℃,通气量为0.5 vvm,初始转速为300 r/min。培养过程中用4 mol/L NaOH 调节pH 为3.5。正十六烷通过补料泵添加到培养基中,每24 h添加1次固体葡萄糖,使葡萄糖质量浓度维持在30~80 g/L。发酵过程中前24 h 的转速控制在300 r/min,以维持菌体生长;高供氧组、低供氧组和优化组的转速分别控制在350、 280、 320 r/min,以实现不同的供氧水平。
1.3 分析方法
1.3.1 正十六烷含量测定 发酵液中正十六烷的含量使用气相色谱法检测[24]。首先,取3个平行样品(2 mL 发酵液)并添加相同体积的正己烷,振荡离心,萃取两遍,取上清用气相色谱仪检测。检测条件如下:进样口温度300 ℃,空气流量400 mL/min,氢气流量30 mL/min,尾吹气流量25 mL/min,分流比13.846∶1,分流流量90 mL/min。升温程序为初始150 ℃保持2 min;以40 ℃/min 的速率升温至220 ℃,保持3 min;以20 ℃/min 的速率升温至280 ℃,保持8 min。
1.3.2 槐糖脂产量和结构测定 槐糖脂产量采用高效液相色谱法检测,2 mL 发酵液与等体积的氢氧化钾/甲醇溶液(cKOH=4 mol/L)混合均匀,80 ℃水浴加热15 min,冷却至室温后,用甲醇和NaH2PO4缓冲液(0.2 mmol/L)定容至10 mL,将样品稀释到适当浓度进行高效液相色谱分析。流动相为:甲酸0.1%(体积分数),甲酸铵20 mmol/L,甲醇75%(体积分数),C18 色谱柱(4.6 mm×250 mm, Acchrom),示差折光检测器(RID),流速0.9 mL/min,进样体积20 μL,柱温50 ℃,检测温度35 ℃。利用乙酸乙酯萃取正十六烷发酵液中的槐糖脂,旋转蒸发得到的槐糖脂固体用于检测槐糖脂的抗菌性、表面张力和乳化性等。槐糖脂用乙醇溶解后采用高效液相色谱-质谱法检测其结构,检测方法与Chen 等[25]描述的方法一致。
1.3.3 葡萄糖和生物量测定 葡萄糖浓度采用生物传感分析仪(SBA-40C,山东省科学院)进行检测。将萃取过槐糖脂的下层发酵液用乙醇溶液(乙醇与水的体积比1∶1)洗涤两遍,在4 000 r/min 转速下离心2 min。然后,在80 ℃烘箱中烘干,称取菌体干重(DCW)。
1.3.4C.bombicola中心碳代谢网络模型构建 槐糖脂合成过程中胞内中心的碳代谢通量采用化学计量学方法进行计算,其前提假设是胞内代谢物浓度守恒,即代谢物的利用速率和生成速率在数值上是相等的。通过分析代谢通量可以得到胞内代谢通量分布图,从而展示每一个代谢反应的流量值以及代谢通量的整体分布状况。建立假丝酵母合成槐糖脂的代谢网络模型,拟耦合以下途径:糖酵解途径、磷酸戊糖途径、三羧酸循环途径、糖异生途径、脂肪酸从头合成途径、脂肪酸β-氧化途径、烷烃氧化途径和槐糖脂合成途径。假设槐糖脂合成阶段胞内中间代谢物都处于拟稳态,考虑代谢网络中碳总量平衡。胞外检测氧气、葡萄糖和烷烃的消耗速率,槐糖脂和二氧化碳的生成速率,以及副产物乳酸、琥珀酸、丙酮酸和柠檬酸的生成速率。代谢网络中相关化合物对照表、代谢通量反应方程式分别见表1 和表2。

表1 代谢网络中相关代谢物对照表Table 1 Comparison table of related compounds in metabolic network

表2 代谢通量方程式Table 2 Metabolic flux equation
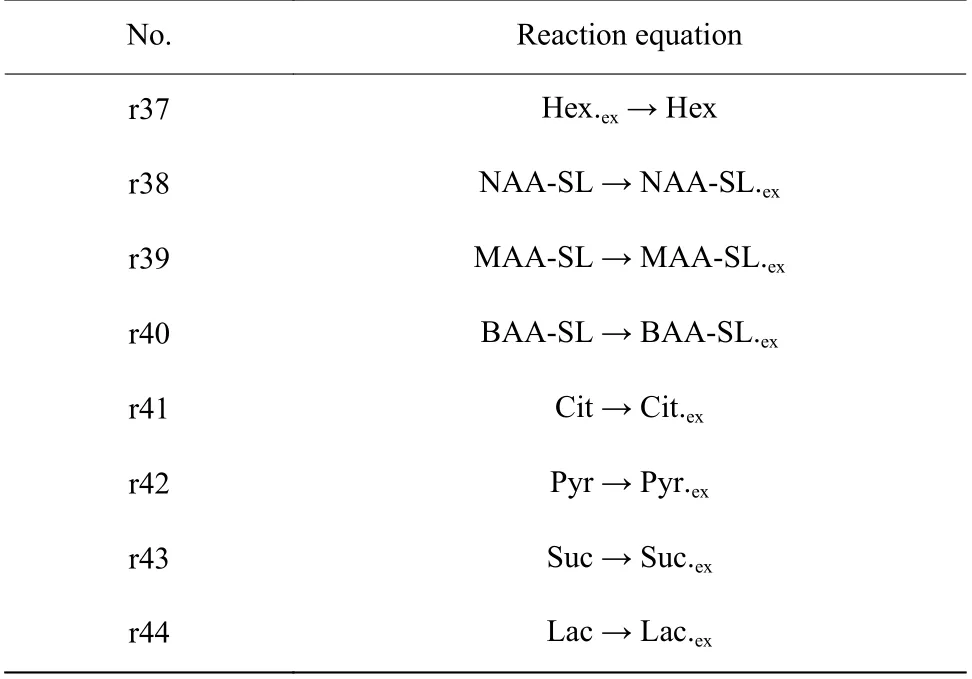
续表2
1.3.5 关键酶活性测定 (1)P450 单加氧酶[26]:通过一定量的P450 单加氧酶催化正十六烷转化成正十六醇,以其间烟酰胺腺嘌呤二核苷酸磷酸(NADPH)的消耗量来定义酶活。添加150 μL 磷酸盐缓冲液(PBS),再添加20 μL 1 mmol/L 的NADPH 溶液,20 μL 3 mg/L 的底物正十六烷,最后添加10 μL破碎酶系,30 ℃反应30 min。反应完毕在340 nm 处测量并读取吸光度值。
(2)脂肪醇氧化酶(FAO)[27]:利用醇氧化酶将正十六醇氧化生成正十六醛,催化反应如下: R-OH +O2→ RO + H2O2,在含有2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)以及过氧化物酶的缓冲体系中发生颜色反应,使体系中的液体由无色转变为蓝绿色,在加入含有酶以及相应的长链脂肪醇溶液后,测定405 nm 处的吸光度值,定量测定醇氧化酶的活性。将2 mL pH 7.0 的Na2HPO4/NaH2PO4缓冲液、0.8 mL 3 mmol/L的ABTS 溶液、60 μL 的过氧化物酶和40 μL的粗提酶液混合,分别加入到两个比色皿中,将其中一个比色皿中的混合液作参比,向另一个比色皿中加入100 μL 底物(1.5 mmol/L 正十六醇乙醇溶液),记录405 nm 处吸光度值的变化。
1.3.6 氧摄取速率(OUR)、二氧化碳释放速率(CER)的检测 发酵尾气中氧气和二氧化碳含量采用尾气过程质谱仪(MAX300-LG,美国Extrel 公司)进行检测,CER、OUR 及其比值RQ分别通过公式(1)、(2)和公式(3)计算[28]。

式中,Fin表示进气流量(mmol/L),V表示发酵液初始体积(L),cinert,in表示进气中惰性气体的浓度(mmol/L),cO2,in,cO2,out表示尾气中氧气的浓度(mmol/L),cCO2,in,cCO2,out表示尾气中二氧化碳的浓度(mmol/L),Tin表示进气温度,pin表示进气压力,h代表尾气湿度。OUR和CER 的单位为mmol/(L·h)。
文中槐糖脂产量、葡萄糖消耗量和烷烃消耗量均已进行标准化处理(以初始体积计)。所有实验重复3 次,图和表中数据均为3 次实验的平均值。采用Origin 8.0 和SPSS 19.0 进行统计学分析。
2 结果与讨论
2.1 不同供氧水平下以烷烃为底物合成槐糖脂的发酵过程参数变化
图1 示出了不同供氧水平下以烷烃为底物合成槐糖脂的发酵过程的参数变化。如图1(a)所示,在发酵进行到24 h 时通过调节转速(n)降低供氧水平,使OUR 降低为高供氧组的1/2(OUR 约为24 mmol/(L·h))。由于此时细胞已经进入稳定期,因此供氧水平的调节对最大生物量没有显著影响,高供氧组和低供氧组两个组别下的最大细胞干重均为18 g/L 左右(图1(b))。相比之下,供氧水平对槐糖脂合成则影响较大,在低供氧条件下,槐糖脂产量只有55.0 g/L,比高供氧条件下降低了30.5%(图1(c))。此外,从发酵过程主要指标参数的比较结果来看(表3),虽然低供氧组的槐糖脂比总底物消耗得率(YSLs/substrate)和比葡萄糖消耗得率(YSLs/Glc)分别比高供氧组的相应值降低了15.9%和33.8%,但是其槐糖脂比烷烃得率(YSLs/Alk)却比高供氧组提高了37.3%,这表明在低供氧条件下,细胞对于烷烃底物的利用更有经济性,而且更多地依赖于葡萄糖底物用于维持代谢和合成代谢所需能量的供应。值得注意的是,通过在线检测CER 和RQ的变化也能够很好地反映出细胞代谢途径的改变,虽然发酵进行到24 h 时低供养组的OUR 水平降低为高供氧组的一半,但是CER 值却只降低到高供氧组大约62.6%的水平,相对应的RQ值也开始表现出明显的差异(图1(d)),高供氧组和低供氧组在槐糖脂生产期的RQ值基本稳定在0.56 和0.74。通过理论计算可知,当葡萄糖完全氧化时,RQ值为1;当十六烷烃完全氧化时,RQ值为0.65。由于槐糖脂合成途径也是耗氧步骤,因此,这在一定程度上表明低供氧组有更多葡萄糖被完全氧化用于能量合成,RQ值有望作为一个潜在的细胞代谢表征参数用于槐糖脂合成过程的进一步优化。

表3 不同供氧水平下发酵过程关键参数比较Table 3 Comparison of key parameters under different oxygen supply levels during the fermentation process
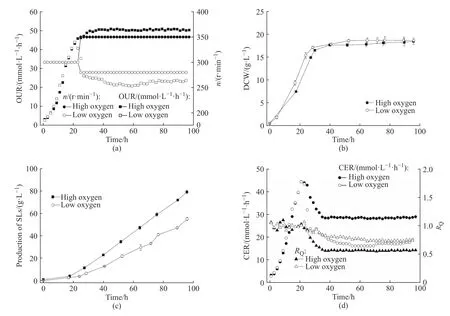
图1 以烷烃为底物合成槐糖脂的发酵过程参数变化Fig. 1 Parameter changes of sophorolipids synthesis using alkanes as substrates during the fermentation process
2.2 不同供氧水平下胞内代谢通量和关键酶活性分析
针对不同供氧条件下细胞对不同底物的利用水平差异,建立了槐糖脂合成阶段(72~96 h)代谢网络模型(图2),其中高供氧组和低供氧组的碳回收率分别约为100.9%和95.1%(表4),因此,可以通过图2利用化学计量法计算槐糖脂合成过程中胞内各物质的代谢流量。如图2所示,在槐糖脂合成菌株中主要有3 条关键代谢途径:葡萄糖分解代谢途径、脂肪酸β氧化代谢途径和槐糖脂合成途径。其中葡萄糖参与磷酸戊糖途径和分解氧化途径分别提供NADPH和胞内维持能;而脂肪酸参与β氧化代谢途径主要提供槐糖脂合成的乙酰辅酶A 和胞内维持能。

图2 不同供氧条件下槐糖脂发酵过程的代谢网络模型(上下数据分别为高供氧组和低供氧组的代谢通量)Fig. 2 Metabolic network model of sophorolipids fermentation process under different oxygen conditions (The upper and lower data represent the metabolic flux of the high oxygen group and the low oxygen group, respectively)
首先,在低供氧条件下,细胞摄取烷烃的量降低了57.6%(表4),主要原因是供氧受限,P450 单加氧酶和长链FAO 的平均酶活分别降低了71.1%和74.5%(图3),从而使烷烃氧化成为槐糖脂合成的主要限速步骤。其次,低供氧组中槐糖脂合成受限导致对胞内NADPH和乙酰辅酶A 的需求量降低,从而使脂肪酸参与β氧化途径的比例降低了13.6%,参与槐糖脂合成途径的比例提高。同样地,葡萄糖参与磷酸戊糖途径的比例也降低了55.5%,其更多地进入糖酵解过程以提供细胞维持能。相比之下,在高供氧水平下,槐糖脂合成需要更多的NADPH 和乙酰辅酶A,使烷烃流向β氧化途径的比例提高,不仅生成更多的乙酰辅酶A,而且也提供大量的细胞维持能。此外,葡萄糖主要参与槐糖脂的合成途径及磷酸戊糖途径以提供前体和NADPH。最后,在不同供氧水平下胞内烷烃和葡萄糖参与分解氧化和槐糖脂合成途径的比例不同,表现在宏观RQ值上也会有所差异。因此,RQ可以作为一个胞内代谢表征的参数用于在线监测槐糖脂合成过程中胞内物质分配以及发酵过程中供氧的适配性。槐糖脂合成是胞内能量、NADPH、乙酰辅酶A 和氧气供给等多种因素共同影响的结果,通过基因工程手段简单地提高或限制某一基因可能难以提高槐糖脂产量[29]。从代谢物网络模型可知,提高槐糖脂合成可以通过以下几个方面共同调控:(1)提高磷酸戊糖的通量从而提高胞内NADPH 供给;(2)提高P450 单加氧酶的酶活以提升整个槐糖脂合成的速率;(3)强化柠檬酸裂解酶的活性(强化柠檬酸转运体系)以提高槐糖脂合成乙酰辅酶A 的供给等[5,30-31]。

图3 不同供氧条件下槐糖脂发酵过程关键酶活Fig. 3 Key enzyme activities in the sophorolipids fermentation process under different oxygen conditions
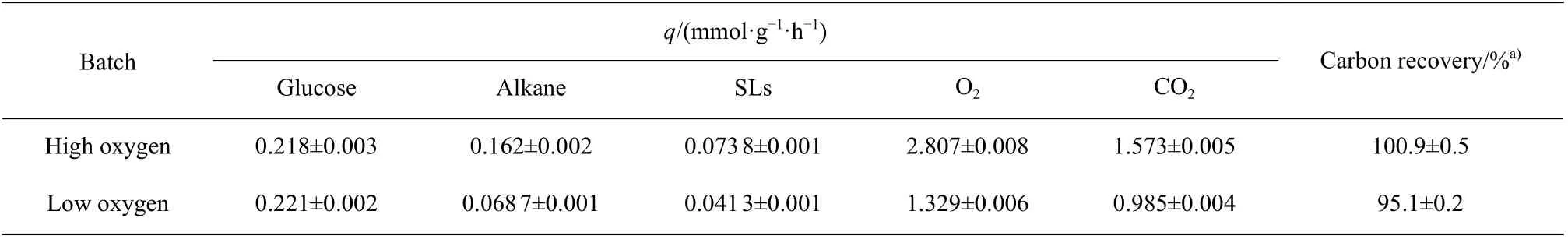
表4 不同供氧水平下菌株72~96 h 的比速率和碳回收率Table 4 Specific rate and carbon recovery rate of strains under different oxygen levels at 72-96 h
2.3 槐糖脂发酵过程供氧策略优化
通过阶段性调整槐糖脂发酵过程的搅拌速度,能够实现不同的供氧水平(图4(a))。随着搅拌速度逐渐上升,槐糖脂发酵过程中OUR 不断增加,但RQ值表现出逐渐降低的趋势,与上述代谢网络模型分析结果一致。此外,从槐糖脂产率(图4(b))可以看出,当OUR 小于45 mmol/(L·h)(即发酵时间85~95 h)时,槐糖脂产率显著降低,表明此时细胞受到供氧水平的限制;而OUR 达到45 mmol/(L·h)之后,槐糖脂产率基本保持在1.14 g/(L·h)左右,说明此时可能存在其他的限制因素导致产率无法进一步提高。从RQ值变化(图4(a))上可以看出,即使产率不变时,RQ仍进一步降低,表明疏水和亲水底物的利用效率依旧会随着改变,葡萄糖主要合成槐糖脂,而烷烃参与胞内维持能的供给比例提高。因此,在后续研究中将OUR 维持在45 mmol/(L·h)左右,此时RQ值为0.62(图5)。比较表5 和表3 可知,优化后槐糖脂最终产量达到83.8 g/L,整个发酵过程平均产率为0.87 g/(L·h),较优化前高供氧组分别提高了5.9%和4.8%。而且与优化前高供氧组相比,优化组的葡萄糖底物利用率虽然略微下降,但是烷烃利用率上升,因此与相对廉价的葡萄糖消耗相比,优化组更具有生产经济性。此外,优化组转速(320 r/min)较高供氧组转速(350 r/min)降低了8.6%,因此在一定程度上降低了功率输入,从而减少了能耗。

图4 槐糖脂发酵过程阶段性调整Fig. 4 Phase adjustment of sophorolipids fermentation process

图5 优化后槐糖脂发酵参数Fig. 5 Sophorolipids fermentation parameters after optimization

表5 优化后发酵过程关键指标参数Table 5 Key parameters of fermentation process after optimization
3 结 论
(1)研究了不同供氧条件下烷烃合成槐糖脂的代谢差异,并通过代谢通量计算和关键酶活性分析,发现氧气供给对细胞脂肪酸和羟基脂肪酸的合成具有重要影响,从而造成细胞对于葡萄糖和烷烃利用率的差异,在线参数RQ值能够很好地反映这一变化,后续可以把RQ作为重要的过程调控参数来进一步优化槐糖脂发酵过程。
(2)在合成期提供最适的供氧水平,能够有效提高底物利用的经济性,并且减少功率输入,从而降低能耗。
