降温速率对斑石鲷无水保活过程中生理应激的影响
2022-04-28华茂圳黄宝生俞涛涛蒋乐霞张家国张长峰孙崇德
华茂圳,黄宝生 ,俞涛涛,蒋乐霞,张家国 ,张长峰,孙崇德
(1. 上海海洋大学水产科学国家级实验教学示范中心,上海 201306;2. 山东省农产品贮运保鲜技术重点实验室,山东 济南 250103;3. 国家农产品现代物流工程技术研究中心,山东 济南 250103;4. 广东海洋大学,广东 湛江 524000)
0 引言
【研究意义】斑石鲷(Oplegnathus punctatus),俗称斑鲷、花金鼓、黑金鼓,极具食用与医用价值,肉质独特,口感丰富,富含多种氨基酸与不饱和脂肪酸,可用于治疗脾肾虚寒、产后腰痛、阴虚消渴等,食用方法以刺身为主,在日本料理中具有“刺身绝品”之誉[1],是极具商业价值的优质海水鱼。其中鲜活斑石鲷售价最高,可达200 元·kg−1[2]。但当前斑石鲷的运输还是停留在有水运输阶段,运输过程需要大量的水辅助,运输途中由于斑石鲷的呼吸和排泄,水质快速恶化,斑石鲷产生严重应激反应,损伤免疫系统,导致大量死亡,运输成活率偏低。因此如何减缓运输途中的应激反应,提高成活率,满足市场需求,具有重要研究价值。【前人研究进展】无水活运技术是一种绿色环保、无污染、安全、优质和高效的新型冷链活体物流技术[3]。该技术是通过物理降温手段使活体处于休眠或半休眠状态,降低新陈代谢速率,减缓应激反应,实现长时间运输的同时,提高存活率[4−6]。研究表明[7−10],物理降温诱导休眠可以有效提高牙鲆(Paralichthysolivaceus)、大菱鲆(Scophthalmus maximus)、半滑舌鳎(Cynoglossus semilaevis)、鲫 鱼(Carassius auratus auratus)、珍珠 龙 胆 石 斑 鱼 (♀Epinephelusfuscoguttatus×♂Epinepheluslanceolatus)、鲮鱼(Cirrhinus molitorella)、尼罗罗非鱼(Oreochromis niloticus)、黑鲷(Acanthopagrus schlegelii)等鱼类的运输时长和存活率,保证肌肉品质的同时,有效降低皮质醇、肾上腺素等激素的质量浓度,缓解应激反应和机体损伤。以上研究充分说明部分水产品可以通过降温诱导休眠的方式无水保活,但降温方式多采用循环水系统或冷水机降温,方式粗糙,难以实现精准恒定降温速率降温。降温速率的变化对鱼类的应激反应和品质产生一定的影响,张玉晗[4]等发现不同降温速率对花鲈无水保活效果差异显著,3 ℃·h−1降温处理的花鲈肝脏损伤程度低于1、5 ℃·h−1降温组,这与加州鲈、鲫鱼的研究结果一致[10−11]。【本研究切入点】目前,关于不同降温速率对斑石鲷无水保活过程中生理应激反应的影响还缺乏相关研究。【拟解决的关键问题】通过国家农产品现代物流工程技术研究中心自主研发的鲜活水产品智能冷驯化唤醒箱,精准控制降温速率,通过比较不同降温速率条件下不同保活时间对鱼体生理代谢指标和应激反应的代表性激素变化情况,确定合理的降温方法,为斑 石鲷无水保活提供理论基础。
1 材料与方法
1.1 材料与试剂
试验用斑石鲷购自山东莱州明波水产公司,挑选健康活跃、体表无损伤、大小均匀的60 尾成鱼用于试验,个体初始体重(330 ± 46) g,暂养于国家农产品现代物流工程技术研究中心水产品控温循环水过滤系统中,水温(18 ± 1 )℃,溶氧为6 mg·L−1以上,pH 为7~8,盐度为31‰,暂养2 d 后进行试验。
鱼皮质醇(Cortisol)酶联免疫检测试剂盒、鱼肾上腺素(E)酶联免疫检测试剂盒、MDA 检测试剂盒、乳酸(LAC)测试盒、糖原(Glycogen)测定试 剂盒购自南京建成生物工程研究所。
1.2 仪器与设备
全自动生化分析仪BK-280,山东博科生物产业有限公司;紫外分光光度计T9S,北京谱析通用仪器有限责任公司;Multiscan MK3 酶标仪,赛默飞世尔(上海)仪器有限公司;台式高速冷冻离心机H205OR,湖南湖仪实验室仪器开发有限公司;医用低温保存箱DW-86L626,青岛海尔生物医疗股份有限公司;鲜活水产品智能冷驯化/唤醒箱,山东省农产品贮运保鲜技术重点实验室自主研发(专利号ZL201310447777.8);人工气候箱QHX-300BSH-Ⅲ,上海新苗医疗器械制造有限公司;水产养殖及循环水处理系统,青岛中科海水处理设备工程有限公司;高速振荡机CM-1000,上海爱朗仪器有限公司;数显恒温水浴锅HH-S4,金坛市医疗仪器厂;电子天平JZ-06-004,上海菁海仪器有限公司;优普系列超纯水器UPR-11-10T;塑料自封袋、充气泵、数字温度计、秒表、5 mL 注射器 、解剖刀、纱布、抗凝管。
1 .3 试验方法
1.3.1 冷驯化处理 通过自主设计的冷驯化智能降温装置完成对斑石鲷的冷驯化[12]。装置按照1、3、5 ℃·h−1降温速率将暂养池中的水温从17.5~18.5 ℃降至生态冰温点10 ℃,各组降温时长分别为7.8 h、2.5 h、1.6 h,此时斑石鲷呼吸频率(33±3) 次·min−1,失去平衡,腹部向上,鱼鳃不能完全闭合,应激反应微弱,呼吸不规律,伴随鱼体剧烈扭动,对触及反 应已无明显响应。
1.3.2 无水保活 冷驯化处理后的斑石鲷装入内壁湿润的自封袋内,将空气排空后,用封口机对塑料袋封口,充入氧气,放进人工气候箱进行无水保活,保活温度根据前期的预试验结果设定为10 ℃。试验组共分为3 组,每组样品30 条。取样时间点为:无水保活0 h、2 h、4 h、6 h,各个时间点观察记录一次 成活率并随机取出3 尾鱼取样进行指标测定。
1.3.3 指标测定 斑石鲷从人工气候箱中取出后,尾静脉取血,用规格为1 mL 的一次性注射器取血5 mL 以上,取出的血液在4 ℃冰箱放置5 h 后,4 ℃、12 000 r·min−1离心15 min,取上清液放入 80 ℃冰箱保存,取完血的斑石鲷放置在盛有冰块的托盘中解剖,取出肝脏和肌肉,放入80 ℃冰箱保存。
(1)血清中皮质醇、肾上腺素的测定
分别采用鱼皮质醇(Cortisol)酶联免疫检测试剂盒、鱼肾上腺素(EPI)酶联免疫检测试剂盒检测血清中皮质醇质量浓度(ng·mL−1)和肾上腺素质量浓度(ng·mL−1)。测定斑石鲷降温前肾上腺素和皮质醇质量浓度值分别为(45.34 ± 2.16) ng·mL−1、(58.09 ± 4.07) ng·mL−1。
(2)肝糖原、肌糖原、乳酸含量的测定
采用糖原(Glycogen)测定试剂盒分别检测肝脏中肝糖原含量(mg·g−1)和肌肉中肌糖原含量(mg·g−1);采用乳酸(LAC)测试盒检测血清中乳酸含量(mmol·L−1)。测定斑石鲷降温前肝糖原、肌糖 原、乳 酸 含 量 分 别 为(15.17 ± 2.56) mg·g−1、(1.38 ± 0.11) mg·g−1、(4.34 ± 0.46) mmol·L−1。
(3)血清生化指标的分析
制备好的血清采用全自动生化分析仪测定生化指标,项目包括谷草转氨酶(AST)、谷丙转氨酶(ALT)、血糖(GLU);采用丙二醛(MDA)测试盒检测血清中丙二醛含量(nmol·mL−1)。测定斑石鲷降温前谷草转氨酶、谷丙转氨酶、血糖、丙二醛 含 量 分 别 为(113.06 ± 4.27) U·L−1、(17.45 ±2.47) U·L−1、(4.35 ± 1.24) mmol·L−1、(1.45 ± 0.23)n mol·mL−1。
1.4 数据处理
应用SPSS 22.0 软件对数据进行统计分析,显著性差异采用Duncan 多重比较法,图表的绘制采用O rigin 2018 软件。
2 结果与分析
2.1 不同降温速率对斑石鲷无水保活过程中存活率的影响
如表1 所示,斑石鲷经过冷驯化后无水保活,各处理组存活率明显下降,分别为60%、76.7%、46.7%。其中,5 ℃·h−1降温组在保活2 h 便出现死亡现象,且随着保活时间的延长,存活率不断下降,为3 个处理组中最低。3 ℃·h−1降温处理组经过6 h 无水保活过程后,存活率最高,但仍与业界期望值存在差距。
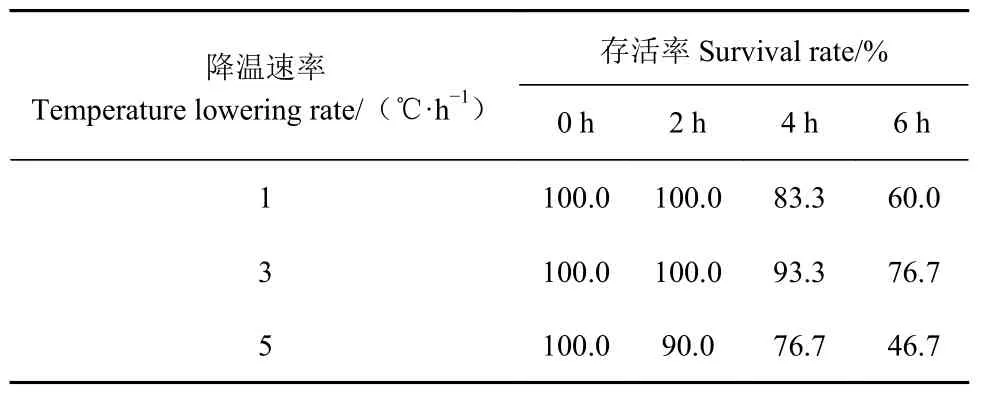
表1 不同降温速率下斑石鲷保活不同时间的存活率Table 1 Survival rates of O. punctatus chilled at various temperature lowering rates out-of-water for different durations
2.2 不同降温速率对斑石鲷无水保活过程中肾上腺素和皮质醇的影响
如表2 所示,与斑石鲷降温前肾上腺素质量浓度(45.34 ± 2.16) ng·mL−1相比,各处理组试验鱼无水保活0 h,血清肾上腺素质量浓度均明显升高。无水保活过程中,3、5 ℃·h−1降温处理组血清肾上腺素呈下降趋势,1 ℃·h−1降温处理组呈现先上升后下降的趋势。无水保活0 h,5 ℃·h−1降温处理组血清肾上腺素质量浓度显著高于1、3 ℃·h−1降温组(P<0.05);无水保活6 h,3 ℃·h−1降温处理组血清肾上腺素质量浓度显著低于1 ℃·h−1降温处理组,与5 ℃·h−1降温处理组无显著差异(P>0.05)。无水保活过程中,3 ℃·h−1降温处理组血清肾上腺素质量浓度除无水保活0 h 外,均显著低于1 ℃·h−1降温处理组(P<0.05)。同时,比较无水保活4~6 h, 1、3、5 ℃·h−1降温处理组斑石鲷肾上腺素含量分别下降了56.9%、11.24%、25.26%。

表2 不同降温速率对斑石鲷无水保活中血清肾上腺素和皮质醇质量浓度的影响Table 2 Effects of chilling rate on serum epinephrine and cortisol contents in survived O. punctatus under treatments
如表2 所示,冷驯化结束后,各处理组对比斑石鲷降温前皮质醇质量浓度[(58.09 ± 4.07)ng·mL−1]均升高。1、3 ℃·h−1降温处理组皮质醇质量浓度随保活时间延长总体呈现上升趋势,5 ℃·h−1降温处理组呈现下降趋势。无水保活0 h,5 ℃·h−1降温处理组斑石鲷皮质醇质量浓度显著高于1、3 ℃·h−1降温组(P<0.05)。保活4 h 后,1、3 ℃·h−1降温处理组皮质醇分别上升27.17%、30.98%。无水保活6 h,5 ℃·h−1处理组血清皮质醇质量浓度显著低于1 ℃·h−1处 理组(P<0.05)。
2.3 不同降温速率对斑石鲷无水保活过程中AST、ALT 和MDA 活力的影响
如表3 所示,无水保活0 h,1、3、5 ℃·h−1降温处理组斑石鲷AST、ALT 活力均明显高于初始值[(113.06 ± 4.27) U·L−1、(17.45 ± 2.47) U·L−1]。同时,各试验组血清AST、ALT 活力呈现上升趋势。无水保活0 h,3 ℃·h−1降温处理组斑石鲷血清AST、ALT 活力整体低于1、5 ℃·h−1降温组。无水保活2~6 h,3 ℃·h−1降温处理组斑石鲷血清AST、ALT 活力显著降低(P<0.05)。

表3 不同降温速率对斑石鲷无水保活中血清谷草转氨酶、谷丙转氨酶和丙二醛活力的影响Table 3 Effects of chilling rate on serum AST, ALT, and MDA activities in survived O. punctatus under treatments
如表3 所示,冷驯化结束后,试验组MDA 含量较降温前(1.45 ± 0.23) nmol·mL−1均增加,且随着保活时间的延长,MDA 含量呈现稳定上升趋势,3 ℃·h−1降温处理组MDA 增长速度整体平稳于1、5 ℃·h−1降温处理组。无水保活0 h 及6 h,3 ℃·h−1降温处理组 MDA 含量显著低于1、5 ℃·h−1降温组(P<0.05)。
2.4 同降温速率对不斑石鲷无水保活过程中血糖、肝糖原、肌糖原和乳酸的影响
如表4 所示,各组降温结束后斑石鲷血糖含量明显高于降温前含量[(4.35 ± 1.24) mmol·L−1],随保活时间的延长,1、5 ℃·h−1处理组血糖呈先上升后下降的趋势,3 ℃·h−1处理组呈上升趋势。无水保活0 h,5 ℃·h−1降温处理组血糖含量显著高于1、3 ℃·h−1降温组(P<0.05)。无水保活6 h,1、5 ℃·h−1降温处理组对比无水保活4 h,血糖含量分别下降7.5%、39.09%,3 ℃·h−1降温处理组血糖含量继续上升。
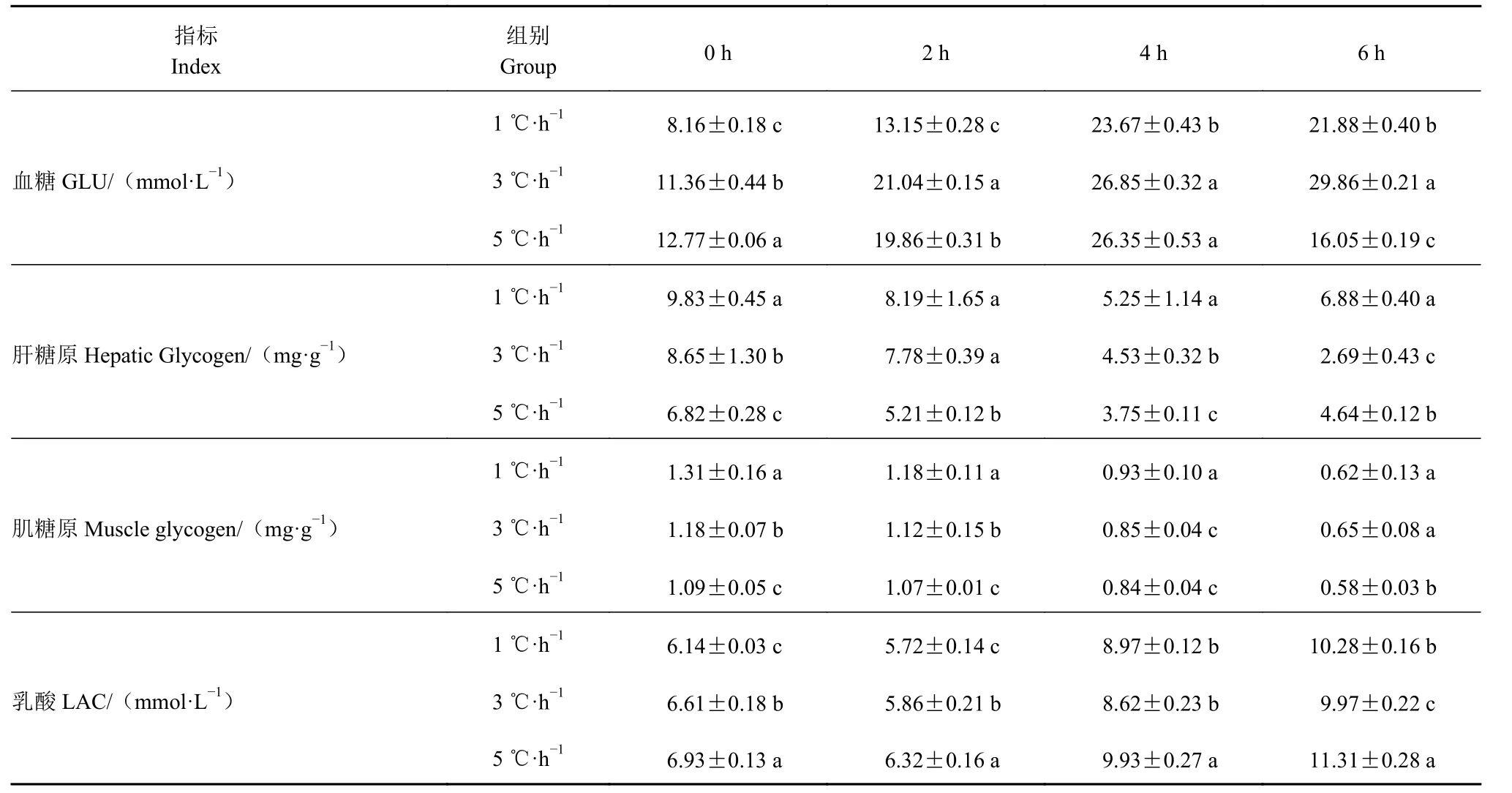
表4 不同降温速率对斑石鲷无水保活中血糖、肝糖原、肌糖原和乳酸含量的影响Table 4 Effects of chilling rate on GLU, hepatic glycogen, muscle glycogen, and LAC contents in survived O. punctatus under treatments
如表4 所示,无水保活0 h,各降温试验组斑石鲷肝糖原均明显低于降温前含量[(15.17 ± 2.56)mg·g−1],随着保活时间的延长,3 个试验组呈现下降的趋势,与血糖的趋势相反。无水保活4~6 h,1、5 ℃·h−1降温处理组肝糖原开始出现明显上升趋势,3 ℃·h−1降温处理组肝糖原含量继续下降。
如表4 所示,无水保活0 h,各降温处理组斑石鲷肌糖原含量均明显低于降温前含量[(1.38 ± 0.11)mg·g−1]。各降温处理组肌糖原含量随保活时间的延长呈下降趋势,分别下降52.67%、44.92%、46.79%,1 ℃·h−1降温处理组肌糖原下降幅度明显高于3、5 ℃·h−1降温组。无水保活6 h,3 ℃·h−1降温组肌糖原显著高于5 ℃·h−1降温组。
如表4 所示,降温结束后,各降温试验组斑石鲷血清乳酸含量明显高于降温前含量[(4.34 ± 0.46)mmol·L−1]。各降温试验组血清乳酸含量均随保活时间的延长呈先下降后上升的趋势。无水保活2 h,各处理组乳酸含量较0 h 下降,无水保活2~6 h,乳酸含量快速上升。无水保活6 h,3 ℃·h−1降温处理组乳酸含量显著低于1、5 ℃·h−1降温处理组(P<0 .05)。
3 讨论
3.1 不同降温速率对斑石鲷无水保活过程中应激反应的影响
当鱼类受到刺激、损伤或死亡信号等指令,头和肾作为主要组织,由嗜铬细胞释放大量的儿茶酚胺类激素(Catecholamine),导致血液中肾上腺素(EPI)含量显著升高,使心跳加速、呼吸加快、血压升高,为鱼体活动提供更多能量并将血压及时输送至重要器官[13];而后脑垂体受下丘脑释放的促肾上腺皮质激素释放因子(Corticotrophin releasing factor)刺激,分泌促肾上腺皮质激素(Adrenocorticotropic hormone)传递给肾间组织,由肾间组织产生以皮质醇(Cortisol)为主的皮质类固醇,并释放到血液中,血液中皮质醇含量的升高,可以加强能量动员,提高血糖水平,短期内增强机体非特异性免疫功能,相反,皮质醇分泌过多,也会抑制机体免疫能力,导致机体受损[14]。因此肾上腺素和皮质醇的检测是机体发生应激反应后的常规检测,也是直接判断是否发生应激反应和机体应激反应程度的重要指标[15−16]。
孟振等[17]研究急性热应激对大菱鲆(Scophthalmus maximus)血液生化指标时,发现温度变化会使大菱鲆肾上腺素浓度升高,这与本试验结果一致,说明斑石鲷在冷驯化过程中,受长时间低温胁迫,嗜铬细胞释放肾上腺素提供能量,抵御低温,维持生命活动。无水保活过程中,3、5 ℃·h−1降温处理组血清肾上腺素呈下降趋势,因为斑石鲷在前期冷驯化过程中,一直处于高速率降温条件下,释放了大量肾上腺素提供能量。1 ℃·h−1降温处理组呈现先上升后下降的趋势,可能是因为冷驯化过程中较低的降温速率使斑石鲷逐渐适应了慢性应激源,自身能量维持生命活动的前提下,释放少量肾上腺素进行能量辅助[18],而无水保活过程中静态的温度环境被斑石鲷侧线器官感知引起脑神经兴奋,刺激肾上腺素的分泌,使得含量上升;5 ℃·h−1降温处理组冷驯化结束后,血清肾上腺素质量浓度明显高于1、3 ℃·h−1降温组,是因为降温速率高,降温至生态冰温点时间短,斑石鲷产生强烈应激,大量释放了头和肾组织中嗜铬细胞贮存的儿茶酚胺类激素,血液中肾上腺素浓度显著升高。席峰[19]在研究环境胁迫对虹鳟(Oncorhynchus mykiss)的影响时发现应激10 min 后,虹鳟血清肾上腺素升高了23 倍,这与本研究结果一致。无水保活过程中,3 ℃·h−1降温处理组血清肾上腺素含量一直维持在稳定水平,同时,比较无水保活4~6 h,各降温处理组斑石鲷肾上腺素浓度分别下降了56.9%、11.24%、25.26%,说明斑石鲷分泌肾上腺素的能力开始下降,意味着保活6 h,鱼体不同程度地受到了损伤,而3 ℃·h−1降温组鱼体损伤程度最低。
徐钢春等[20]研究盐度对长江刀鲚(Coilia nasus)运输胁迫应激指标的影响时发现,刀鲚经过运输前处理后,血清皮质醇含量显著高于未处理组(P<0.05),这与本研究结果一致,表明冷驯化使斑石鲷产生了应激反应,且驯化结束后神经内分泌反应不能及时恢复到应激前的状态。1、3 ℃·h−1降温处理组皮质醇质量浓度总体呈现上升趋势,表明斑石鲷通过动态冷驯化后,对温度的变化产生适应性,此时,斑石鲷进行无水保活,等同于人为因素将动态环境转为静态,诱使肾间组织分泌皮质醇,使其达到较高水平来应对不利因素;5 ℃·h−1降温处理组呈现下降趋势,表明随着保活时间的延长,处于高值的血清皮质醇会抑制斑石鲷免疫能力,使得肾间组织分泌皮质醇的能力下降,这与鲑鳟鱼类的研究一致[21]。无水保活0 h,5 ℃·h−1降温处理组斑石鲷皮质醇质量浓度显著高于1、3 ℃·h−1降温组,这可能是因为短时间快速降温对斑石鲷产生的应激更为剧烈。随着保活时间的延长,1、3 ℃·h−1降温组皮质醇质量浓度显著上升(P<0.05),这与刘骁等[22]研究团头鲂(Megalobrama amblycephala)无水保活结果一致。保活4 h 后,1、3 ℃·h−1降温处理组皮质醇分别上升27.17%、30.98%,Chen 等[23]发现将鲤鱼置于4 ℃的水中6 h,皮质醇含量快速上升,表明持续的低温会使鱼类皮质醇含量上升。无水保活6 h,5 ℃·h−1处理组血清皮质醇质量浓度显著低于1 ℃·h−1处理组(P<0.05)。以上研究表明,经过5 ℃·h−1冷驯化后的斑石鲷,在无水保活过程中机体免疫能力受损,导致皮质醇分泌能力下降,无法应对不利因素维持正常生命活动[24],合理解释了无水保活时间的延长,降低了斑石鲷的存活率。3 ℃·h−1的降温速率较1 、5 ℃·h−1更适用于斑石鲷降温休眠。
3.2 不同降温速率对斑石鲷无水保活过程中肝脏的影响
谷草转氨酶(AST)、谷丙转氨酶(ALT)是鱼体细胞内重要的功能酶,是鱼类代谢过程中必不可少的催化剂,主要存在于肝细胞和心肌细胞中,当肝细胞和心肌细胞受损时,细胞膜通透性增加,AST和ALT 会被释放到血液中,因此血清中AST 和ALT被认为是肝功能和心脏是否正常的最具特异性和广泛使用的指标[25]。当鱼类在无水保活过程中一直处于不利环境,自身会遭受伤害,该过程体内活性氧会不断积累进而诱发膜脂过氧化,膜脂过氧化的产物有脂类过氧化物、丙二醛(MDA)、乙烷等,其中MDA 是膜脂过氧化最重要的产物之一,因此可以通过测定 MDA 的含量了解膜脂过氧化的程度,以间接测定肝脏细胞膜系统受损程度[26]。
吴胜泽等[27]研究对鲫鱼(Carassius auratus)无水保活条件下生理生化指标的变化时发现,鲫鱼经过梯度降温后,血清AST、ALT 活性显著高于对照组,表明降温处理会损伤肝脏,这与本研究结果一致。无水保活0 h,3 ℃·h−1降温处理组斑石鲷血清AST、ALT 活力整体低于1、5 ℃·h−1降温组,是因为3 ℃·h−1的降温速率对斑石鲷进行冷驯化,所需要的时间短、温差小,能适当减缓斑石鲷无水保活过程中的肝脏损伤,这与何蓉等[28]研究不同温度无水活运中华鳖(Trionyx Sinensis)结论一致。保活过程中,3 个试验组血清AST、ALT 活力均呈现上升趋势,表明无水保活时间和降温速率会对斑石鲷肝脏造成损伤,3 ℃·h−1降温条件下的斑石鲷肝脏损伤程度最低。
冷驯化结束后,3 个试验组MDA 浓度均增加,且随着保活时间的延长,MDA 浓度呈现稳定上升趋势。无水保活0 h,3 ℃·h−1降温处理组MDA 浓度显著低于1、5 ℃·h−1降温组(P<0.05),表明3 ℃·h−1降温能够有效降低斑石鲷体内活性氧的积累,减轻氧化应激。张玉晗等[4]研究低温预处理对花鲈(Lateolabrax japonicus)无水活运时间的影响时发现,不同的降温速率会对花鲈无水运输产生剧烈脂质过氧化反应,造成肝组织细胞大量损伤和凋亡,这与本研究结果一致。以上研究结果显示,冷驯化速率和无水保活时间会对斑石鲷肝脏造成损伤,这可能是 斑石鲷无法进行长时间无水保活的重要原因。
3.3 不同降温速率对斑石鲷无水保活过程中能量代谢的影响
血糖作为血液中最重要的能源物质,是鱼类各种生命活动所需能量的直接来源[29]。血糖在常态下会在血液中保持一个正常范围,但是发生应激反应时,肝糖原会分解为葡萄糖,使鱼体血糖含量升高[30]。无水保活过程中,鱼类为了保持正常状态,以血糖代谢为主,将糖原物质转化为葡萄糖,使葡萄糖含量增加,以此抵御寒冷。随着保活时间的延长,葡萄糖被进一步分解提供能量,此时葡萄糖浓度下降,机体与肝脏组织抵抗寒冷的能力也下降[31]。肌糖原是机体新陈代谢得以维持的重要能量来源,主要存在于肌肉中,是反应外界环境应激程度的重要指标,其变化规律能清晰反映机体对环境的适应情况[32]。乳酸是反应机体细胞是否缺氧的敏感标志物,是肌糖原在缺氧状态下,通过一系列酶促反应产生的糖代谢产物,只能在肝脏和肾脏中清除,当肝、肾受损时,会导致细胞膜通透性增高,血清乳酸含量升高。
各试验组降温结束后斑石鲷血糖含量显著高于降温前,表明冷驯化过程中,斑石鲷为了御寒,将糖原物质分解为葡萄糖。随着保活时间的延长,各试验组呈先上升后下降的趋势,说明葡萄糖被进一步分解供能,这与范秀萍[33]研究低温休眠对珍珠龙胆石斑鱼(♀Epinephelusfuscoguttatus×♂Epinepheluslanceolatus)的胁迫响应和机制时的结果一致。无水保活0 h,5 ℃·h−1降温试验组血糖含量显著高于1、3 ℃·h−1降温组(P<0.05),这可能是因为5 ℃·h−1降温组降温速率高,温差大,需要足够多的葡萄糖供能。无水保活6 h,1、5 ℃·h−1降温处理组较保活4 h,血糖含量分别下降7.5%、39.09%,说明随着保活时间的延长,斑石鲷为了维持正常生命活动,体内葡萄糖被分解提供能量。纪利芹等[34]研究连续降温对大菱鲆代谢机能时发现,温度持续的降低,会加剧ATP 的消耗,活化葡萄糖酶,使葡萄糖含量下降,这与本试验结果一致。3 ℃·h−1降温处理组血糖含量继续上升,说明斑石鲷以3 ℃·h−1的速率冷驯化,应激程度较1、5 ℃·h−1降温组弱,葡萄糖酶处于低值。
张丽[35]研究大黄鱼(Larimichthys crocea)保活运输技术时发现,经过降温后的大黄鱼,肝糖原含量显著低于未降温组(P<0.05),降温引起大黄鱼强烈应激,诱使糖原磷酸化酶分解肝糖原,这与本研究结果一致。随着保活时间的延长,3 个试验组呈现下降的趋势,与血糖的趋势相反,说明持续的低温胁迫威胁斑石鲷生命,肝糖原分解提供能量,增强机体抗低温胁迫能力。无水保活4~6 h,1、5 ℃·h−1降温处理组肝糖原开始出现明显上升趋势,说明此时血液中葡萄糖被分解完全,而葡萄糖的来源一般是肝糖原分解提供,因此肝脏增加了肝糖原的合成。3 ℃·h−1降温处理组肝糖原含量继续保持下降,表明3 ℃·h−1冷驯化的斑石鲷体内肝糖原的储存量能够满足无水保活过程中的消耗,无需肝脏额外合成,同时对环境改变的适应能力也更强,更适合无水保活。
无水保活0 h,各降温试验组斑石鲷肌糖原含量均显著低于降温前,表明温度下降使斑石鲷产生应激,为了抵御寒冷压力,利用糖原分解产生的能量供能。Nie 等[36]分析大菱鲆冷驯化过程生理学变化时发现,温度迅速下降会使大菱鲆分解糖原和糖基化供能,这与本试验结果一致。而后,随保活时间的延长,各降温试验组肌糖原显著降低,这可能是因为斑石鲷在无水保活过程中呼吸方式为鳃部直接与空气接触,而该方式效率上不明确[37],从而导致缺氧,肌糖原分解为乳酸。保活结束,各降温处理组肝糖原含量分别下降52.67%、44.92%、46.79%,1 ℃·h−1降温处理组肌糖原下降幅度显著高于3、5 ℃·h−1降温组,可能是1 ℃·h−1降温组冷驯化时间长,对斑石鲷肝脏产生损伤,导致肌糖原的分解效率下降[38]。
降温结束后,各降温试验组斑石鲷血清乳酸含量明显高于降温前,说明斑石鲷接近生态冰温点时应激剧烈,导致肌糖原分解,乳酸含量升高,这与王彩霞等[11]探索加州鲈(Micropterus salmoides)生态冰温点时的结果一致。整个无水保活过程,各降温试验组血清乳酸含量呈现先下降后上升的趋势。无水保活2 h,各试验组乳酸含量下降,可能是斑石鲷新陈代谢缓慢,呼吸频率逐渐减弱,且处于相对富氧的状态。无水保活2~6 h,乳酸含量显著上升(P<0.05),说明斑石鲷长时间处于无水环境中,肝脏和肾脏严重损伤,无氧代谢加剧,乳酸在体内无法及时清除产生积累。Virani 等[39]研究缺氧对墨西哥湾刺鱼(gulf killifish)个体乳酸变化时发现,随着缺氧时间的延长,墨西哥湾刺鱼体内乳酸呈上升趋势,这与本研究结果一致。无水保活6 h,5 ℃·h−1降温处理组乳酸含量显著高于1、3 ℃·h−1降温组,说明5 ℃·h−1降温对斑石鲷机体损伤大,不适合作为斑 石鲷降温休眠速率。
4 结论
本研究通过不同降温速率开展斑石鲷的无水保活试验表明,斑石鲷可以通过冷驯化的方式进行无水保活,其中3 ℃·h−1降温处理对斑石鲷产生的应激反应弱、肝脏损伤小,可以实现无水保活6 h。下一步可以借助现代分子生物学手段,研究鱼类应激诱导生命体征波动与无水保活时间的动态关联机制,阐明降温速率对斑石鲷无水保活过程中生理应激的影响调控机制。
