利用BSA-Seq 方法定位一个水稻早衰相关基因OsBRCA1
2022-04-28蒋家焕朱永生陈丽萍郑燕梅蔡秋华谢华安王爱荣张建福
蒋家焕,朱永生,陈丽萍,郑燕梅,蔡秋华,谢华安,王爱荣,张建福,
[1. 福建省农业科学院水稻研究所/农业农村部华南杂交水稻种质创新与分子育种重点实验室/福州(国家)水稻改良分中心/福建省作物分子育种工程实验室/福建省水稻分子育种重点实验室,福建 福州 350003;2. 福建农林大学植物保护学院,福建 福州 350002]
0 引言
【研究意义】水稻(Oryza sativa)是全世界最主要的粮食作物之一,全球有超过50%的人口以大米为主食,水稻的高产和稳产是保障粮食安全的重要因素。而在农业生产中,水稻等禾谷类作物的产量95%来自叶片光合作用[1]。近年来,随着不断增长的人口压力、各种生物和非生物逆境胁迫以及城镇化带来的耕地面积不断缩小等因素均对水稻的产量构成了严重的威胁[2,3]。植物的生长发育的过程受到各种内外因素的影响。外因方面,某些物理和化学因素,如射线、强光、高温、盐、碱及干旱等环境因素可能会引起植物细胞的渗透胁迫,导致叶片的枯萎甚至早衰,进而影响作物的光合作用和代谢,造成作物的产量受到影响[4]。在遗传因素上,植物叶片早衰突变症状是常见的突变类型,这是因为某些与植物叶绿体的合成、发育和降解相关的重要基因发生了突变,失去了相应的基因功能,最后致使水稻叶色异常或早衰,进而导致水稻产量的下降。水稻作为单子叶植物分子研究的模式植物,其全基因组测序已经完成[5],我们可从中获取大量可利用的全长cDNA 相关信息用于指导育种和生产。因此,开展水稻早衰突变体相关基因的克隆并进行其早衰机理的研究,深入了解水稻叶片衰老所参与的信号通路和调控机制,对于选育延缓衰老、抗衰老的水稻品种,保证粮食安全具有重要意义。【前人研究进展】衰老同时受到遗传基因与外界环境的影响,但在植物衰老过程中,遗传往往占据主导因素,这是植物在漫长的进化过程中建立的一种自我保护形式[6]。从植物叶片早衰数据库查询结果显示,在水稻中已鉴定出近160 个与叶片衰老相关的基因,其中经遗传转化验证或互补验证的与叶片早衰相关的调控基因仅占三分之一[7]。在其中21 个已克隆的水稻叶片早衰相关基因中,多数基因参与叶绿素降解[8]、过氧化反应[9]、激素合成及信号传导[10]和逆境胁迫[11]等途径。研究结果显示,早衰突变体多数是因为植物抗氧化系统功能下降,导致叶片衰老。因此,克隆和研究更多导致水稻早衰突变体的相关基因,并进行其遗传机理的深入研究,有利于构建和完善植物早衰的遗传调控网络。然而,当前这些早衰相关基因大多是通过经典的正向遗传和图位克隆的方法获得的,传统的图位克隆方法存在研究周期长、通量低、工作量大等缺点。【本研究切入点】为加快水稻早衰基因的定位和克隆,本研究在前期工作通过传统图位克隆方法,已获得了早衰突变体w14 的目标基因精细定位区间,因区间内包含有8 个功能基因,无法最终确定其候选基因[12]。为了进一步确定早衰突变体的目标候选基因,同时也对图位克隆的结果进行验证,本研究通过BSA-Seq 的方法从中寻找可能影响水稻出现早衰突变的位点。混合群体分离分析法(Bulked segregant analysis,BSA)是基于临时(如F1、F2分离群体)或永久群体(如重组自交系、近等基因系)表现出明显差异的个体,通过构建DNA 混池进行基因定位。BSA 已被应用于水稻质量性状基因[13]和数量性状基因(QTL)[14−15]的定位。但利用BSA对水稻早衰突变体的相关基因进行定位和遗传学分析相关研究鲜见报道。【拟解决的关键问题】本研究以w14 和日本晴分别作为早衰突变体和野生型,配制 F2代遗传群体,种植于田间到抽穗期开始调查表型。依据w14 和野生型日本晴作为调查早衰表型的标准,选出极端材料构建基因池。 通过BSA-seq 分析,初步确定w14 中早衰相关基因的连锁区间,为早衰突变体w14 的衰老相关基因 的精细定位及基因克隆奠定基础。
1 材料与方法
1.1 试验材料
日本晴为本课题组保有的粳稻常规品种。野生型粳稻品种云引(YY)自云南省农业科学院引进,经0.8% EMS 诱变处理后从中筛选得到一个稳定遗传的 早衰突变体,命名为w14。
1 .2 试验方法
1.2.1 BSA-Seq 群体构建 将早衰突变体w14 与粳稻品种日本晴杂交得到F1杂交种,F1套袋自交并分单株收获得到F2种子,F2群体种植于田间生长至孕穗期时进行表型调查和取样,早衰突变型单株和野生型单株各取100 个,分别提取DNA,进行DNA 浓度测定后稀释成相同的浓度再等量混合,分别构成隐性基因池和显性基因池,再加突变体w14 共3 个样品委托广州基迪奥生物科技有限公司进行重测序分析,日本晴利用参考基因组用模块版本:IRGSP 1.0。基因集注释版本:MSU 7.0。水稻参考基因组大小为374 471 240 bp,共有12 条染色体。水稻12 条染色体的长度信息将用于统计量拟合和可视化,我们将染色体长度的信息保存在04.mapping/00.chr_length.t ab 文件中。
1.2.2 测序数据的评估和处理 对测序得到的原始测序读段(Sequenced reads 或者Raw reads),里面含有带接头的、低质量的数据。为了保证信息分析质量,必须对原始测序读段过滤,得到待分析数据,后续分析都基于待分析数据。数据处理的步骤如下:
(1)去除带接头(Adapter)的数据对;
(2)当单端测序数据中含有的N 的含量超过该条数据长度比例的10%时,需要去除此对成对数据;
(3)当单端测序数据中含有的低质量(Q≤5)碱基数超过该条数据长度比例的50%时,需要去除此 对成对数据。
1.2.3 测序数据的质量修剪 先经过FASTQC 的质控评估后如果发现待分析数据中依然含有一些接头与低质量的序列,利用TRIMMOMATIC 对待分析数据进行质量修剪,修剪后的读段称为删节数据(Trimmed data)。
TRIMMOMATIC 的处理内容主要包括以下方面:
(1)继续去除数据中的接头(Adapter)序列;
(2)以7 bp 的滑窗扫描数据,若滑窗的Qphred均值低于20,则去除该窗口及其之后的序列(默认采用Q20 标准);
(3)在成对数据中,当某一单端数据修剪后长度 低于30 bp 时,需要去除此成对数据。
1.2.4 读段比对 通过bwa mem 程序将分析数据比对到参考基因组,利用samtools sort 工具对匹配项(Alignment)按参考序列的顺序进行排序,利用Picard的Mark Duplicate 去除比对结果中的重复,屏蔽PCR duplication 的 影 响, 并 通 过 GATK 进 行 InDel Realignment,即对存在插入缺失的位点附近进行局部重新比对,校正由于插入缺失引起的比对错误。
将各样本的比对结果(bam 文件)存放在01.bam目录中。在Linux 操作系统下,安装了samtools 之后,用samtools view 及less 命令浏览bam 文件,命令如下:samtools view-h sample.bam less 或者用IGV 等基 因组浏览器载入bam 文件,可视化浏览比对结果。
1.2.5 基因组序列扩增与比对分析 应用NCBI 及http://rice.plantbiology.msu.edu 等网站的数据库分析水稻LOC_Os03g49200 的基因序列,利用引物设计软件Primer Premier 6 设计引物扩增目标基因的基因组序列全长,并在上述网站下载该基因序列,在DNAMAN 中进行序列比对分析。所设计的分段扩增目标基因的基因组序列全长的引物序列如表1。

表1 用于 OsBRCA1 基因组全长分段扩增的引物序列Table 1 Primer sequences for genome full-length fragment amplification on OsBRCA1
2 结果与分析
2.1 BSA-Seq 及测序数据质量分析
在之前的工作中,我们通过传统的基因图位克隆方法,获得了早衰突变体w14 目标基因所在的精细定位区间,但该区间包括8 个可能的候选基因,因而仍无法最终确定候选基因[12]。为了进一步确定目标基因的候选基因同时也对图位克隆的结果进行验证,我们通过BSA-Seq 的方法,即通过分别对F2群体中的显性单株构成的野生型基因池和隐性单株构成的突变型基因池(各取100 个单株)进行重测序分析,拟从中寻找可能影响水稻出现早衰突变的位点。
重测序分析SNP 位点是如今进行基因序列差异分析和基因克隆的重要辅助手段。但是基因组测序的数据质量往往会对后续的分析造成重要的影响。在本研究中,除了其中一个亲本使用日本晴的网络数据库序列信息之外,我们分别对突变体w14、隐性基因池和显性基因池进行了测序分析,同时对这3 个样本的测序数据量及测序质量进行了统计分析,结果表明,剔除低质量的数据后获得的过滤数据都在95%以上,其中Phred 数值大于20、30 的碱基占总体碱基的百分比分别超过95%和91%(表2)。
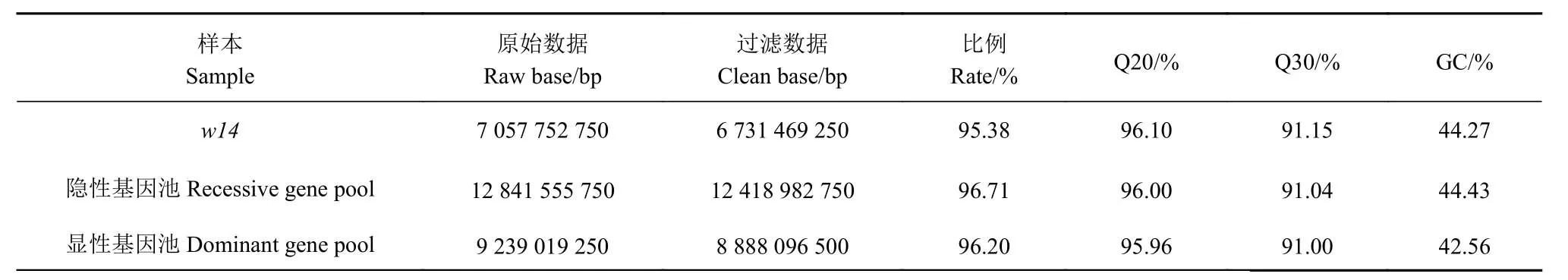
表2 测序数据和测序质量的统计分析Table 2 Statistical analysis on sequencing data and quality
在测序质量评估上,以样本w14 的测序结果为例,Qphred值的箱线图(zip 文件中Images/per_base_quality.png)(图1),其中图1A 是正向数据的Qphred值,图1B 是反向数据的Qphred值。从图可知,测序的质量值总体在Q30 以上,测序的质量值分布正常,可用于进一步的分析。

图1 突变体 w14 测序数据的质量评估Fig. 1 Statistical analysis on sequencing data and quality on w14
2.2 BSA-Seq 突变位点分析
根据设计的BSA-seq 分析的基因克隆方案,进行了单基因定位和突变基因的鉴定。对显性基因池和隐性基因池进行基因频率分析结果可知,单基因主峰位于Chr3(图2)。进一步对Chr3 基因统计量拟合曲线分析,候选区间初步估计为Chr3:27.5~29.5 Mb(图3)。这包含了我们前述的利用传统分子标记技术所定位的区间,并形成相互验证的结果。但为保守起见,上下游各扩0.5 Mb,即挑选Chr3 的27 Mb 至30 Mb 的范围进行因果变异的鉴定。

图2 基因池间等位频率分析寻找目标基因的主峰位置Fig. 2 Allele frequency between gene pools for locating main peak in target gene注:A:隐性纯合池;B:显性杂合池;C:两个混池之间的差异;D:目标基因的基因主峰。Note: A: recessive homozygous pool; B: dominant heterozygous pool; C: difference between two mixed pools; D: main peak in target gene.
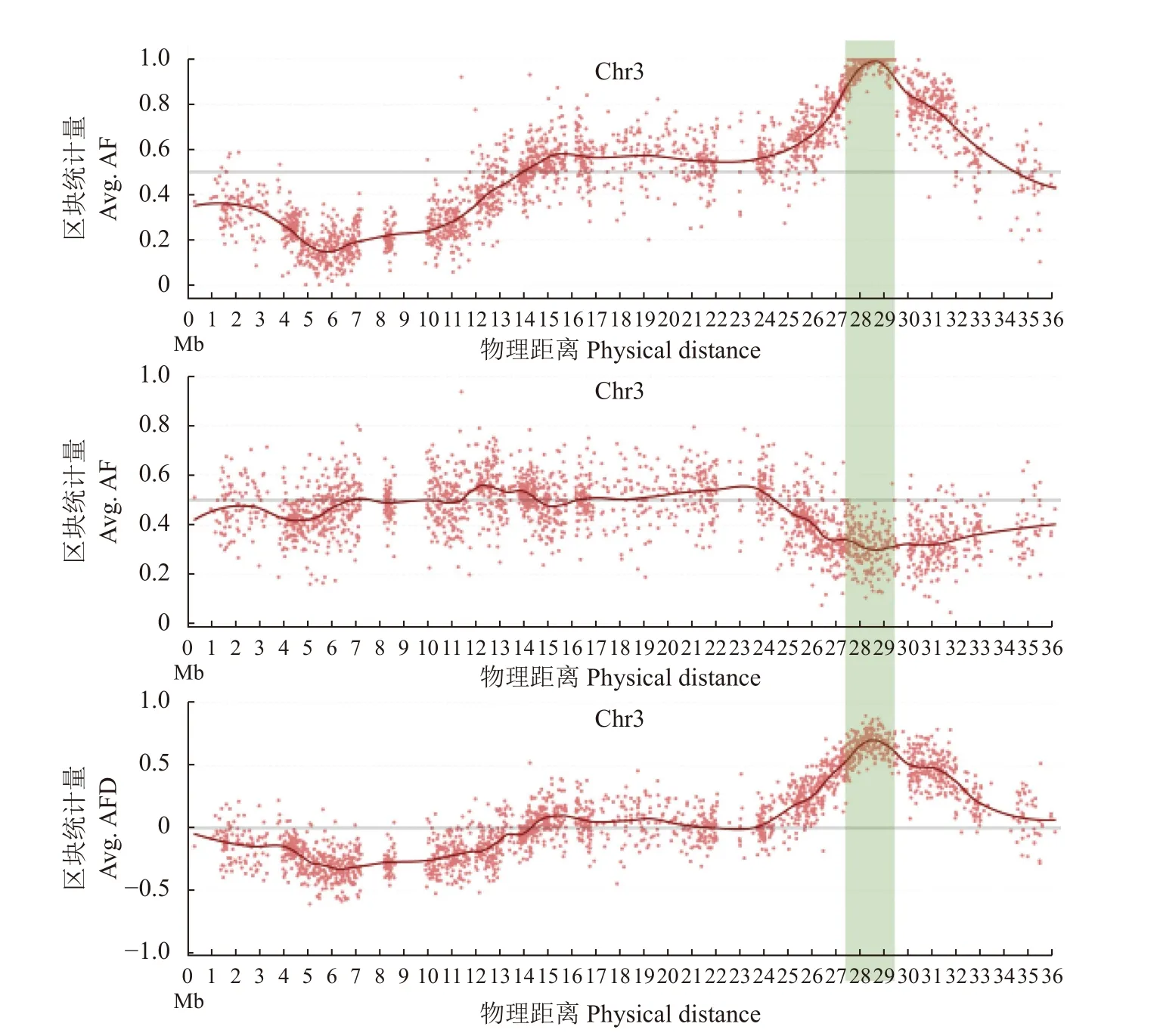
图3 测序结果中3 号染色体的AF 及AFD 拟合曲线Fig. 3 AF and AFD fitting curves of Chr 3 in sequencing
综合精细定位的区间,在目标区域内共找到2 个符合条件的候选因果变异(表3)。并且利用snpEff 对候选因果变异进行注释,注释结果如表4所示,在Chr3 上的两个候选基因中,其中LOC_Os03g48626 位于染色体27726166 的物理位置上,突变位点由野生型YY 的C 突变为T,但该突变发生在内含子中。另一候选基因LOC_Os03g49210 位于Chr3的28129631 物理位置上,突变位点也是由野生型的C 突变为T,且该突变位于候选基因的第3 外显子上,属于错义突变,造成了该基因编码的第20 个氨基酸由T(苏氨酸)变成I(异亮氨酸),从而可能导致了基因功能的改变。遂将该基因定位本研究的目 标基因,因与人BRCA1 同源,命名为OsBRCA1。

表3 目标染色体的因果变异鉴定结果Table 3 Causal variant identification on target chromosome

表4 利用snpEff 对候选因果变异进行注释的结果Table 4 Annotated candidate causal variant by snpEff
2.3 突变基因差异位点验证
根据BSA-Seq 结果,通过数据库查找目标基因OsBRCA1 的基因组序列,设计9 对引物(表1)分别分段扩增突变体w14、野生型云引及日本晴的OsBRCA1 基因组序列,以对BSA-Seq 结果进行验证。电泳后回收片段进行DNA 测序。调取NCBI 数据库中水稻的LOC_Os03g49210 序列,用DNAMAN 软件进行分段比对,将测序结果拼接比对LOC_Os03g49210的CDS 序列在日本晴、YY 及w14 中是否存在差异。对比结果表明在突变体w14 中该基因CDS 的第62 位碱基处有一个SNP 位点,由野生型YY 的C 突变成T(图4A),造成了其编码的氨基酸序列的第21 位由苏氨酸突变为异亮氨酸(图4B)。该测序结果与上述BSA-seq 分析结论相一致,这也进一步说明测序和分析结论的具有较高的可靠性。

图4 OsBRCA1 在野生型和突变体w14 的序列比对分析Fig. 4 Sequence alignment between OsBRCA1 in wild-type and mutant w14注:A:基因组序列比对结果;B:氨基酸序列比对结果。Note: A: genome sequence alignment; B: amino acid sequence alignment.
3 讨论与结论
水稻叶片的衰老直接影响水稻的产量和品质,水稻早衰的研究成为热点领域之一。当前,在水稻中已经鉴定了超过150 个的衰老相关基因,这些早衰相关基因分布在除了第1、8 和12 染色体之外的其他9 条染色体,其中已被克隆的仅占三分之一。与前人研究相比较,本研究中的突变体w14 的表型与已报道的早衰突变体均不同。在前期工作中,我们通过传统图位克隆方法,获得了早衰突变体w14 的目标基因精细定位区间,但该区间内包含有8 个功能基因,因此无法最终确定其候选基因[12]。为了进一步确定早衰突变体的目标候选基因,同时也对图位克隆的结果进行验证,本研究中我们通过BSASeq 的方法从中寻找可能影响水稻出现早衰突变的位点,并最终在目标区域内找到2 个符合条件的候选因果变异,其中LOC_Os03g48626 该突变发生在内含子中,另一候选基因LOC_Os03g49210 的突变位于第2 外显子上,属于错义突变,造成该基因编码的氨基酸发生改变。BSA-seq 分析结论与传统图位克隆方法所得到的结果相一致,这也进一步说明BSAseq 及分析结论具有较高的可靠性。错义突变基因与人BRCA1 同源,命名为OsBRCA1,该基因为一个保守基因,目前已在13 650 多个物种上被发现,在水稻中尚未见该基因的相关报道。在拟南芥中也存在BRCA1 的同源基因,AtBRCA1,包含一个N 端环状结构域,两个C 端BRCT 和p300/CBP 互作结构域,其结构域与分子特性都与BRCA1 高度相似,极易受伽马射线诱导,在DNA 修复和细胞周期控制中起重要作用[16]。拟南芥中存在两个BRCA1 的互作基因即AtBRCC36A 和AtBRCC36B,这两个基因功能同时存在或同时敲除时,拟南芥都是完全可育的且并无发育缺陷,而单突变体则具有明显的HR 缺陷[17]。BRCA2同源基因不仅参与减数分裂中DNA重组,还通过与链交换蛋白RAD51 的互作参与病原相关(PR)基因的转录调控[18]。暴露在X 射线遭受高剂量辐射时,拟南芥中BRCA1 和RAD51 在慢阶段DNA 损伤修复过程中表达滞后[19],从而影响植物的生长发育。因此OsBRCA1 的突变也可能造成水稻DNA复制时的错配、双链DNA 断裂和DNA 损伤修复受阻,从而引起水稻的发育异常,导致水稻的叶片早衰症状。
