舍曲林对抑郁症大鼠认知功能和海马突触后致密蛋白-95 mRNA表达的影响
2022-04-28翁孝琴罗彬彬陈佐明
翁孝琴,薛 山,罗彬彬,陈佐明
(1.新乡医学院第二附属医院临床心理科,河南 新乡 453000;2.郑州市第二人民医院眼科,河南 郑州 451100)
抑郁症是严重的精神疾病,其患病率在世界范围居高不下[1-2],主要表现为情绪障碍和认知功能障碍,尤其在重度抑郁症患者中,认知功能异常尤为明显[3-4]。有研究显示,抑郁症患者会出现认知功能紊乱,而认知功能在一定程度上可以调节人的情绪[5-6],因此,研究抑郁症患者认知功能异常的发病机制尤为重要。炎症细胞因子的激活可降低突触可塑性[7-8],造成认知功能障碍,认知功能障碍与海马功能和结构异常有关[9]。突触后致密蛋白-95(post-synaptic density protein-95,PSD-95)是位于突触后特化区内的主要支架蛋白,在调控神经突触发育和可塑性中起关键作用,并参与学习记忆等功能的调节。有研究发现,长期应激可使抑郁症大鼠海马CA1、CA3区中的PSD-95表达水平下降[10],提示在抑郁症的发生、转归过程,PSD-95作为神经信号传递中重要的整合器,通过串集、整合特异受体及下游相关蛋白,影响神经突触可塑性。本研究通过分析舍曲林对抑郁症大鼠认知功能和海马组织中PSD-95 mRNA相对表达量的影响及PSD-95 mRNA相对表达量与抑郁症大鼠认知功能之间的关系,来探讨抑郁症可能的发病机制。
1 材料与方法
1.1 实验动物成年健康雄性Sprague-Dawle大鼠64只,体质量180~230 g,由河南省郑州大学实验动物中心提供,实验动物机构许可证号:SCXK(豫)2010-0002;饲养于河南省生物精神病学重点实验室屏障动物房。实验过程中,在不影响实验要求和实验结果的基础上充分遵守替代、减少、优化的原则。
1.2 试剂与仪器反转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)所需引物由生工生物工程(上海)股份有限公司合成;旷场箱购自深圳市瑞沃德生命科技有限公司,Y迷宫(MG-2)购自安徽淮北正华生物仪器设备有限公司,Smart Version 2.5.16轨迹图像分析软件由美国Smart Software股份有限公司提供。Eppendorf 5331梯度聚合酶链反应仪购自德国艾本德股份公司,BTS-20.M型紫外凝胶成像系统购自英国UVItec公司。
1.3 实验动物分组及干预措施大鼠先适应性饲养1周,自由摄食、饮水,光照周期为12 h,室温(22±2)℃,相对湿度45%~60%。随机选择16只大鼠作为对照组,每笼4只,正常饲养。其余48只大鼠参照文献[11]采用慢性不可预见应激(chronic unpredictable stress,CUS)方法制备抑郁症模型(模型组),具体造模方法为:大鼠均单笼孤养,使用10种刺激方法,每日随机给予2种,相同刺激不连续出现,使大鼠无法预知操作,连续刺激28 d。然后根据大鼠体质量变化、旷场试验、蔗糖水消耗实验、Y迷宫实验和巴恩斯迷宫实验结果(大鼠体质量增长减缓、快感缺乏、认知功能损伤)证实大鼠均造模成功。将造模成功大鼠随机分为抑郁组、抑郁+生理盐水组和抑郁+舍曲林组,每组16只。抑郁+舍曲林组大鼠每日灌胃舍曲林5.8 mg·kg-1,抑郁+生理盐水组大鼠每日灌胃生理盐水5.8 mg·kg-1,以上2组大鼠均干预4周;抑郁组大鼠不给予任何干预措施。然后3组大鼠继续给予CUS,以避免抑郁行为退化。
1.4 大鼠行为学评估
1.4.1 旷场实验造模后,对照组和模型组大鼠进行旷场实验。将大鼠放入黑色方形敞箱(长100 cm,宽100 cm,高40 cm)中央,记录大鼠在中央区停留时间。从放入敞箱中央开始计时,测试时间5 min。每2次测试间期将敞箱清理干净,不留异物和异味。全程使用Smart Version软件记录大鼠水平运动距离、竖立运动次数(两前肢同时离地竖起记为1次)。
1.4.2 蔗糖水消耗试验造模后,对照组和模型组大鼠进行蔗糖水消耗试验。每次测试前禁食禁水24 h 并测大鼠体质量,然后给予大鼠10 g·L-1蔗糖水,观察大鼠1 h的饮水量,计算每100 g体质量大鼠饮用蔗糖水的量,蔗糖水摄入量=1 h饮用量(mL)/[动物体质量(g)×100]。
1.4.3 Y迷宫实验检测大鼠的认知功能造模后及舍曲林干预4周后,参照王跃春等[12]的方法对各组大鼠进行Y迷宫实验。每轮Y迷宫实验分为第1天学习阶段和第2天测试阶段。实验前允许大鼠在迷宫内自由活动,适应环境5 min后,开始进行随机的变换安全区,以训练大鼠辨别灯光刺激及安全方位的能力。实验过程中调节刺激电压为50~70 V,大鼠在起始区内给予电刺激使其逃至安全区,灯光持续15 s,然后熄灯休息45 s,再开始下一轮操作,将大鼠受电刺激后10 s内一次性从起始区逃至安全区的反应称为“正确反应”,否则称为“错误反应”。第1天学习阶段中,以达到学会为目的进行学习训练,学会的标准:在10次电刺激中连续9次做出正确反应。第2天测试,检测大鼠的记忆能力,在连续20次的电刺激测试中记录正确反应次数、错误反应次数和每次从信号灯亮到进入安全区的逃避潜伏期,以1个实验日累计的总潜伏期反应时间来表示大鼠信息提取速度以及综合记忆能力。
1.4.4 巴恩斯迷宫实验检测大鼠认知功能造模后及舍曲林干预4周后,各组大鼠进行巴恩斯迷宫实验。巴恩斯迷宫实验装置位于地板上方140 cm处,20个孔均匀地位于表面周边,直径为5 cm。目标洞是这些孔中的1个,连接到暗室允许小鼠逃离强光的刺激。在正式实验的前1 d,将动物放入目标洞中4 min 进行适应。在第1天,将大鼠放置在迷宫中心的黑色立方体中5 s,大鼠在移除立方体时探索迷宫以找到目标洞,一旦大鼠进入目标洞,就会在那里停留30 s,如果在3 min内找不到目标洞的话,它将被引导至目标洞并允许停留在目标箱中1 min。每只动物在1 d内进行2次试验,每次间隔4 h,记录每只大鼠到达目标盒的潜伏时间。测试共进行4 d,每只大鼠测试前使用体积分数75%乙醇清洁装置以避免嗅觉干扰,应用Spain Panlab Smart 3.0软件对进入目标洞中的时间和错误次数进行视频记录和分析。
1.5 RT-PCR法检测大鼠海马组织中PSD-95 mRNA相对表达量各组大鼠认知功能测试完成后,腹腔注射100 g·L-1水合氯醛(3 mL·kg-1)对大鼠进行全身麻醉。对照组、抑郁组、抑郁+生理盐水组和抑郁+舍曲林组随机取8只大鼠,断头处死,冰上快速剥离出海马组织,-80 ℃储存。TRIzol法提取各组大鼠海马组织中总RNA,并反转录为cDNA。以cDNA为模板,配制 20 μL反应体系,于 RT-PCR仪上进行扩增。反应条件:95 ℃ 预变性 30 s,95 ℃变性 5 s,60 ℃退火 30 s,70 ℃延伸10 s,共30个循 环。以PSD-95为模板设计引物,上游引物序列为5′-GACAGTGAGACCGACGACATT-3′,下游引物序列为5′- CCCATAGAGGTGGCTGTTGTA-3′,扩增产物396 bp。 以内参β-actin为模板设计引物,上游引物序列为5′-CCCATCTATGAGGGTTACGC-3′,下游引物序列为5′-TTTAATGTCACGCACGATTTC-3′,扩增产物150 bp。 使用 12 g·L-1琼脂糖凝胶进行电泳,并使用Gene Tools From SynGene 软件对4组大鼠RT-PCR产物的电泳条带进行灰度值分析,以目的基因与内参基因的灰度值比值表示PSD-95 mRNA相对表达量。

2 结果
2.1 舍曲林干预前对照组与模型组大鼠体质量、蔗糖水摄入量和运动总距离比较结果见表1。模型组大鼠体质量、蔗糖水摄入量、运动总距离均显著少于对照组,差异有统计学意义(P<0.05)。
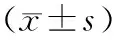
表1 舍曲林干预前对照组与模型组大鼠体质量、蔗糖水摄入量和运动总距离比较
2.2 舍曲林干预前对照组与模型组大鼠认知功能比较结果见表2和表3。在Y迷宫实验中,模型组大鼠正确反应次数少于对照组,错误反应次数多于对照组,总潜伏期反应时间长于对照组,差异有统计学意义(P<0.05)。
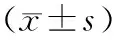
表2 舍曲林干预前对照组与模型组大鼠Y迷宫实验结果比较
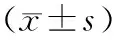
表3 舍曲林干预前对照组与模型组大鼠进入目标洞时间比较
在巴恩斯迷宫实验中,模型组大鼠第2天、第4天进入目标洞时间长于对照组,差异有统计学意义(P<0.05);2组大鼠第1天、第3天进入目标洞时间比较差异无统计学意义(P<0.05)。
2.3 舍曲林干预后4组大鼠认知功能比较结果见表4和表5。抑郁组、抑郁+生理盐水组大鼠正确反应次数少于对照组,错误反应次数和总潜伏期反应时间长于对照组,差异有统计学意义(P<0.05)。抑郁+舍曲林组与对照组大鼠正确反应次数、错误反应次数和总潜伏期反应时间比较差异无统计学意义(P>0.05)。抑郁+舍曲林组大鼠正确反应次数多于抑郁组和抑郁+生理盐水组,错误反应次数少于抑郁组和抑郁+生理盐水组,总潜伏反应时间短于抑郁组和抑郁+生理盐水组,差异有统计学意义(P<0.05)。抑郁组与抑郁+生理盐水组大鼠正确反应次数、错误反应次数和总潜伏期反应时间比较差异无统计学意义(P>0.05)。
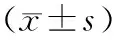
表4 舍曲林干预后4组大鼠Y迷宫实验结果比较
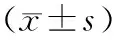
表5 舍曲林干预后4组大鼠进入目标洞时间比较
抑郁组、抑郁+生理盐水组大鼠第1、2、3、4天进入目标洞时间均长于对照组,差异有统计学意义(P<0.05)。抑郁+舍曲林组与对照组大鼠第1、2、3、4天进入目标洞时间比较差异无统计学意义(P>0.05)。抑郁+舍曲林组大鼠第1、2、3天进入目标洞时间少于抑郁组和抑郁+生理盐水组,差异均有统计学意义(P<0.05);抑郁+舍曲林组大鼠第4天进入目标洞时间与抑郁组和抑郁组+生理盐水组比较差异无统计学意义(P>0.05)。抑郁组与抑郁+生理盐水组大鼠第1、2、3、4天进入目标洞时间比较差异无统计学意义(P>0.05)。
2.4 4组大鼠海马组织中PSD-95 mRNA相对表达量比较结果见图1。对照组、抑郁组、抑郁+生理盐水组、抑郁+舍曲林组大鼠海马组织中PSD-95 mRNA相对表达量分别为0.739±0.024、0.459±0.022、0.454±0.027、0.625±0.019。抑郁组、抑郁+盐水组大鼠海马组织中PSD-95 mRNA相对表达量显著低于对照组,差异有统计学意义(P<0.05)。抑郁+舍曲林组与对照组大鼠海马组织中PSD-95 mRNA相对表达量比较差异无统计学意义(P>0.05)。抑郁+舍曲林组大鼠海马组织中PSD-95 mRNA相对表达量显著高于抑郁组和抑郁+生理盐水组,差异有统计学意义(P<0.05)。抑郁组与抑郁+生理盐水组大鼠海马组织中PSD-95 mRNA相对表达量比较差异无统计学意义(P>0.05)。

M:marker;A:对照组;B:抑郁组;C:抑郁+生理盐水组;D:抑郁+舍曲林组。
2.5 大鼠海马组织中PSD-95 mRNA相对表达量与认知功能相关性大鼠海马组织中PSD-95 mRNA相对表达量与大鼠在Y迷宫实验中正确反应次数呈显著正相关(r=0.486,P<0.05),与错误反应次数呈显著负相关(r=-0.581,P<0.05)。
3 讨论
抑郁症是导致全球疾病负担增加的五大疾病之一。全球约3.5亿人患有严重抑郁症,根据抑郁症临床表现可分为不同类型,但任何类型的抑郁症均会导致患者认知功能损伤,其病理生理学机制尚不清楚,需进一步研究[13]。尽管抗抑郁药的快速发展改善了部分抑郁症患者的症状,但由于该疾病病因不明确,仍有较多患者治疗效果欠佳,给个人和家庭带来很大痛苦。因此,研究抑郁症患者的发病机制仍是目前研究热点。
本研究参照ANTONIUK等[11]方法通过给予CUS制备抑郁症模型,结果显示,模型组大鼠体质量下降(反映其食欲下降)、蔗糖水摄入量减少(反映其对愉悦事件的兴趣丧失)、旷场试验中运动总距离缩短(反映其类焦虑样状态控制能力以及探究活跃能力降低),说明成功制备抑郁症模型。
关于抑郁症的发病机制,“神经可塑性学说”得到学者们的公认。因此,选择性5-羟色胺再摄取抑制剂在临床抑郁症治疗中得到广泛使用,这类药物主要通过抑制中枢神经系统内5-羟色胺神经递质的再摄取,从而提高5-羟色胺神经递质的含量。国外有学者发现,单胺类5-羟色胺再摄取抑制剂能引起神经可塑性的改变[14],其中舍曲林是该类药物之一。本研究结果显示,抑郁组大鼠在Y迷宫实验中的错误反应次数显著多于对照组,在巴恩斯迷宫实验中其正确反应次数显著少于对照组,说明抑郁症大鼠发生认知功能障碍,与LI等[15]研究结果一致。为进一步证实神经可塑性变化,本研究给予舍曲林干预后发现,抑郁+舍曲林组大鼠的进入目标洞时间少于抑郁组和抑郁组+生理盐水组,说明抑郁症大鼠的学习记忆能力下降,而抗抑郁药物干预能改善抑郁症状并提高学习记忆能力;提示在抑郁症发病时神经生物学的改变参与了学习记忆等的调节,而神经可塑性在其中起重要作用,是情绪、学习记忆功能的基础[16]。
有学者通过动物模型、抑郁症患者大脑形态学和尸检结果发现了抑郁症在发生和转归过程中大脑结构形态学的改变特点,提出了神经可塑性学说[17]。PSD-95基因沉默可影响缺血后大鼠海马锥状细胞的死亡,说明PSD-95对海马神经元锥体细胞及可塑性等产生了一定的影响[18]。BESSIERES 等[19]研究发现,PSD-95在调节神经突触可塑性中具有重要作用。本研究采用RT-PCR技术检测抑郁症大鼠经舍曲林治疗后海马组织中PSD-95 mRNA的表达情况,结果显示,抑郁组和抑郁+生理盐水组大鼠海马组织中PSD-95 mRNA相对表达量显著低于对照组,抑郁+舍曲林组大鼠海马组织中PSD-95 mRNA相对表达量显著高于抑郁+生理盐水组。说明长期CUS可通过影响PSD-95的转录水平来影响神经可塑性,从而导致抑郁症的形成,与MAYA VETENCOURT等[20]的研究结论一致。本研究进一步对大鼠海马组织中PSD-95 mRNA表达水平与大鼠在Y迷宫实验中正确反应次数及错误反应次数的相关性进行了分析,结果发现,PSD-95 mRNA相对表达量与错误反应次数呈显著负相关,与正确反应次数呈显著正相关,说明PSD-95 mRNA水平与大鼠认知功能有关。舍曲林可能是通过增加大鼠海马组织中PSD-95 mRNA的表达,触发一系列生物学改变,进而发挥治疗作用。但以上研究结论仍需蛋白水平实验结果进行佐证。
本研究从分子生物学水平上阐明抑郁症大鼠海马组织中神经突触可塑性导致认知功能障碍的可能神经生理机制,为进一步深入解释慢性应激引发身心疾病的作用机制提供了实验证据,为抗抑郁症药物的研发提供新的药物作用靶点。
