急性Stanford A型主动脉夹层患者术前主动脉弹性与术后主动脉重构的相关性
2022-04-28李金平杜恩慧关文华
李金平,杜恩慧,关文华
(1.新乡医学院第三附属医院放射科,河南 新乡 453003;2.新乡医学院第三临床学院,河南 新乡 453003)
急性Stanford A型主动脉夹层(acute Stanford type A aortic dissection,ATAAD)是心脏外科的危急重症,其病死率极高,外科手术是目前最有效的治疗方式[1]。手术治疗的核心在于减少和预防因假腔所致的主动脉破裂,纠正因假腔引起的主动脉瓣关闭不全,并通过密封或修复近端内膜的入口,使血液流经真正的内腔以重建新的血液通道,改善由主动脉夹层引起的分支血管的异常血液供应,避免主动脉破裂并缓解脏器灌注不足[2-4]。通过缓慢闭塞假腔和维持真腔的通畅来稳定主动脉整体尺寸的过程称之为主动脉重塑[5]。ATAAD患者术后假腔逐渐萎缩或完全血栓形成和真腔的扩张是术后预后良好的指证,而假腔的扩大则意味着预后不良,甚至需要再次手术的可能[6]。目前,ATAAD患者术后主动脉重构的机制尚不明确。本研究旨在通过分析ATAAD患者术前及术后计算机断层扫描血管造影(computed tomography angiography,CTA)影像资料,探讨ATAAD患者术前升主动脉弹性与术后假腔血栓形成及主动脉重构的相关性,以期进一步提高对ATAAD患者术后主动脉重构的认识。
1 资料与方法
1.1 一般资料选择2011年1月至2020年6月于新乡医学院第三附属医院行急诊手术治疗且术后规律进行CTA随访的39例ATAAD患者为研究对象,其中男27例,女12例;年龄26~83(56.89±13.81)岁;按照ATAAD细化分型原则[7]分型:A3C型17例,A2C型13例,A1C型7例,A1S 1例,A3S型1例;手术方式:升主动脉及全弓替换加支架象鼻术26例,主动脉根部替换及全弓替换加支架象鼻术7例,单纯 Bentall手术4例,升主动脉及部分主动脉弓替换术2例。病例纳入标准:(1)CTA诊断符合Stanford 分型中Stanford A型主动脉夹层的描述[7];(2)急性期(发病14 d内)完成手术治疗;(3)术前均采用心电门控CTA技术进行扫描采集;(4)有完整的CTA随访资料,图像清晰,全程主动脉无明显运动伪影,对比剂显示满意,能够分辨主动脉双腔和内膜片,并能够达到CT所需测量参数需求。排除标准:(1)住院期间死亡病例;(2)术后失访病例。本研究获医院医学伦理委员会审核批准,患者知情同意并签署知情同意书。
1.2 方法
1.2.1 CTA扫描方法扫描设备使用SIEMENS公司64排螺旋CT机(SOMATOM Definition AS128)或GE公司128层螺旋CT机(Revolution 宝石能谱CT);患者扫描体位采取仰卧位,头先进;扫描参数为管电压120 kV,管电流300~320 mA,准直64 000 mm×0.625 mm,螺距0.16~0.24,显示野250 mm,矩阵512×512;扫描范围自胸廓的入口至耻骨联合的上缘平面;造影剂为注射用碘普罗胺 370 mg I·mL-1[先灵(广州)药业有限公司,国药准字H10970166]80~100 mL,注射流率5 mL·s-1;采用回顾性心电门控技术,动脉期扫描采用对比剂追踪程序自动触发技术,感兴趣区(region of interest,ROI)位于主动脉夹层真腔内,胸9~12椎体层面,阈值150 HU。动脉期扫描后,静脉期扫描延迟20~30 s。
1.2.2 术前升主动脉动脉弹性评估将CTA扫描获得的原始数据传输至后处理工作站(Syngo MMWP Version 2008A;GE Advantage workstation 4.5),重建心动周期的40%收缩期与75%舒张期图像,选取距左冠状动脉开口上方25 mm处作为测量平面,应用后处理工作站测量包含真假腔的升主动脉腔的面积及直径,并计算升主动脉收缩期最大管腔面积(area systole,As)、舒张末期最小管腔面积(area diastole,Ad)、收缩期最大管腔直径(diameter systole,Ds)、舒张末期最小管腔直径(diameter diastole,Dd)(图1)。计算主动脉扩张度(aortic distensibility,AD)、主动脉顺应性(aortic compliance,AC)、主动脉僵硬度(aortic stiffness,ASI),AD=(As-Ad)÷Ad/(Ps-Pd),AC=(As-Ad)/(Ps-Pd),ASI=ln[As÷Ad/(Ds-Dd)÷Dd],Ps和Pd对应患者的收缩压和舒张压[4]。
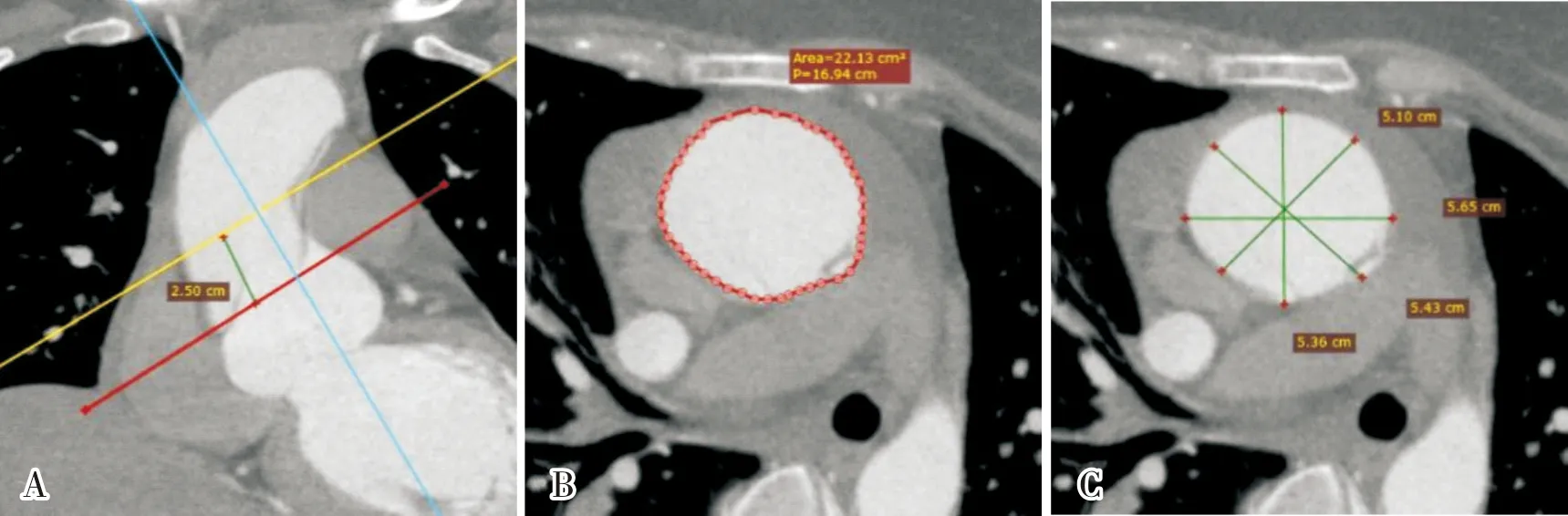
A:左冠状动脉起点上方25 mm处沿血管中心线选取垂直平面;B:横截面积测量;C:通过4次具有相等分离角的测量计算直径均值。
1.2.3 术后主动脉重构状态判定依据术后3个月CTA结果,选取主动脉弓层面、肺动脉干层面、左下肺静脉层面、主动脉裂孔层面、腹腔干上缘层面、肠系膜上动脉上缘层面、左肾动脉上层面、右肾动脉上层面测量真腔面积(true lumen area,Ta)、假腔面积(false lumen area,Fa),计算真腔面积占比(rate of true lumen area,TR)[TR=Ta/(Ta+Fa)×100%]。对比末次CTA与术前CTA,以TR增加(即TR术后-TR术前)>0为该平面重构阳性;TR增加<0为该平面重构阴性;TR阳性平面计数>1/2平面总数,则定义为主动脉重构阳性。
1.2.4 术后假腔状态评估依据患者术后末次CTA动脉期及静脉期扫描结果评估假腔状态,按照术后假腔内血栓形成及通畅程度将本研究病例分为假腔内完全血栓形成组(A组)、假腔完全通畅组(B组)、假腔内不完全血栓形成组(C组)、假腔完全消失组(D组)。

2 结果
2.1 术后主动脉重构状态与术前升主动脉弹性的相关性结果见图2、图3和表1。主动脉重构阳性31例(79.5%),主动脉重构阴性8例(20.5%)。主动脉重构阳性组患者AD、AC、ASI显著低于主动脉重构阴性组,差异有统计学意义(P<0.05);Pearson相关性分析显示,AD、AC、ASI与主动脉重构阳性呈中度相关(r=0.664、0.569、0.514,P<0.05)。

A:主动脉弓层面;B:肺动脉干层面;C:左下肺静脉层面;D:主动脉裂孔层面。A1、B1、C1、D1为术前图像;A2、B2、C2、D2为术后3个月图像,假腔完全消失,主动脉重构阳性。

图3 ATAAD患者主动脉重构阴性CTA图像
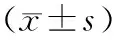
表1 不同主动脉重构状态组ATAAD患者AD、AC和ASI值比较
2.2 术后假腔状态与术前升主动脉弹性相关性分析结果见表2。A组、B组、C组、D组患者主动脉弹性相关参数AD、AC、ASI比较差异有统计学意义(F=9.581、17.954、8.637,P<0.05)。B组患者AD、AC显著高于A组、C组和D组,差异有统计学意义(P<0.05);A组、C组和D组患者AD、AC比较差异无统计学意义(P>0.05)。B组和C组患者ASI显著高于A组和D组,差异有统计学意义(P<0.05);B组与C组、A组与D组患者ASI比较差异无统计学意义(P>0.05)。Pearson相关性分析显示,AD、AC、ASI与不同假腔状态之间无相关性(r=-0.145、-0.035、-0.196,P>0.05)。
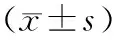
表2 不同假腔状态组ATAAD患者AD、AC和ASI值比较
3 讨论
主动脉夹层的发生机制目前尚不十分明确,除与诸如Marfan综合征、Loeys Dietz综合征等遗传疾病有一定相关性外[8],高血压和主动脉弹性在主动脉夹层的发生中也起到了重要的作用[9]。动脉弹性是动脉的固有特征,反映了单位压力作用下动脉壁的功能变化。舒张期动脉功能状态包括血管的直径和宽度、横截面积和体积的变化,可以反映动脉的弹性性能[10]。研究发现,原发性高血压患者的血清生长分化因子-15与ASI呈明显的负相关,表明二者存在一定的协同性[11]。JIA等[12]研究发现,高血压前期患者升主动脉弹性在高血压形成的早期即可发生变化。LI 等[13]研究证实了心电门控双源CT评估胸主动脉弹性的可能性,并发现主动脉夹层患者主动脉弹性参数AD、AC、AS均高于健康人群,进一步证实主动脉弹性在主动脉夹层的发生中起到了重要作用。近年来磁共振成像(magnetic resonance imaging,MRI)技术更多地用于评价动脉系统[14]。MORGANT等[15]采用MRI分析升主动脉弹性,并尝试确定主动脉壁破裂的风险阈值,以指导患者是否需要做主动脉置换来避免主动脉夹层的发生。
ATAAD患者术后主动脉的重构是一个持续的、较为长期的过程。主动脉的正性重构,即真腔的扩大、假腔的缩小,被认为是ATAAD术后良性转归的结果[6]。高灌注假腔的持续存在是导致主动脉管腔增大、因发生动脉瘤或瘤样扩张而再次手术或主动脉发生破裂的主要原因[16]。既往也有研究认为,真腔塌陷和多重假腔扩大是B型主动脉夹层近端修复后远端主动脉扩大的2个潜在危险因素[17]。因此,术后需行CTA检查观察真腔管腔的扩张程度和假腔的变化规律。本研究采用CTA对ATAAD患者术后主动脉重构进行评估,并完善了评估方法,即采用TR>0为阳性,同时满足TR阳性平面计数>1/2平面总数,定义为主动脉重构阳性。本研究结果显示,31例(79.5%)患者为主动脉重构阳性,取得了较为理想的手术效果。此外,本研究结果显示,主动脉重构阳性组患者AD、AC、ASI显著低于主动脉重构阴性组,且主动脉重构阳性与术前主动脉弹性相关参数AD、AC、ASI呈中度相关性,表明主动脉弹性的变化不仅是产生主动脉夹层的重要因素,在一定程度上也决定了术后主动脉重构状态,这与SATO等[18]研究结论一致,但其机制尚不明确。术后主动脉由于人工血管置换和(或)支架的置入无法通过测量计算术后主动脉真正的弹性参数,故本研究选取的是术前升主动脉弹性进行评估,存在一定的局限性,同时主动脉夹层假腔累及范围内不同节段的主动脉弹性可能不同,尚需进一步探讨更为合适的主动脉弹性的评价方法。
研究发现,ATAAD患者术后假腔闭合的10 a生存率为(89.8±2.1)%,永存假腔患者10 a生存率仅为(59.8±53.5)%[19]。但并非所有ATAAD患者术后的假腔均能顺利地发生假腔血栓化直至消退。本研究病例术后3个月CTA显示,假腔完全消失17例、假腔完全血栓形成3例,共计20例ATAAD患者术后取得了较好的假腔状态的转归,预示其生存期延长;但仍有12例患者仅仅是假腔不完全血栓形成,7例的患者假腔完全通畅,这可能在一定程度上与本组随访时间尚不充分有关。因为假腔是否闭合与患者的长期生存率密切相关,所以对于这些病例需要进行更为长期的随访观察[20]。目前关于假腔血栓的形成原因及影响因素研究报道较少,一般认为随着夹层破口的封堵,假腔血流的减缓甚至中断是产生血栓的有利因素,但出口的持续开放存在演变为新入口的可能性,如果能够提前预测术后主动脉的假腔状态,及时调整治疗方案,可能会有益于患者的预后。本研究结果表明,B组患者AD、AC显著高于A组、C组和D组,A组、C组和D组患者AD、AC比较差异无统计学意义;B组和C组患者ASI显著高于A组和D组,B组与C组、A组与D组患者ASI比较差异无统计学意义;但不同假腔状态与主动脉弹性相关参数AD、AC、ASI无相关关系。而VEGER等[21]关于主动脉壁弹性对主动脉夹层假腔影响的体外研究结果显示,主动脉壁弹性是改变假腔的一个重要参数,弹性降低的主动脉壁导致假腔中部和远端假腔直径增加,与本研究结果不一致,这种差异可能与本组病例随访时间尚短,患者尚未达到假腔血栓完全形成或假腔完全消失所需要的时间,或与本研究观察的是术前主动脉弹性与假腔状态转归的相关性而非术后主动脉弹性与假腔状态转归有关。
综上所述,主动脉弹性与主动脉夹层的发生有关,并与ATAAD患者术后主动脉真腔重构有一定相关性,因此,主动脉弹性相关参数AD、AC、ASI测量对ATAAD治疗措施的制定具有参考价值,并对其预后转归有一定预测意义。
