欧当归内酯A对人胶质瘤细胞U251细胞凋亡及自噬的影响
2022-04-28王利莹陆玉成王丽娟王蒙恩韦志永车峰远
王利莹,陆玉成,王丽娟,王蒙恩,韦志永,车峰远
(1.潍坊医学院临床医学院,山东 潍坊 261000;2.临沂市人民医院生物样本库,山东 临沂 276000;3.临沂市人民医院中心实验室,山东 临沂 276000;4.临沂市人民医院病理科,山东 临沂 276000)
胶质瘤是成人最常见的原发性脑肿瘤,占脑恶性肿瘤的81%[1],主要起源于中枢神经系统的胶质细胞[2]。胶质瘤有丰富的新生血管网络支持其浸润生长,导致其生长迅速且侵袭性高。目前,胶质瘤的治疗方法主要是手术切除辅以化学治疗和放射治疗,但化学治疗的不良反应和肿瘤的耐药性严重影响患者的治疗效果[3]。胶质瘤患者平均生存期仅10.2~14.6个月,恶性胶质瘤患者5 a生存率低于5%[4-5]。胶质瘤患者的年龄、病灶切除范围和病理类型等均可影响患者的生存率和复发率[6]。因此,迫切需要研究新的治疗策略来增强胶质瘤患者的治疗效果并延长其生存时间。欧当归内酯A(levistilide A,LA)是从传统中药川穹根里分离出来的一种天然化合物,由2个藁本内酯聚合而成[7-8]。目前已有研究证实,LA通过活性氧介导的内质网应激途径可促进细胞凋亡从而发挥抗肿瘤作用[9]。本研究旨在探讨LA对人胶质瘤细胞U251凋亡及自噬的影响,以期为胶质瘤的治疗提供参考。
1 材料与方法
1.1 细胞、主要试剂和仪器人胶质瘤细胞U251购自中国科学院上海生命科学研究院细胞资源中心。LA购自上海源叶生物科技有限公司。达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)购自美国Hyclone公司,灭活胎牛血清和青、链霉素双抗及胰蛋白酶购自美国Gibco公司。细胞计数试剂盒-8(cell counting kit-8,CCK-8)、Annexin V-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)和蛋白提取试剂盒购自上海贝博生物公司,聚氰基丙烯酸正丁酯(butyleyanoacrylate,BCA)定量检测试剂盒购自上海碧云天生物技术有限公司。3-甲基腺嘌呤(3-methyladenine,3-MA)购自美国APEXBIO公司。兔抗人p53一抗、鼠抗人B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)蛋白一抗、兔抗人Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)一抗、兔抗人caspase-3一抗、兔抗人微管相关蛋白1A/1B-轻链3(light chain 3,LC3)-Ⅰ、LC3-Ⅱ一抗均购自美国Cell Signaling Technology公司,鼠抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购自美国Proteintech公司,辣根过氧化物酶(horseradish peroxidase,HRP)-羊抗兔二抗和HRP-羊抗鼠二抗购自美国Cell Signaling Technology公司。Canto II流式细胞仪购自美国BD公司,酶标仪购自美国Bio-Rad公司,Fluorchem E成像系统购自美国Proteins simple公司,ECLIPSE Ti显微镜购自日本尼康公司。
1.2 方法
1.2.1 细胞培养将U251细胞接种于含有体积分数10%热灭活胎牛血清、体积分数1%青、链霉素混合液的DMEM培养基中,于37 ℃、含体积分数5% CO2的全湿培养箱中培养,待细胞生长至密度70%~80%时,用胰蛋白酶消化传代,共传代15次,取对数生长期的U251细胞用于后续实验。
1.2.2 CCK-8实验检测细胞增殖能力取对数生长期U251细胞接种于96孔板中,每孔4 000个细胞,随机分为空白组、30 μmol·L-1LA组、60 μmol·L-1LA组、90 μmol·L-1LA组,每组设置5个复孔,分别培养于含0、30、60、90 μmol·L-1LA的培养基中,干预24、48、72 h时加入10 μL CCK-8试剂,37 ℃下培养2~3 h,使用酶标仪检测450 nm波长处吸光度,以吸光度值表示细胞增殖能力,吸光度值越大表示细胞增殖能力越强。实验重复3次,取均值。根据实验结果,选择对U251细胞增殖抑制较弱的24 h作为后续实验LA作用时间。
1.2.3 流式细胞术检测细胞凋亡情况取对数生长期U251细胞接种于6孔板中,每孔铺150 000个细胞,随机分为空白组、30 μmol·L-1LA组、60 μmol·L-1LA组、90 μmol·L-1LA组,每组2个复孔,分别于含0、30、60、90 μmol·L-1LA的培养基中干预24 h,用预冷磷酸盐缓冲液(phosphate buffer solution,PBS)冲洗贴壁细胞,用不含乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰酶消化,收集细胞,重悬后加入400 μL Annexin V结合液,加入5 μL FITC/PI室温避光孵育15 min,应用流式细胞仪检测细胞凋亡率。实验重复3次,取均值。
1.2.4 3-MA抑制剂实验检测细胞自噬能力根据预实验选择对U251增殖能力影响较弱的1 mmol·L-1作为3-MA实验浓度,对U251细胞活性影响最大的90 μmol·L-1作为LA单独用药浓度。将对数生长期U251细胞接种于96孔板中,每孔4 000个细胞,随机分为空白组、3-MA组、90 μmol·L-1LA组、30 μmol·L-1LA+3-MA组、60 μmol·L-1LA+3-MA组、90 μmol·L-1LA+3-MA组,每组设置5个复孔,每孔加入相应浓度的3-MA和LA各50 μL,干预24 h,再加入10 μL CCK-8试剂,37 ℃培养2~3 h,应用酶标仪检测450 nm波长处吸光度,以吸光度值表示细胞活性,吸光度值越大表示细胞活性越强。实验重复3次,取均值。
1.2.5 Western blot法检测U251细胞凋亡蛋白p53、Bax、Bcl-2、caspase-3和自噬蛋白LC3-Ⅰ、LC3-Ⅱ的表达将对数生长期U251细胞接种于6孔板中,每孔铺150 000个细胞,随机分为空白组、30 μmol·L-1LA组、60 μmol·L-1LA组、90 μmol·L-1LA组,每组2个复孔。分别于0、30、60、90 μmol·L-1LA的培养基中干预24 h,用细胞刮板收集加药干预后的U251细胞,置于离心管中,使用蛋白提取试剂盒提取细胞总蛋白,应用BCA法定量后,将蛋白质在质量分数10%~15%的聚丙烯酰胺凝胶上进行电泳,并转移蛋白至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上,用体积分数5%的脱脂牛奶封闭1 h,用含吐温-20的磷酸盐缓冲液(phosphate buffered solution with tween-20,PBST)清洗后加入p53(滴度11 000)、Bax(滴度11 000)、Bcl-2(滴度1:2 000)、caspase-3(滴度11 000)、LC3-Ⅰ(滴度11 000)、LC3-Ⅱ(滴度11 000)一抗及内参GAPDH,4 ℃冰箱过夜孵育;第2天,PBST洗涤3次,室温下加入HRP-羊抗兔二抗(滴度12 000)或HRP-羊抗鼠二抗(滴度13 000),室温孵育1 h,PBST洗涤3次,将增强化学发光液试剂A和试剂B按11的比例混匀,每条PVDF膜加入200 μL混合液覆盖,在暗室中使用Fluorchem E成像系统拍照获取蛋白条带照片,应用Image J系统分析各条带灰度值,以目的蛋白灰度值与内参蛋白灰度值比值表示目的蛋白相对表达量。实验重复3次,取均值。

2 结果
2.1 不同浓度LA对U251细胞生长的抑制作用比较结果见表1。培养24、48、72 h,30 μmol·L-1LA组、60 μmol·L-1LA组和90 μmol·L-1LA组的细胞增殖能力显著低于空白组,60 μmol·L-1LA组和90 μmol·L-1LA组细胞增殖能力显著低于30 μmol·L-1LA组,90 μmol·L-1LA组细胞增殖能力显著低于60 μmol·L-1LA组,差异有统计学意义(P<0.05)。空白对照组培养24、48、72 h时的细胞增殖能力比较差异无统计学意义(P>0.05)。30 μmol·L-1LA组培养72 h时的细胞增殖能力显著高于培养24、48 h时,差异有统计学意义(P<0.05);培养24 h与48 h 时的细胞增殖能力比较差异无统计学意义(P>0.05)。60 μmol·L-1LA组培养48、72 h时的细胞增殖能力显著低于培养24 h时,差异有统计学意义(P<0.05);培养48 h与72 h时的细胞增殖能力比较差异无统计学意义(P>0.05)。90 μmol·L-1LA组培养48、72 h时的细胞增殖能力显著低于培养24 h时,培养72 h时的细胞增殖能力显著低于培养48 h时,差异有统计学意义(P<0.05)。
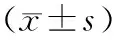
表1 4组U251细胞增殖能力比较
2.2 不同浓度LA对U251细胞凋亡率的影响结果见图1。空白组、30 μmol·L-1LA组、60 μmol·L-1LA组、90 μmol·L-1LA组细胞凋亡率分别为(2.89 ± 0.26)%、(13.5 ± 2.12)%、(22.74 ± 1.58)%、(25.75 ± 0.93)%。空白组、30 μmol·L-1LA组、60 μmol·L-1LA组、90 μmol·L-1LA组细胞凋亡率比较差异有统计学意义(F=53.600,P<0.05)。30 μmol·L-1LA组、60 μmol·L-1LA组、90 μmol·L-1LA组细胞凋亡率显著高于空白组,60 μmol·L-1LA组、90 μmol·L-1LA组细胞凋亡率显著高于30 μmol·L-1LA组,差异有统计学意义(P<0.05);60 μmol·L-1LA组与90 μmol·L-1LA组细胞凋亡率比较差异无统计学意义(P>0.05)。

A:空白组;B:30 μmol·L-1LA组;C:60 μmol·L-1LA组;D:90 μmol·L-1LA组。
2.3 6组U251细胞活性比较结果见表2。90 μmol·L-1LA组、90 μmol·L-1LA+3-MA组细胞活性低于空白组、3-MA组、30 μmol·L-1LA+3-MA组和60 μmol·L-1LA+3-MA组,90 μmol·L-1LA组细胞活性低于90 μmol·L-1LA+3-MA组,差异有统计学意义(P<0.05);空白组、3-MA组、30 μmol·L-1LA+3-MA组、60 μmol·L-1LA+3-MA组细胞活性比较差异无统计学意义(P>0.05)。
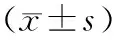
表2 6组U251细胞活性比较
2.4 4组U251细胞中p53、Bax、Bcl-2和caspase-3蛋白相对表达量比较结果见图2和表3。30 μmol·L-1LA组、60 μmol·L-1LA组和90 μmol·L-1LA组U251细胞中p53和Bax蛋白相对表达量高于空白组,30 μmol·L-1LA组U251细胞中caspase-3蛋白相对表达量低于空白组,90 μmol·L-1LA组U251细胞中Bcl-2蛋白相对表达量低于空白组、caspase-3蛋白相对表达量高于空白组,差异有统计学意义(P<0.05);30 μmol·L-1LA组和60 μmol·L-1LA组U251细胞中Bcl-2蛋白相对表达量及60 μmol·L-1LA组caspase-3蛋白相对表达量与空白组比较差异无统计学意义(P>0.05)。90 μmol·L-1LA组U251细胞中p53、Bcl-2蛋白相对表达量低于30 μmol·L-1LA组和60 μmol·L-1LA组,90 μmol·L-1LA组U251细胞中Bax、caspase-3蛋白相对表达量高于30 μmol·L-1LA组,90 μmol·L-1LA组U251细胞中caspase-3蛋白相对表达量高于60 μmol·L-1LA组,差异有统计学意义(P<0.05);90 μmol·L-1LA组与60 μmol·L-1LA组U251细胞中Bax蛋白相对表达量比较差异无统计学意义(P>0.05)。60 μmol·L-1LA组U251细胞中Bax、caspase-3蛋白相对表达量高于30 μmol·L-1组,差异有统计学意义(P<0.05);60 μmol·L-1LA组与30 μmol·L-1组U251细胞中p53、Bcl-2蛋白相对表达量比较差异无统计学意义(P>0.05)。

1:空白组;2:30 μmol·L-1 LA组;3:60 μmol·L-1 LA组;4:90 μmol·L-1 LA组。
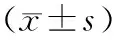
表3 4组U251细胞p53、Bax、Bcl-2和caspase-3蛋白相对表达量的比较
2.5 4组U251细胞中LC3-Ⅰ、LC3-Ⅱ蛋白相对表达量及LC3-Ⅱ/LC3-Ⅱ比值比较结果见图3和表4。4组U251细胞中LC3-Ⅰ蛋白相对表达量比较差异无统计学意义(P>0.05)。60 μmol·L-1LA组、90 μmol·L-1LA组U251细胞中LC3-Ⅱ蛋白相对表达量及LC3-Ⅱ/LC3-Ⅰ比值显著高于空白组和30 μmol·L-1LA组,差异有统计学意义(P<0.05);30 μmol·L-1LA组与空白组U251细胞中LC3-Ⅱ蛋白相对表达量及LC3-Ⅱ/LC3-Ⅰ比值比较差异无统计学意义(P>0.05),60 μmol·L-1LA组与 90 μmol·L-1LA组U251细胞中LC3-Ⅱ蛋白相对表达量及LC3-Ⅱ/LC3-Ⅰ比值比较差异无统计学意义(P>0.05)。

1:空白组;2:30 μmol·L-1 LA组;3:60 μmol·L-1 LA组;4:90 μmol·L-1 LA组。
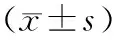
表4 4组U251细胞LC3-Ⅰ、LC3-Ⅱ蛋白相对表达量及LC3-Ⅱ/LC3-Ⅰ比值比较
3 讨论
神经胶质瘤是一种生存率低且复发性高的恶性肿瘤,按细胞类型分为星形细胞瘤、少突胶质细胞瘤、少突星形细胞瘤或室管膜瘤[10]。近几年来针对胶质瘤的新型治疗方法层出不穷,但其长期治疗效果仍不能令人满意,且新型治疗方法普及范围局限。因此,对胶质瘤的治疗目前仍需要积极探索新的有效药物。LA是从中药川芎根中提取出来的一种抗肿瘤药。研究表明,LA可通过活性氧途径诱导内质网应激促进细胞凋亡[9];在乳腺癌细胞中可逆转P-糖蛋白介导的表达,增加对阿霉素和长春新碱的敏感性[11];同时也通过泛素途径降低多药耐药蛋白1的表达来协同增强阿霉素诱导的K562/dox细胞凋亡[12]。
本研究结果显示,30 μmol·L-1LA组、60 μmol·L-1LA组和90 μmol·L-1LA组的细胞增殖能力显著低于空白组,60 μmol·L-1LA组和90 μmol·L-1LA组细胞增殖能力显著低于30 μmol·L-1LA组,90 μmol·L-1LA组细胞增殖能力显著低于60 μmol·L-1LA组;30 μmol·L-1LA组培养72 h时细胞增殖能力显著高于24、48 h时,60 μmol·L-1LA组培养48、72 h 时细胞增殖能力显著低于24 h时,90 μmol·L-1LA组培养48、72 h 时细胞增殖能力显著低于24 h,培养72 h时细胞增殖能力显著低于48 h时;30 μmol·L-1LA组、60 μmol·L-1LA组、90 μmol·L-1LA组细胞凋亡率显著高于空白组,60 μmol·L-1LA组、90 μmol·L-1LA组细胞凋亡率显著高于30 μmol·L-1LA组;90 μmol·L-1LA组、90 μmol·L-1LA+3-MA组细胞活性显著低于空白组、3-MA组、30 μmol·L-1LA+3-MA组和60 μmol·L-1LA+3-MA组,90 μmol·L-1LA组细胞活性显著低于 90 μmol·L-1LA+3-MA组。以上研究结果提示,LA能够抑制U251细胞的增殖,促进U251细胞的凋亡及自噬,且与作用浓度和时间有一定相关性。
细胞主要有内源性和外源性2种凋亡途径[13],caspase-3在2种途径中均起一定作用。p53可诱导大量基因参与细胞凋亡,其既可通过诱导BH3-only蛋白导致线粒体外膜通透化参与内源性凋亡途径,也可通过Fas和Dr5参与外源性凋亡途径[13-15]。Bcl-2蛋白家族能够调节内源性凋亡途径[15],Bax作为Bcl-2蛋白家族的成员之一,在凋亡中起着重要的促进作用[16]。Bcl-2则属于抗凋亡蛋白,通过螯合Bim来阻止Bax和Bak的激活来抗凋亡[14]。Bcl-2、Bax在肿瘤中的表达量是否平衡决定凋亡过程的发生。本研究结果显示,30 μmol·L-1LA组、60 μmol·L-1LA组和90 μmol·L-1LA组U251细胞中p53和Bax蛋白相对表达量高于空白组,30 μmol·L-1LA组U251细胞中caspase-3蛋白相对表达量低于空白组,90 μmol·L-1LA组U251细胞中Bcl-2蛋白相对表达量低于空白组、caspase-3蛋白相对表达量高于空白组;90 μmol·L-1LA组U251细胞中p53、Bcl-2蛋白相对表达量低于30 μmol·L-1LA组和60 μmol·L-1LA组,90 μmol·L-1LA组U251细胞中Bax、caspase-3蛋白相对表达量高于 30 μmol·L-1LA组, 90 μmol·L-1LA组U251细胞中caspase-3蛋白相对表达量高于 60 μmol·L-1LA组,60 μmol·L-1LA组U251细胞中Bax、caspase-3蛋白相对表达量高于 30 μmol·L-1组。这一结果说明,LA通过增加p53、Bax、caspase-3蛋白和减少Bcl-2蛋白的相对表达量调控U251细胞的凋亡,且与作用浓度有一定相关性,但完整的机制、信号通路还有待进一步研究。
在肿瘤发生的早期,自噬可阻止肿瘤的发生并抑制癌症的进展[17];一旦肿瘤发展到晚期,作为动态降解和再循环系统的自噬将有助于肿瘤的存活和生长,且可增加癌症的侵袭性[18]。LC3在细胞自噬成熟过程中被自噬相关基因(autophagy-related gene,ATG)4切割产生LC3-Ⅰ,ATG7和ATG3将LC3-Ⅰ结合到磷脂酰乙醇胺上形成脂溶性LC3-Ⅱ[18]。自噬体中LC3的存在以及转化成向下迁移的 LC3-Ⅱ是形成自噬小体的关键步骤,也是自噬发生的标志[19]。在应激条件下,自噬可以促进肿瘤细胞的存活,而凋亡途径阻止癌细胞的存活,自噬和凋亡作为2种分解代谢途径,对肿瘤微环境至关重要且联系复杂。Bcl-2被认为为自噬和凋亡的中枢调节因子,在应激条件下,c-Jun氨基酸末端激酶-1被激活,该酶调节Bcl-2的磷酸化,使Bcl-2从Beclin-1和Bax中被取代出来,以分别诱导自噬和凋亡[20-22]。此外,caspase家族作为众所周知的凋亡蛋白,也参与了自噬的过程,它们通过与自噬相关蛋白的相互作用和切割来阻碍或增强自噬[23]。本研究结果显示,4组U251细胞LC3-Ⅰ蛋白相对表达量比较差异无统计学意义(P>0.05);60 μmol·L-1LA组、90 μmol·L-1LA组U251细胞LC3-Ⅱ蛋白相对表达量及LC3-II/LC3-I比值显著高于空白组和30 μmol·L-1LA组;说明,LA可能通过LC3途径影响自噬通路,但其上下游相关分子还需进一步研究。
综上所述,LA能够通过增加凋亡蛋白p53、Bax、caspase-3和减少Bcl-2蛋白的表达,以及增加自噬蛋白LC3-Ⅱ的表达,抑制U251细胞的增殖,促进U251细胞的凋亡及自噬,这为临床上LA治疗胶质瘤提供了理论依据。但关于LA促进U251细胞的凋亡及自噬完整的机制尚不明确,仍需进一步研究。
