泛素结合酶9 通过核因子κB 通路诱导胃癌细胞SGC7901 凋亡的研究
2022-04-27袁金华曾宪晶刘伍才罗亮
袁金华,曾宪晶,刘伍才,罗亮
井冈山大学附属医院,江西 吉安 343000
胃癌是消化道常见的恶性肿瘤,根据全球癌症研究机构的数据统计,胃癌位于全球恶性肿瘤发病的第五位,死亡率位于第三位。我国是胃癌的高发区,发病率和死亡率分别占到全球的42.6%和45.0%[1],且发病呈年轻化趋势。当前胃癌治疗方法主要是手术、放疗和化疗,但预后较差,寻找有效的治疗手段对本病的治疗具有重要意义。
研究表明:核因子-κB(NF-κB)是真核细胞转录因子,NF-κB 信号通路可以调控细胞増殖、分化和凋亡等重要生理功能,与肿瘤发生密切相关[2]。泛素结合酶9(Ubc9)是小泛素相关修饰物(SUMO)过程中唯一的结合酶,Ubc9 在细胞增殖、有丝分裂、周期进程、分化等方面发挥着重要作用[3],Ubc9 在多种肿瘤中过表达,可能参与了肿瘤发生和进展的病理过程,并且可能与肿瘤的耐药相关[4],研究已证实Ubc9 是一个促癌基因[5],抑制Ubc9 基因后NF-κB 信号通路的凋亡蛋白降低[6]。基于此,我们推测Ubc9 基因可能通过影响NF-κB信号通路来抑制胃癌细胞的增殖及凋亡,为治疗提供理论参考。
1 材料与方法
1.1 主要实验材料
胃癌SGC7901 细胞株(购自上海赛默生物有限公司),兔抗Ubc9 单克隆抗体、兔抗p65 单克隆抗体、兔抗IKBα 单克隆抗体、兔抗Bcl-2 单克隆抗体、山羊抗小鼠β-actin(美国Abcam 公司),Ubc9 引物(Generay Biotech 公司),RNA 提取试剂盒(上海碧云天生物技术有限公司),PCR 检测试剂盒(上海碧云天生物技术有限公司),Opti-DMEM、转染试 剂Lipofectamine 2000(Invitrogen 公 司),Trizol Reagent(Invitrogen 公司),胎牛血清(上海碧云天生物技术有限公司),RPIM-1640 培养基(Hyclone公司)。
1.2 细胞培养、分组、转染
SGC7901 细胞复苏后培养于含10%胎牛血清的RPIM-1640 培养基中,于5%二氧化碳、37 ℃培养箱中传代培养,每3~4 d 按照1∶3 比例传代1 次,取对数生长期细胞进行相关实验。按5×104mL 的细胞密度接种至六孔板中后放入恒温培养箱中继续培养。将实验细胞分为四组:正常胃癌细胞A 组(Normal 组),脂质体B 组(Lipo-2000 组),空载质粒C 组(NC-shRNA 组),及目的质粒D 组(Ubc9-shRNA 组),质粒的构建与测序均由上海吉玛公司负责完成,细胞转染方法:准备5 个1.5 mL的EP 管,分别向每管内加入0.5 mL Opti-DMEM,其中2 个EP 管做好标记分别加入10 μg 空载质粒及目的质粒,余3 管加入20 μL 的lipo2000,混合后静置。接着向加入lipo2000 的3 个EP 管分别加入目的质粒、空载质粒以及500 μL Opti-DMEM,混匀,最后将配制好的各EP 管内液体分别加入所对应的培养皿中,置入培养箱中培养。
1.3 qRT-PCR 检测基因表达
细胞转染48 h 后,使用RNA 提取试剂盒提取细胞总RNA,并反转录得到cDNA,以此为模板进行qRT-PCR 目的基因扩增,结果计算根据LC 480检测得出的CT 值为cDNA 荧光强度达到所设定阀值的循环数,ΔCt=目的基因CT值-内参基因CT值,每个样品中mRNA 相对表达量=2-ΔCT× 100%。

表1 引物序列
1.4 Western blot 检测蛋白表达
采用蛋白提取试剂盒提取细胞总蛋白,BCA 法测定总蛋白浓度,上样SDS-PAGE 胶,电泳,转膜、封闭,抗体孵育,显影成像,利用凝胶图像处理系统分析目标条带灰度值,记录其相对表达量。
1.5 流式细胞仪检测细胞周期与凋亡
细胞周期检测:调整细胞浓度为1×106个/mL,离心,弃上清,重悬后收集细胞,采用1 mL 已配制好的周期试剂检测各组细胞的周期,按照试剂盒说明书进行反应后,30 min 内进行流式细胞仪检测细胞的周期。细胞凋亡测定:调整细胞浓度为1×106个/mL,离心,弃上清,重悬后收集细胞,滴 入500 μL Binding Buffer溶液重悬后加入5 μL AnnexinV-FITC 混匀,再加入5 μL 碘化丙啶,混匀,室温避光孵育,1 h 内应用流式细胞仪检测各组细胞的凋亡情况。
1.6 统计学方法
2 实验结果
2.1 转染效率检测
24 h 后在荧光显微镜下观察荧光的显示情况,当质粒成功转染后,质粒进入胃癌细胞即可在荧光显微镜呈现肉眼可见的绿色荧光,见图1。
图1 荧光显微镜下观察mir-Ubc9向SGC 7901细胞转移情况(×200)
2.2 RT-PCR 检测转染后各组Ubc9 基因mRNA 的表达水平
各组细胞经相应的处理24 h 后,将Normal 组,Lipo-2000 组,空载质粒NC-shRNA 组作为对照组,与对照组相比,人工合成的针对Ubc9 基因的miRNA 质粒(Ubc9-shRNA 组)能显著地抑制胃癌SGC7901 中Ubc9 基因的表达(0.31±0.06),差异有统计学意义(P<0.05)。见图2。

图2 各组泛素结合酶9 mRNA表达情况:A.正常胃癌细胞组;B.脂质体组;C.空载质粒组;D.目的质粒组
2.3 Western blot 检测转染mir Ubc9 后细胞内Ubc9与α-SMA 的表达水平
与对照组相比,人工合成的针对Ubc9 基因的miRNA 质粒明显抑制了SGC7901 中Ubc9 蛋白的表达,差异有统计学意义(0.28±0.06,P<0.05)。同时SGC7901细胞内α-SMA蛋白表达量也明显下降,差异有统计学意义(0.28±0.06,P<0.05)。见图3、表2。
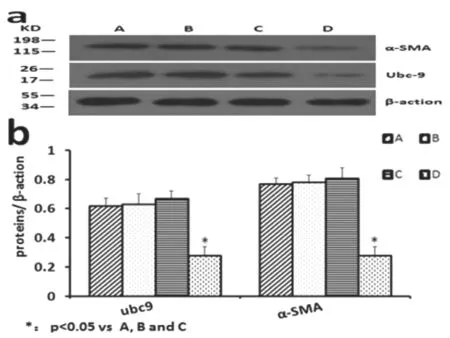
图3 各组泛素结合酶9和a-平滑肌肌动蛋白表达情况:A.正常胃癌细胞组;B.脂质体组;C.空载质粒组;D.目的质粒组
表2 各组泛素结合酶9和α-平滑肌肌动蛋白蛋白表达水平(,n=4)

表2 各组泛素结合酶9和α-平滑肌肌动蛋白蛋白表达水平(,n=4)
注:与D组比较,aP<0.05。
2.4 流式检测结果
2.4.1 细胞周期结果 实验结果显示:转染后胃癌SGC7901 细胞的周期被阻滞在G2/M 期,并且能够促进SGC7901 的凋亡,与各对照组相比差异有统计学意义(20.45±2.71,P<0.05),提示Ubc9 基因可能调控SGC7901 细胞的细胞周期。见图4、表3。

图4 细胞周期情况:A.正常胃癌细胞组;B.脂质体组;C.空载质粒组;D.目的质粒组
表3 各组SGC 7901细胞周期情况(,n=4)

表3 各组SGC 7901细胞周期情况(,n=4)
注:与D组比较,aP<0.05。
2.4.2 细胞凋亡结果 实验结果显示:转染后SGC7901细胞的凋亡增加明显,与各对照组相比差异有统计学意义(P<0.05),提示Ubc9 基因可能参与调控SGC7901 细胞的凋亡。见图5、表4。
表4 各组SGC 7901细胞凋亡率(,n=4)

表4 各组SGC 7901细胞凋亡率(,n=4)
注:与D组比较,aP<0.05。

图5 细胞凋亡情况:A.正常胃癌细胞组;B.脂质体组;C.空载质粒组;D.目的质粒组
2.5 Western blot 检测细胞IKBα、p65 与Bcl-2 蛋白表达结果
与对照组相比,Ubc9-shRNA 组SGC7901 细胞内p65 与Bcl-2 蛋白表达量明显下降(0.28±0.06,0.28±0.04,P<0.05),而IKBα 的表达量增加明显(0.9±0.05,P<0.05),差异有统计学意义(P<0.05)。见图6 与表5。

图6 各组相关蛋白表达情况:A.正常胃癌细胞组;B.脂质体组;C.空载质粒组;D.目的质粒组

表5 各组相关蛋白表达水平表
3 讨论
诱导肿瘤细胞凋亡是抗癌药物治疗肿瘤的重要机制之一[7-8]。研究表明,泛素样小分子修饰SUMO 参与了多种细胞进程,如细胞周期的调控、细胞增殖、细胞凋亡及DNA 损伤修复等[9]。SUMO是一个重要的、多步骤的蛋白质翻译后修饰过程,而Ubc9 在SUMO 化这一过程中至关重要,Ubc9 是SUMO 修饰过程中唯一的E2 结合酶[10],能增强SUMO 化修饰从而调控细胞凋亡[11]。
人类胃癌、肝癌、结直肠癌等肿瘤中均发现NF-κB 通路极度活跃,它可通过调节生长、细胞周期、细胞侵袭等相关环节促进癌变[12],NF-κB 是一种重要的核转录因子,与炎症、凋亡等过程密切相关。NF-κB 是普遍存在于细胞质中的一种快反应因子,在静息状态下,它与抑制因子IκB 形成复合物,以无活性的潜在状态存在于细胞质中。NF-κB信号通路是由细胞外的刺激引起的,受体蛋白接受刺激后先活化IκB 激酶(IKK)。IKK 将细胞内NFκB·IκB 复合物的IκB 亚基调节位点的丝氨酸磷酸化,使得IκB 亚基被泛素化修饰,进而被蛋白酶降解,从而释放NF-κB 二聚体[13]。p50 和p65 组成的二聚体为NF-κB 的主要形式,p50 是与DNA 结合的部位,p65 参与基因转录的起始调节,p65 是NF-κB 的主要活性形式,并可促进p50 与DNA 结合,当p65 与细胞质内抑制蛋白IκB 结合,可掩盖p50 上核定位信号,仅有p65 的蛋白C 末端含有转录激活区域,能够直接启动基因的转录[14-15]。本研究中观察:Ubc9 能抑制SGC7901 细胞内的p65入核,从而抑制NF-κB 进入细胞核与DNA 特定靶кB 部位结合,进而抑制NF-κB 的活化,同时本研究结果也发现胃癌SGC7901 细胞转染Ubc9 后,与各对照组比较,Ubc9-shRNA 组IKBα 表达量增加,p65 的表达量减少(P<0.05),提示人工合成的针对Ubc9 基因的miRNA 质粒明显能够抑制NF-κB的转录激活,证实了文献[13]研究结论,Ubc9 能与IKBα 结合并发生相互作用,延缓IKBα 的降解和NF-κB 的转录激活。
细胞凋亡一种程序性的细胞死亡,Bcl-2 基因主要的生理功能是减少细胞凋亡[16],研究发现Bcl-2 基因在多种恶性肿瘤组织中高表达。研究证实,凋亡是由于caspases 家族蛋白的瀑布式反应而导致的细胞自身溶解的过程,Bcl-2 蛋白不仅能抑制细胞凋亡,亦可能拮抗抑癌基因所介导的细胞凋亡。作为抗凋亡蛋白,Bcl-2 蛋白能够通过抑制肿瘤凋亡来促进其扩散。转录激活后入核的NF-κB 可调控反向凋亡相关基因Bcl-2、Bax 及细胞增殖相关基因Cyclin D1 的转录,从而发挥对细胞增殖、分化、凋亡及细胞周期的调控。在本次实验中,我们观察发现Ubc9 转染后胃癌SGC7901细胞的周期被阻滞在G2/M 期,并且细胞的凋亡增加明显,NF-κB 转录激活后Bcl-2 水平降低,与各对照组相比,差异有统计学意义(P<0.05),提示Ubc9 可能是通过NF-κB 通路影响Bcl-2 基因的表达来调控胃癌SGC7901 细胞的凋亡。Mo 等[17]下调Ubc9 后乳腺癌MCF-7 细胞生长受抑制,凋亡增加,Ubc9 是通过Bcl-2 发挥作用,结果表明Ubc9 通过影响Bcl-2 基因表达而具有抗凋亡作用。
综上所述,人工合成的针对Ubc9 基因的miRNA质粒能够抑制SGC7901 细胞的增殖并促进其凋亡,为胃癌的治疗提供了一种新的实验依据。然而对于其具体的通路以及如何影响胃癌细胞周期的分子机制尚未明确。
