藜蒿黄酮微胶囊工艺优化及释放动力学研究
2022-04-26曹新华
徐 媛,王 璐,冷 艳,曹新华
(江汉大学生命科学学院,湖北 武汉 430056)
藜蒿(Artemisia selengensisTurcz.)为菊科蒿属多年生草本植物,别名香艾蒿,芦蒿,蒌蒿等[1]。藜蒿香气馥郁,味道鲜美,食用价值极高。国内外研究发现藜蒿根茎中富含黄酮、多酚、萜类及多糖等活性成分,具有重要的药理和营养功能,可用于医药、食品等领域[2−4]。黄酮类化合物具有抗氧化、抗肿瘤、预防心血管和防治呼吸系统疾病等作用,尤其对甲型流感病毒H1N1具有较好的抑制作用[5−6];其降解产物脱氨基酪氨酸(Deaminotyrosine, DAT)是开启人体免疫保护和增强病毒抵御免疫反应的关键因子,研究表明,黄酮类化合物对包膜RNA病毒如拉沙病毒等的感染途径均有阻断作用,具有广谱抗病毒活性。因此,黄酮类化合物可为免疫力低下或病毒易感人群提供有效的功能保障[7]。
然而,黄酮类化合物难溶于水,稳定性差,易受氧气、pH和温度等影响而失去生物活性,严重限制其应用性和持效性[8−9]。微胶囊技术正是解决这一问题的有效途径,利用聚合物壁材包裹形成微型包埋物,使活性成分免受外界环境的影响,在提高芯材稳定性的同时达到组分控制释放的功能[10−12]。β-环糊精(βcyclodextrin, CD)是由7个D-葡萄糖分子以α-1,4-糖苷键连接而成的圆台状环化物,其表面由多羟基形成亲水区,内部中空部位由疏水的C-H键和环氧基形成疏水区,疏水中心可与大小形状合适的疏水物质包接形成络合物以完成包埋[13−15]。利用β-环糊精包裹藜蒿黄酮形成微胶囊的技术,可以拓展黄酮类化合物在食品工业中的实际应用范围。
近年来,藜蒿中黄酮类化合物的研究进展主要集中在提纯工艺的优化、结构鉴定及抗氧化能力等方面[16−18];而如何通过微胶囊技术提高其贮藏稳定性以优化藜蒿黄酮类功能性产品的实际应用是亟待解决的问题,然而,目前对藜蒿黄酮化合物的微胶囊制备及其工艺优化未有报道。在食品工业实际产品开发过程中,微胶囊中芯材的释放性能对功能性食品的贮藏稳定性有及其重要的作用[19−20];且芯材的释放性能与及其动力学会随贮藏环境的变化呈现不同情况[21−22]。
现阶段黄酮微胶囊化研究主要集中在制备工艺及部分功能活性,有关黄酮微胶囊的释放动力学及释放性能的研究鲜少报道。因此,本研究以β-环糊精为壁材,采用分子包埋法进行藜蒿黄酮微胶囊制备,通过控制芯壁比、包埋时间和包埋温度对藜蒿黄酮微胶囊包埋率进行研究,利用响应面法对微胶囊工艺参数进行优化,并进一步对藜蒿黄酮微胶囊在贮藏期间的释放动力学进行探讨,从而为藜蒿黄酮类化合物的开发应用提供科学依据。
1 材料与方法
1.1 材料与仪器
新鲜藜蒿 采自武汉市荷香源农业发展有限公司;芦丁标品 纯度≥98%,购于中国药品生物制品鉴定所;β-环糊精 分析纯,购于天津博迪化工股份有限公司;亚硝酸钠、无水乙醇、硝酸铝、氢氧化钠
分析纯,购于上海化学试剂有限公司。
RE52-99型旋转蒸发器 上海亚荣生化仪器厂;UV-1700 SPC型紫外可见分光光度计 日本SHIMADZU公司;SHA-B恒温振荡器 常州电器有限公司;HWS-1000F恒温恒湿培养箱 上海丙林电子科技有限公司;DHG-9140A 电热恒温干燥箱 宏华仪器设备有限公司;GT-100高通量组织研磨仪 北京格瑞德曼仪器设备有限公司;DZF-6050真空干燥箱
上海一恒仪器有限公司;HJ-3数显恒温磁力搅拌器 常州国华电器有限公司。
1.2 实验方法
1.2.1 藜蒿中黄酮类化合物的提取 新鲜藜蒿根茎置于电热恒温干燥箱(60 ℃)内恒温干燥处理,每隔1 h称重直至恒重,在1200 r/min下研磨1 min,密封保存于棕色瓶中。精确称取1.00 g藜蒿粉末,以50 mL 70%乙醇为提取溶剂,在180 r/min、50 ℃下恒温振荡提取2 h,获得提取液[23−24]。相同条件重复提取2次,合并提取液并抽滤、浓缩,真空干燥即得藜蒿黄酮提取物。
1.2.2 藜蒿黄酮微胶囊的制备 按一定芯材壁材质量比例(芯壁比)准确称量β-环糊精溶于40 ℃蒸馏水,制成饱和溶液。根据芯壁比取一定质量藜蒿黄酮溶于5 mL无水乙醇溶液,用滴管缓慢滴加适量藜蒿总黄酮提取液到β-环糊精饱和溶液中,在设定温度下用磁力搅拌器搅拌一定时间后,冷却至室温,即得藜蒿总黄酮微胶囊混悬液[25−26]。放置于4 ℃下平衡12 h,过滤分离产物,将下层湿浆在0.04 Mpa,50 ℃条件下恒温加热真空干燥4 h,即得藜蒿黄酮微胶囊产品。
1.2.3 黄酮微胶囊的制备工艺优化设计
1.2.3.1 单因素实验 按1.2.2工艺方法操作,制备藜蒿黄酮类化合物微胶囊。分别以芯壁比(m/m)(1:1、1:2、1:4、1:6、1:8 g/g)、包埋时间(30、40、50、60、70 min)和包埋温度(30、40、50、60、70、80 ℃)为单因素进行实验,在考察单因素对藜蒿黄酮微胶囊包埋率的影响时,其它各变量固定取值分别为芯壁比1:4 g/g、包埋时间60 min、包埋温度60 ℃。
1.2.3.2 Box-Behnken响应曲面法优化藜蒿黄酮微胶囊制备工艺 根据单因素实验结果,利用Minitab 16软件进行响应曲面试验设计与分析,选择包埋时间(A)、包埋温度(B)、芯壁比(C)进行三因素三水平的Box-Behnken试验,以藜蒿黄酮微胶囊包埋率为响应值,确定微胶囊制备的最佳工艺条件。响应曲面优化试验因素及水平见表1。
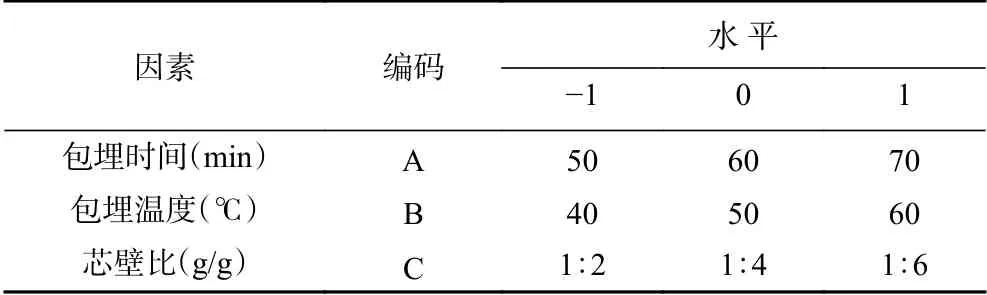
表1 响应面试验因素与水平Table 1 Factors and levels of response surface experiments
1.2.4 藜蒿黄酮微胶囊释放动力学的分析方法
Avrami’s方程可用于气固及液固释放动力学,多数研究表明微胶囊释放动力学符合Avrami’s方程[27−28],假设藜蒿黄酮微胶囊也符合此方程,其释放速率常数k和释放机理参数n可由下式计算得出:
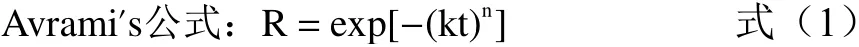
对公式两边取对数可得:

公式(1)、(2)中,R为芯材残留量,即黄酮在释放后的保留率,%;k为释放速率常数;n为释放机理参数;t为贮藏时间,d。
释放动力学分析实验主要考察不同环境温度和相对湿度对藜蒿黄酮微胶囊释放动力学的影响。温度效应实验模拟常见食品贮藏温度4、25和45 ℃(低温、常温、高温),选择在恒温恒湿箱中保持相对湿度50%条件下贮藏18 d,定期测定藜蒿黄酮微胶囊的保留率;湿度效应实验则模拟在25 ℃室温环境中且相对湿度分别为50%、70%和90%(低湿、中湿、高湿)条件下,研究藜蒿黄酮微胶囊在18 d贮藏过程中的保留率以分析其释放行为[29−30]。
以l nt 为 横坐标,l n(−lnR)为纵坐标做线性回归方程,计算可得释放速率常数k和释放机理参数n。根据扩散动力学理论,当n=0.54时说明释放属于扩散限制反应动力学;当n=1时代表释放过程遵循一级反应释放动力学[31]。
1.2.5 藜蒿中黄酮类化合物的测定
1.2.5.1 黄酮标准曲线的绘制 精确称取真空干燥恒重的芦丁标准品25 mg,用95%乙醇溶解并定容至100 mL容量瓶中,摇匀得0.25 mg/mL的芦丁标准溶液。分别精确吸取0、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8 mL于10 mL容量瓶中,加入5% NaNO2溶液0.3 mL,摇匀后静置6 min,再加入10%的Al(NO3)3溶液0.3 mL,静置6 min,再加入4% NaOH溶液4 mL,并用无水乙醇定容至10 mL后,摇匀静置15 min。选定510 nm为黄酮类化合物测定波长,测定各浓度标准液的吸光值A[32]。以吸光值为纵坐标,芦丁浓度C(mg/mL)为横坐标绘制标准曲线为A=11.35C−0.004,R2=0.9993。
1.2.5.2 藜蒿中黄酮类化合物的含量测定 精确量取藜蒿黄酮提取液2 mL,按照1.2.5.1方法处理黄酮提取液后,测定各条件下溶液吸光值,并根据标准回归曲线计算藜蒿总黄酮含量。计算得藜蒿黄酮提取液中总黄酮含量为153 mg/g。
1.2.6 微胶囊包埋率测定 微胶囊表面藜蒿黄酮含量测定:精密称取0.25 g藜蒿黄酮微胶囊产品,少量多次加入无水乙醇,充分振荡、洗涤以洗掉微胶囊表面黄酮,静置溶液并过滤[33]。将上清液用无水乙醇定容至25 mL,按照黄酮含量测定方法测定微胶囊表面黄酮质量m(g)。
微胶囊产品藜蒿黄酮总量测定:精密称取0.25 g藜蒿黄酮微胶囊产品,用适量蒸馏水完全溶解后,加入无水乙醇,充分振荡、静置并过滤,将上清液用无水乙醇定容至25 mL测定总黄酮含量M(g)。
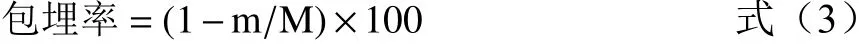
1.2.7 藜蒿黄酮微胶囊中黄酮保留率的测定 根据1.2.4的温度效应实验和湿度效应实验设定温湿度参数,分别称取藜蒿黄酮微胶囊产品(总黄酮质量M,表面黄酮质量m)置于恒温恒湿培养箱中贮藏18 d,间隔3 d测定微胶囊产品表面的黄酮质量m1,按公式(4)计算藜蒿黄酮微胶囊中黄酮保留率[34]。
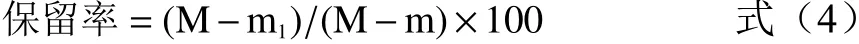
1.3 数据处理
各样品黄酮含量测定均重复三次并求平均值。所有数据通过SPSS 19.0软件进行显著性分析,水平为0.05。
2 结果与分析
2.1 单因素实验
2.1.1 芯壁比对藜蒿黄酮微胶囊化的影响 从图1中可以看出,当加入的藜蒿黄酮含量与β-环糊精含量为1:8 g/g时,较小的芯壁比值会导致壁材β-环糊精与芯材黄酮类化合物不能充分接触,微胶囊化效率即包埋率较低;继续增大芯材所占比例,微胶囊包埋率会逐渐增加,且当比值达到1:4 g/g时,总黄酮的包埋率达到最大值;然而若继续增大黄酮含量以提高芯壁比值,就会造成单位壁材的包埋量过大而超过β-环糊精的包裹限度,使芯材附着在壁材的表面,而降低了β-环糊精对总黄酮的包覆效果,从而导致藜蒿总黄酮微胶囊产品的制备效率降低。因此,选择芯壁比1:2~1:6 g/g进行后续试验。

图1 芯壁比对包埋率的影响Fig.1 Effect of the core-wall ratio on the rate of embedding
2.1.2 包埋时间对藜蒿总黄酮微胶囊化的影响 理论上,微胶囊化的效率会随着制备过程中搅拌时间的增加而提高。但从图2中可以看出,微胶囊化时间为30~60 min时,包埋率随时间延长呈上升趋势,但包埋时间超过60 min后,微胶囊化效率随着时间的延长而呈逐渐下降的趋势,可见藜蒿总黄酮的微胶囊化效率并不是简单地随着包埋时间的增加而与之成正相关。这可能是由于在微胶囊化过程中,随着包埋时间的延长,黄酮类分子进入β-环糊精分子的空腔结构内越多,随着β-环糊精的内部空腔被芯材逐渐占据,壁材对黄酮的包埋能力逐渐饱和,继续延长包埋的搅拌时间可能会破坏已经形成的微胶囊包合物,从而将导致包埋率下降[35]。因此选择包埋时间50~70 min进行后续试验。
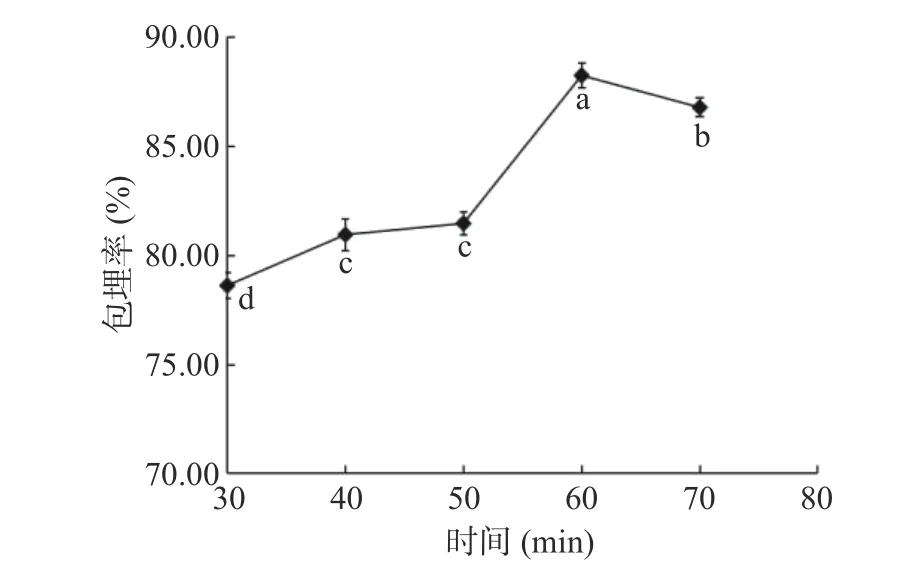
图2 包埋时间对包埋率的影响Fig.2 Effect of embedding time on the rate of embedding
2.1.3 包埋温度对藜蒿总黄酮微胶囊化的影响 由图3可以看出,在30~50 ℃范围内随着包埋温度的升高,黄酮的包埋率有所增加,但升高幅度较为平缓;而当制备温度超过50 ℃后,藜蒿总黄酮的微胶囊化效率开始下降。这主要是由于在微胶囊制备开始时,提高包埋温度有利于β-环糊精在水溶液中的溶解,因此,能提供大量溶解的分子状态的β-环糊精包埋住黄酮类分子而形成微胶囊。然而若继续升高包埋温度,壁材可能会发生热降解从而影响黄酮的微胶囊化效率,且由于包埋制备反应为放热反应[36],当包埋温度增加过高时就可能会对黄酮微胶囊的形成造成一定的阻碍,因此,藜蒿中黄酮类化合物在50 ℃条件下会有较高且稳定的包埋率,故选择包埋温度40~60 ℃进行后续试验。
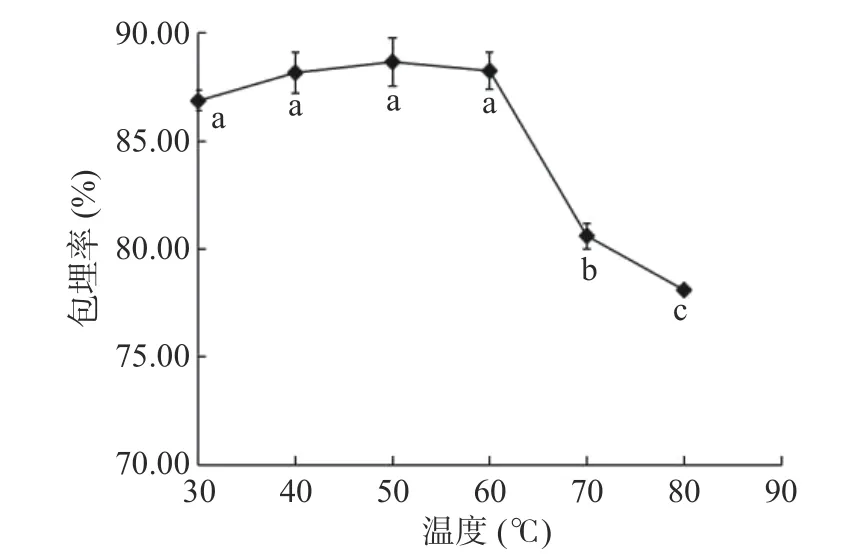
图3 包埋温度对包埋率的影响Fig.3 Effect of embedding temperature on the rate of embedding
2.2 响应曲面法优化藜蒿黄酮微胶囊制备工艺
2.2.1 响应曲面设计方案及结果 在单因素实验的基础上,选出影响黄酮微胶囊化包埋率的包埋时间(A)、包埋温度(B)和芯壁比(C)3个主要因素,运用Minitab 16 软件进行响应曲面(RSM)的试验设计,以表1的因素水平设计得到15组试验。该试验设计方案及其响应值包埋率结果见表2。
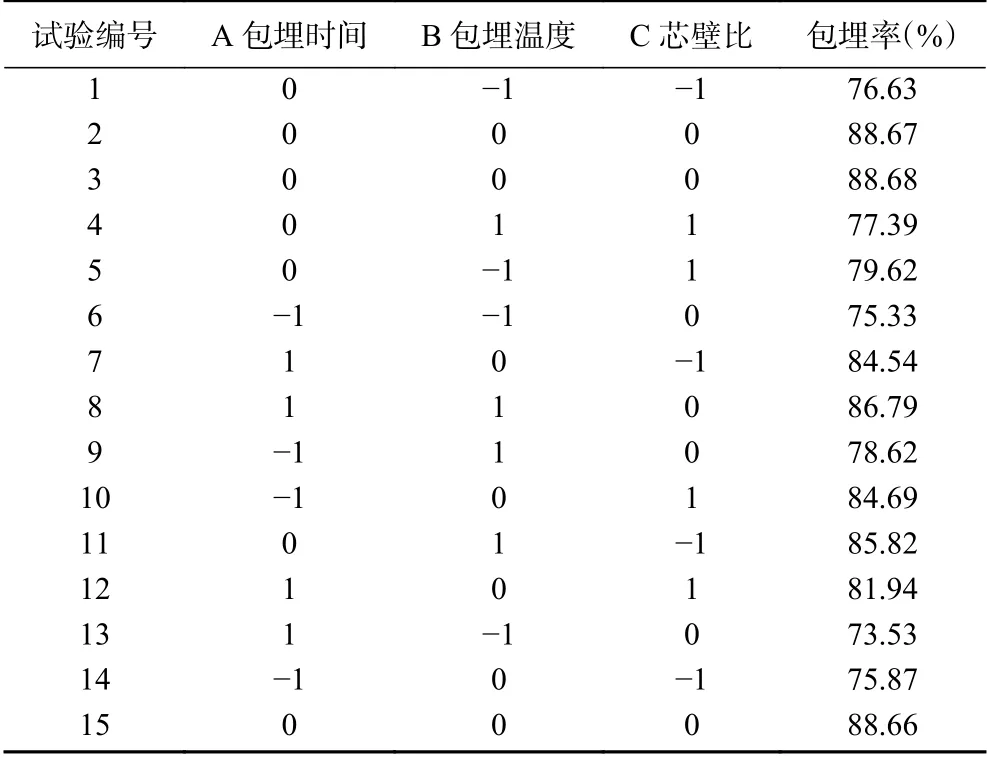
表2 响应曲面设计方案及结果Table 2 Design and results of response surface experiments
2.2.2 回归模型的建立及显著性分析 应用Minitab 16 软件,以包埋时间、包埋温度、芯壁比为响应变量,并以微胶囊后的黄酮包埋率为响应值,对表2中的数据进行多元回归拟合,获得藜蒿总黄酮包埋率对芯壁比、包埋时间和包埋温度的二次多项回归方程:Y=0.886687+0.0139A+0.0294B+0.0024C−0.0396A2−0.0614B2−0.0267C2+0.0249AB−0.0313AC−0.0285BC,对该模型进行显著性检验及方差分析结果见表3。
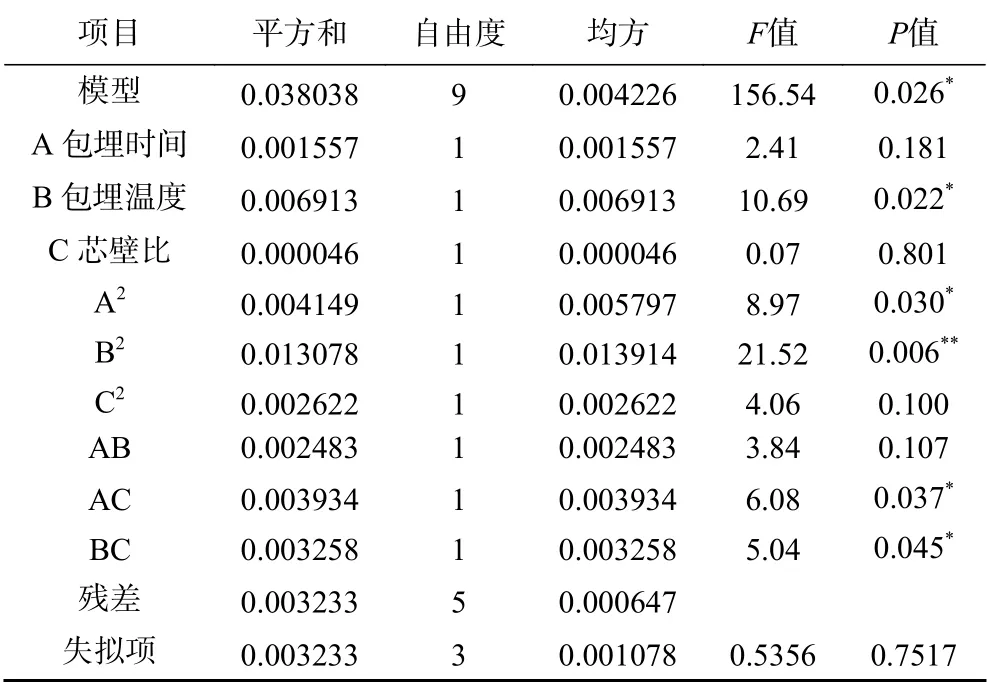
表3 回归方程方差分析Table 3 Regression equation analysis of variance
由表3可知,模型的F值为156.54证明模型是显著的,失拟值为0.7517>0.05,表明失拟不显著。模型决定系数R2=0.9771,表明总黄酮包埋率的实际值与预测值间具有较好拟合度,模型校正决定系数R2Adj=0.9217,说明该模型能解释约92.17%包埋率的变化,因此,可以较好分析和预测藜蒿中总黄酮的微胶囊化工艺。F值的大小可反映各实验变量对响应值的影响力,从表3可得出各制备因素对藜蒿中总黄酮微胶囊化效率的影响大小顺序为:包埋温度(B)>包埋时间(A)>芯壁比(C)。
回归模型的一次项B显著(P<0.05),二次项A2显著(P<0.05)、B2极显著(P<0.01),交互项AC、BC显著(P<0.05),AB不显著(P>0.05),说明不同的微胶囊化工艺与藜蒿黄酮包埋率不是简单的线性关系。
2.2.3 响应曲面分析及优化 如图4~图6所示,分别为两因素交互作用的响应曲面及其等高线。表示了当包埋时间、包埋温度和芯壁比3个因素中任意一个变量为零水平时,其余2个变量对藜蒿黄酮微胶囊包埋率的影响。
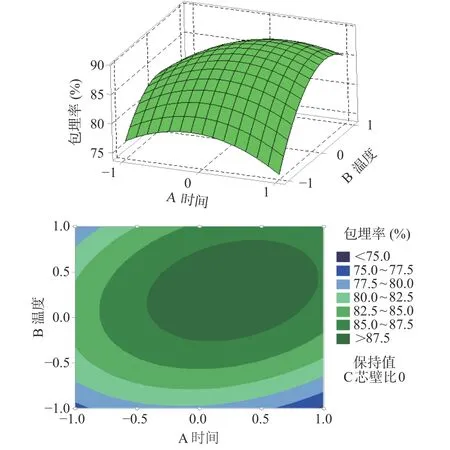
图4 包埋时间和包埋温度交互项的响应曲面和等高线图Fig.4 Response surface and contour plots for the effect of the interaction of embedding time and embedding temperature
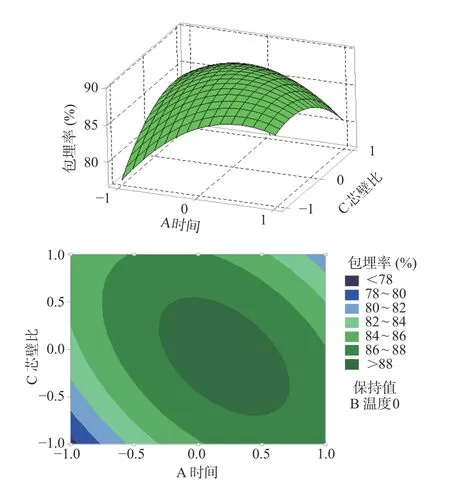
图6 芯壁比和包埋时间交互项的响应曲面和等高线图Fig.6 Response surface and contour plots for the effect of the interaction of core-to-wall material ratio and embedding time
以上所示相应的响应曲面及其等高线图是根据回归分析结果做出的。由图可以确定,包埋温度、包埋时间及芯壁比3个因素对藜蒿总黄酮包埋率的影响。由图可知,包埋温度相较于包埋时间、芯壁比的曲线较为陡峭,说明包埋温度对于黄酮包埋率的影响较显著些;包埋温度固定时,包埋时间的曲线比芯壁比的陡峭,再一次验证藜蒿黄酮微胶囊化过程中,包埋温度的影响最大,包埋时间其次,芯壁比的影响最小。
由响应面的最高点和等高线圆心分布可看出,在所选范围内藜蒿总黄酮的包埋率存在极值。等高线的形状反映了因素间交互影响的大小。当等高线呈圆形时,两因素间的交互作用相对较弱;而当等高线趋于椭圆形时则表明两因素间的交互作用相对较强。由等高线的形状看出,包埋时间和芯壁比以及包埋温度和芯壁比的交互作用显著,包埋时间和包埋温度的交互作用不显著,与表3结果相统一。根据试验所设定的参数范围,采用Minitab 16软件处理可以得到藜蒿黄酮包埋率最大为89.66%,所对应的最佳工艺参数为:包埋时间为65.35 min,包埋温度为54.74 ℃,芯壁比为1:2.96 (g/g)。
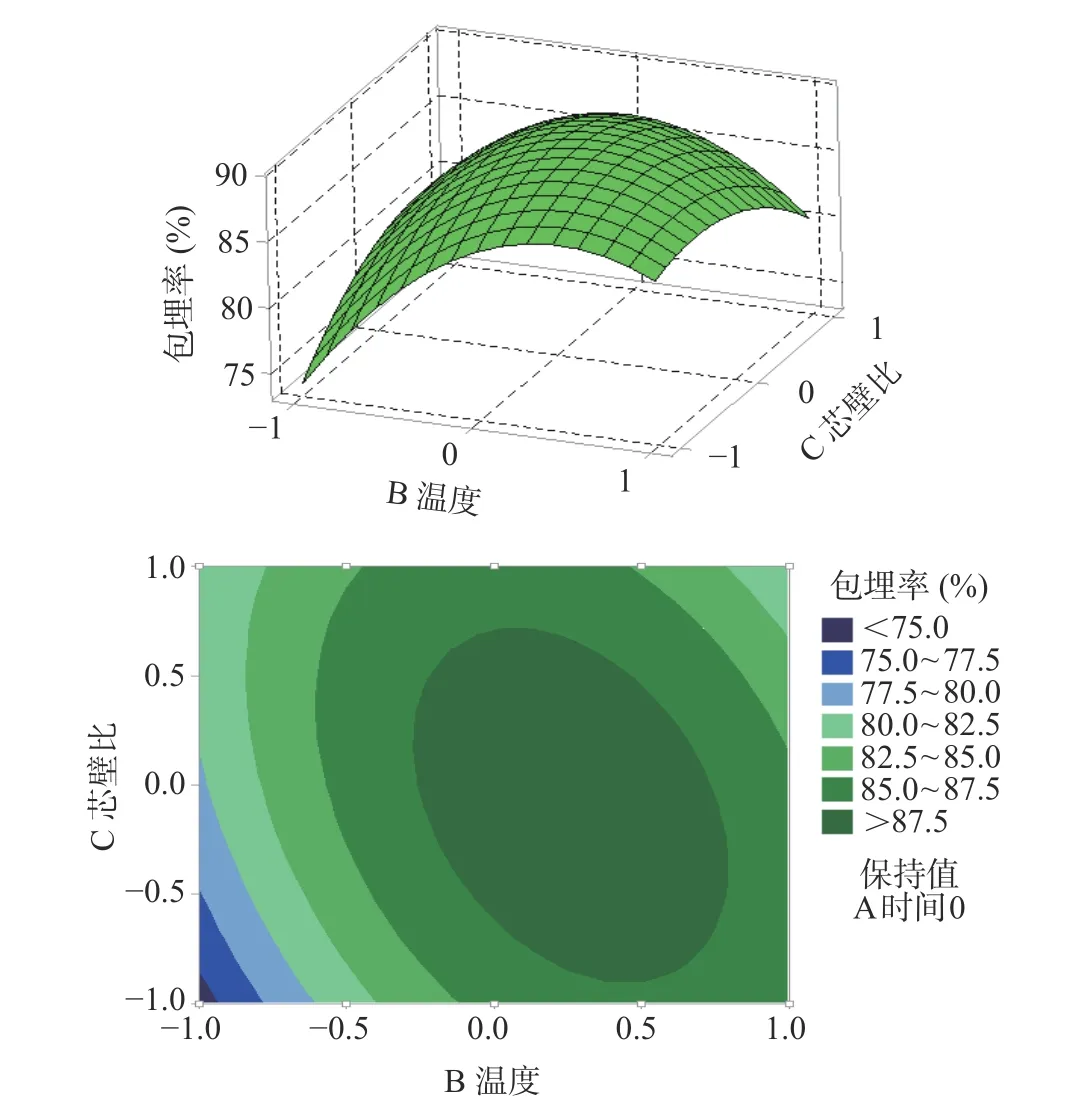
图5 包埋温度和芯壁比交互项的响应面和等高线图Fig.5 Response surface and contour plots for the effect of the interaction of embedding temperature and core-to-wall material ratio
2.2.4 藜蒿黄酮微胶囊化工艺条件的确定 对响应曲面法所得结果的可靠性进行检验,并考虑其可操作性,将微胶囊化工艺调整为:包埋时间65 min,包埋温度55 ℃,芯壁比为1:3 (g/g)。在此条件下进行3次验证性实验,得到藜蒿黄酮类化合物的平均包埋率为89.52%,与预测值89.66%相比,相对偏差为0.11%。说明了响应曲面分析法可得到最佳工艺的包埋效果,从而验证了该回归模型是合理的。
2.3 藜蒿黄酮微胶囊在贮藏过程中的释放动力学
2.3.1 温度对藜蒿黄酮微胶囊中黄酮保留率的影响
从图7可知,黄酮保留率随着贮藏时间的延长呈下降趋势;在同一贮藏时间下,温度越高,藜蒿黄酮微胶囊的保留率越低。贮藏18 d后,4 ℃下微胶囊中黄酮保留率最高,达98.14%;同一时间下25和45 ℃的黄酮保留率仅为89.35%和73.82%。由实验结果可知,随着贮藏时间的延长,藜蒿黄酮微胶囊的芯材逐渐释放,黄酮保留率逐渐减少,当产品贮藏温度逐渐升高时,芯材的释放速率加快。温度升高促使微胶囊壁材形成的包膜破损,膜壁空隙增大,黄酮释放受到的阻力变小,释放速率加快[37];另外,高温将导致芯材的分子活化能增大,分子热运动加快,从而加速释放[38]。因此,藜蒿黄酮微胶囊的贮存过程应尽量避免高温。
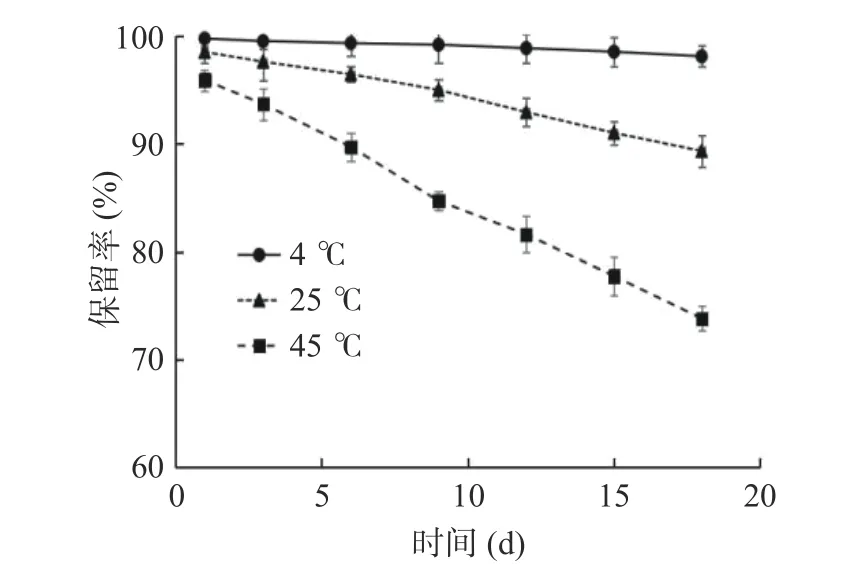
图7 不同温度下微胶囊的黄酮保留率Fig.7 Flavonoids retention rate of the microcapsules at different temperatures
2.3.2 Avrami’s公式对不同温度下藜蒿黄酮微胶囊的释放动力学分析 Avrami’s公式对不同温度下黄酮微胶囊释放动力学的拟合曲线见图8。由表4可知,藜蒿黄酮微胶囊在各温度下各回归方程的R2均在0.95以上,表明Avrami’s公式对不同温度下黄酮释放过程的拟合性较好,因此采用Avrami’s公式进行黄酮芯材释放动力学分析是切实可行的[39]。4、25、45 ℃下释放机理参数分别为0.7113、0.7105和0.7049,均在0.54~1.00之间,表明藜蒿黄酮微胶囊的释放反应动力学介于扩散限制动力学与一级反应动力学之间。对比不同温度条件下的释放速率常数k发现,随着温度升高释放速率常数增大明显。说明不同温度下藜蒿黄酮微胶囊的释放过程为非稳态、非恒速过程[40−41],低温贮藏(4 ℃)将有效稳定微胶囊的释放。
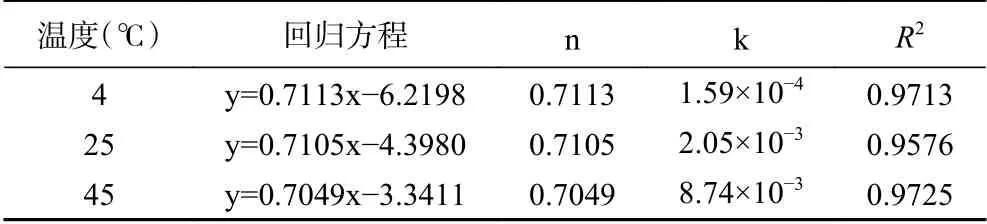
表4 不同温度下的黄酮释放机理参数及释放速率常数Table 4 Release mechanism parameters and release rate constants of flavonoids at different temperatures
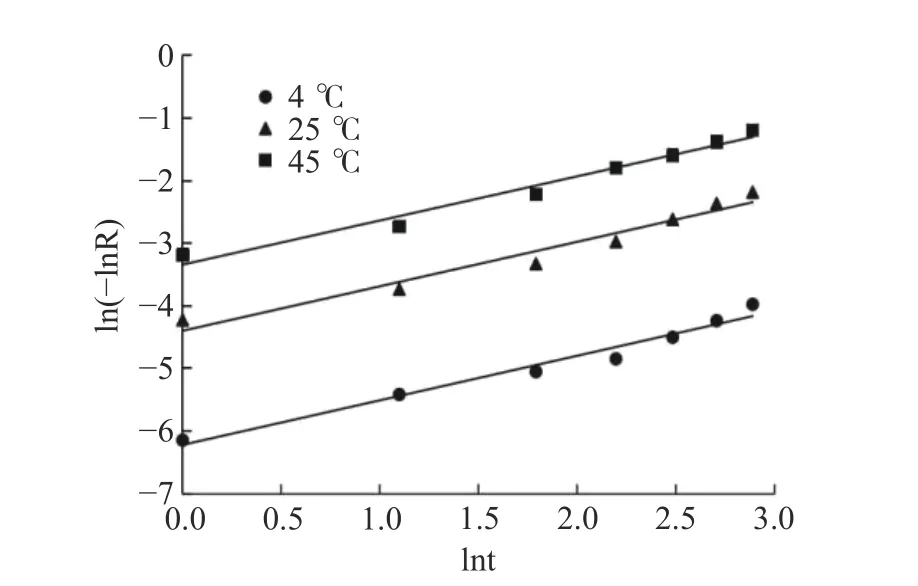
图8 藜蒿黄酮微胶囊在不同温度下释放动力学的Avrami’s 分析Fig.8 Avrami's analysis of release kinetics of Artemisia selengensis flavonoids microcapsules at different temperatures
2.3.3 湿度对藜蒿黄酮微胶囊中黄酮保留率的影响
从图9可知,黄酮保留率随着相对湿度增大而迅速下降。贮藏18 d后,50% RH条件下黄酮保留率达到89.35%,而90% RH条件下黄酮保留率仅为56.26%。同一贮藏时间下,相对湿度越大,黄酮保留率越低。表明藜蒿黄酮微胶囊在相对湿度较低条件下释放较为缓慢,而相对湿度较高的贮藏环境会显著增加其释放速率。壁材β-环状糊精外部亲水,相对湿度增加将导致水分子经微胶囊表面微孔进入内部,从而使壁材机械强度与致密性发生改变,从而破坏壁材对芯材的保护作用,加速黄酮的渗透与释放[42]。与图7对比可知,高湿条件对黄酮微胶囊的破坏程度明显高于高温条件下芯材的释放率,故在贮藏时,应尽量保持较低的环境湿度。
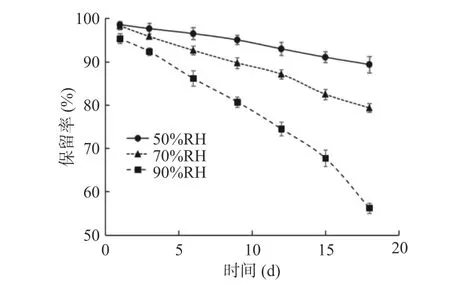
图9 不同湿度下微胶囊的黄酮保留率Fig.9 Flavonoids retention rate of the microcapsules at different relative humidity
2.3.4 Avrami’s公式对不同湿度下藜蒿黄酮微胶囊的释放动力学分析 Avrami’s公式对不同湿度下黄酮微胶囊释放动力学的拟合曲线见图10。由表5可知,藜蒿黄酮微胶囊在RH 50%、70%、90%条件下,各回归方程的R2均在0.95以上,表明Avrami’s公式对不同湿度下黄酮释放过程的拟合性较好。各湿度下藜蒿黄酮微胶囊释放机理参数n分别为0.7105、0.8823和0.8400,均在0.54~1.00之间,说明其释放反应动力学介于扩散限制动力学与一级反应动力学之间。随着相对湿度增加,微胶囊的释放速率常数k迅速增加,RH为90%的k值比RH为50%的k值高出约10倍;且与不同温度条件下释放动力学相比,高湿贮藏条件下的k值明显高于高温条件下的k值,与前面讨论一致,说明藜蒿黄酮微胶囊产品对相对湿度更为敏感,干燥环境将有利于微胶囊的贮藏。
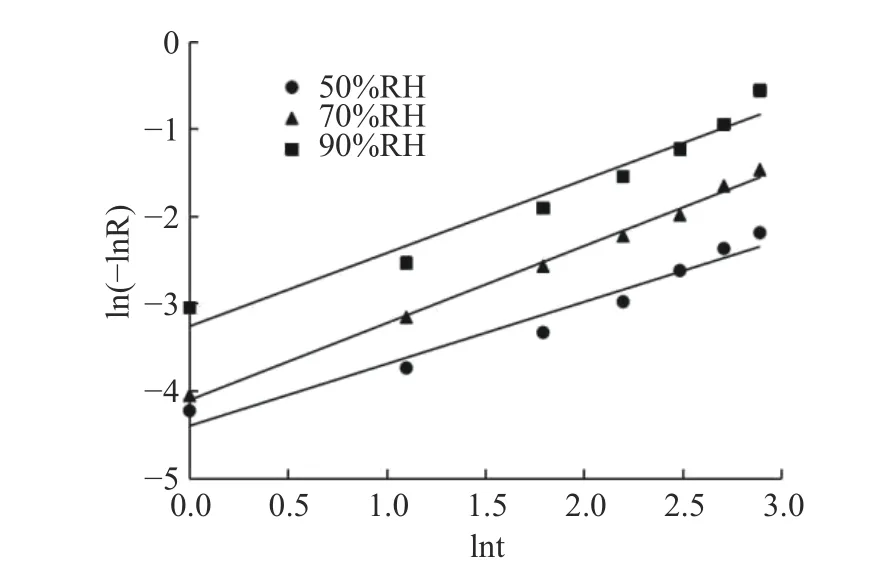
图10 藜蒿黄酮微胶囊在不同湿度下释放动力学的Avrami’s 分析Fig.10 Avrami's analysis of release kinetics of Artemisia selengensis flavonoids microcapsules at different humidity
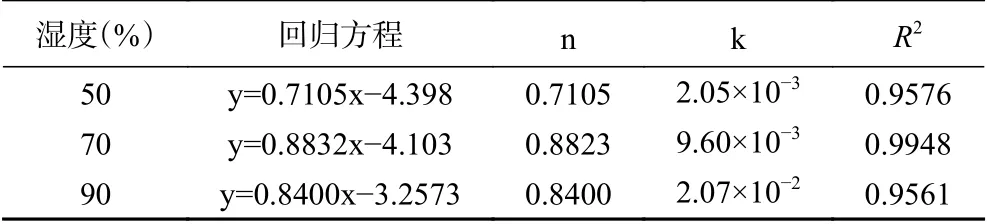
表5 不同湿度下的黄酮释放机理参数及释放速率常数Table 5 Release mechanism parameters and release rate constants of flavonoids at different humidity
3 结论
采用分子包埋法以β-环糊精为壁材制备藜蒿黄酮微胶囊。通过研究包埋时间、包埋温度和芯壁比对藜蒿黄酮微胶囊包埋率的影响,设计响应曲面试验优化微胶囊制备工艺,得出包埋温度对微胶囊化效率影响最大,在包埋时间65 min,包埋温度55 ℃,芯壁比为1:3 (g/g)条件下包埋效果最优,得到藜蒿黄酮微胶囊的平均包埋率为89.52%。
运用Avrami’s公式分析不同温度与相对湿度下藜蒿黄酮微胶囊的释放性能。研究表明,随着贮藏温度和相对湿度的增加,藜蒿黄酮微胶囊的释放速率均显著增加;与温度相比,高湿环境更能加速藜蒿黄酮微胶囊的释放。藜蒿黄酮微胶囊在4、25、45 ℃和相对湿度50%、70%、90%时,其释放机理参数介于0.54~1.00之间,表明其释放动力学介于扩散限制动力学与一级释放动力学之间。低温低湿环境下藜蒿黄酮微胶囊能实现芯材的缓慢释放,有利于提高藜蒿黄酮的贮藏稳定性与维持其功能活性。藜蒿黄酮微胶囊的释放性能受到多因素的综合影响,因此有待进一步研究实际应用中藜蒿黄酮微胶囊的稳定性与缓释性能。
