他克莫司治疗儿童肾小球疾病血药浓度监测及临床疗效评价
2022-04-26陈慧颖邓芳梅康康詹迪迪彭寅蔡和平
陈慧颖 邓芳 梅康康 詹迪迪 彭寅 蔡和平
原发性肾小球疾病是儿童常见的肾脏疾病。免疫机制是大多数原发性肾小球疾病的主要环节。免疫抑制剂在肾小球疾病的治疗中起着重要作用。他克莫司是一种新型大环内酯类免疫抑制剂,通过抑制白细胞介素-2的产生和T淋巴细胞的活化发挥免疫抑制作用。他克莫司还可以通过稳定足细胞肌动蛋白骨架发挥非免疫作用,从而改善蛋白尿[1]。与环孢素A相比,他克莫司具有较强的免疫抑制作用和较少的不良反应。它是一种免疫抑制剂,广泛用于儿童肾病。然而,由于他克莫司治疗窗口狭窄,用药后个体间的药代动力学和药效学存在很大差异。临床上,有必要通过治疗药物监测来调整药物剂量,以减少不良反应的发生[2]。目前,笔者发现关于他克莫司治疗儿童肾小球疾病的药物监测研究较少。有鉴于此,回顾性分析我院2019年4月至2021年4月服用他克莫司儿童的他克莫司血药浓度监测结果,评价儿童的临床疗效和不良反应,为临床合理用药提供依据。
1 资料与方法
1.1 一般资料 收集2019年4月至2021年4月入住我院肾内科,诊断为肾小球疾病的患儿。入院期间患儿遵医嘱服用他克莫司治疗且定期监测他克莫司血药浓度为研究对象。记录患儿病史资料、肾脏病理、用药情况及实验室检查结果等,并对血药浓度分布情况进行统计。
1.2 排除标准 (1)联合其他免疫抑制剂治疗的患儿病例;(2)不能按时随访的病例;(3)未按照医嘱服药的病例。
1.3 药物治疗方案 采用他克莫司(0.05~0.1 mg·kg-1·d-1)联合中等剂量泼尼松片(0.5~1.0 mg·kg-1·d-1)或等效剂量甲泼尼龙片口服。他克莫司每日每隔12 h口服给药,餐前1 h 或餐后2 h服用。服药1周后清晨空腹采血进行血药谷浓度监测(目标范围为 5~10 ng/ml),用药过程中根据患儿的血药浓度结果、临床疗效及是否发生不良反应等情况进行剂量调整。连续治疗6个月。
1.4 血药浓度测定 患儿服用他克莫司至少1周,清晨空腹抽取血药浓度达稳态静脉血2 ml置 置于EDTA抗凝管中。采用的分析仪器为西门子 Viva-E血药浓度检测仪,严格按照试剂盒说明书采用酶放大免疫检测方法,测定他克莫司全血药物谷浓度。
1.5 临床疗效评价 考察规律用药时间6个月、定期随访、临床资料完整的患儿,疗效评价分析和记录不良反应。对患儿用药前及用药后的各项实验室指标,如血常规、尿常规、生化水平等进行详细记录。对纳入患儿在服药后 1个月、3个月、6个月疗效评价,具体评价标准[3]:(1)完全缓解(CR):血生化及尿检查完全正常;(2)部分缓解(PR):晨尿蛋白阳性(++)和(或)水肿消失、血清白蛋白大于 25 g/L;(3)未缓解(NR):晨尿蛋白≥(+++)。

2 结果
2.1 患儿一般资料 2019年4月至2021年4月服用他克莫司治疗肾小球疾病并进行血药浓度监测的病例,共89例,其中男66例,女23例;平均年龄(7.64±4.19)岁。查阅患儿的一般情况、肾脏病理结果统计如下。见表1。

表1 服用他克莫司治疗肾小球疾病患儿基本资料
2.2 临床疗效评价 规律用药时间6个月、定期随访、临床资料完整的患儿共计44例,服用TAC 1个月时完全缓解率为72.72%,部分缓解率4.55%,未缓解率为22.73% ;服用3个月完全缓解率为72.72%,部分缓解率为13.64%,未缓解率为13.64%;服用6个月完全缓解率为84.09%,部分缓解率为2.27%,未缓解率为13.64%。见表2。
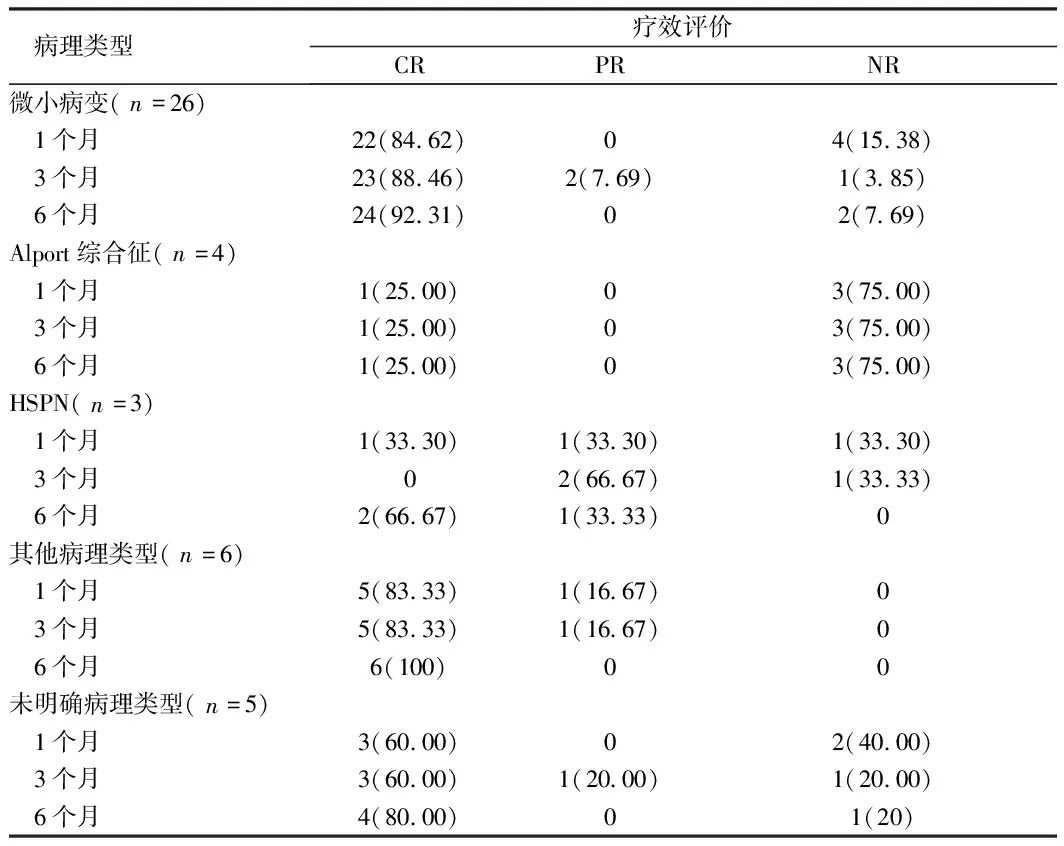
表2 不同病理类型患儿服用他克莫司1个月、3个月及6个月的临床疗效 例(%)
2.3 不良反应 89例患儿在治疗期间,共计发生15例不良反应。出现感染10例,其中肺部感染6例,皮肤软组织感染2例,胃肠道感染1例,泌尿系感染1例;肌酐升高2例;血糖升高1例;肝功能异常1例。
2.4 他克莫司血药浓度监测 89例患者共计监测201例次,他克莫司血药浓度分布情况如下:谷浓度<5 ng/ml的占48.76%,谷浓度5~10 ng/ml的占48.26%,谷浓度>10 ng/ml的占2.98%,纳入评价的44例他克莫司血药谷浓度比较,CR组平均血药谷浓度为(5.55±1.63)ng/ml,PR组平均血药谷浓度为(5.96±2.79)ng/ml,NR组平均血药谷浓度为(4.57±1.83)ng/ml。CR组平均血药谷浓度与PR组平均血药谷浓度比较,无明显差异(P>0.05)。CR组平均血药谷浓度与NR组平均血药谷浓度比较具有显著性差异(P<0.05)。
2.5 临床指标变化 随访患儿在治疗1个月、3个月和6个月后各项检验指标比较结果显示血清白蛋白在用药1个月后比用药前显著升高(P<0.05),24 h尿蛋白、血胆固醇在用药1个月后比用药前显著降低(P<0.05),三酰甘油而在治疗3个月后比用药前显著降低(P<0.05)。血肌酐在治疗期间无显著性变化(P>0.05)。见表3。
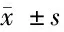
表3 他克莫司用药前后临床指标变化
3 讨论
本研究回顾性对我院2019年4月至2021年4月,89例应用他克莫司治疗肾小球疾病的患儿进行研究调查。研究发现,他克莫司治疗的肾小球疾病中最常见的病理类型为微小病变。儿童肾病综合征(NS)的肾脏病理改变多为微小病变[4],对激素治疗敏感,80%~90% 的NS患儿初始激素治疗可获完全缓解,但有76%~93%的患儿复发,其中45%~50%为频复发NS(FRNS)或激素耐药NS(SDNS)[5]。FRNS和SDNS多选择加用免疫抑制剂,例如他克莫司等进行治疗。Wang等[6]研究,他克莫司在38例 FRNS/SDNS儿童中维持缓解及减少复发的疗效,他克莫司0.05~0.15 mg·kg-1·d-1,随访12个月。治疗6个月时,他克莫司组缓解率(完全缓解和部分缓解)为97.3%。本研究与之相仿,研究表明他克莫司用于治疗难治性病理类型微小病变型NS,治疗6个月后缓解率(CR+PR)为92.31%。他克莫司对不同病理类型的肾小球疾病作用机制不尽相同。Alport综合征为Col4A3或4或5基因突变所导致的遗传性肾脏疾病[7]。本研究随访4例患儿中,应用他克莫司后只有一例患儿疾病得到缓解。而姚小丹等[8]研究报道,5例Alport患者用他克莫司治疗后发现,他克莫司可降低蛋白尿,改善血清白蛋白水平。研究不一致原因可能为患者发病年龄和生理病理状态不同。笔者发现目前单独分析紫癜肾炎或MsGPN 时他克莫司治疗窗的文献很少。
文献报道他克莫司主要的不良反应为感染、糖耐量异常、神经系统症状[9],本次研究结果与之相仿。随访过程中发现无严重不良反应发生,其中一般不良反应15例,10例患儿出现感染,感染发生率高达11.24%。1例肾功能异常的患儿为基础血肌酐值较高,初始应用 他克莫司时剂量未减量,用药1个月后监测他克莫司血药谷浓度为9.2 ng/ml。减少剂量后,患儿血肌酐情况好转。另外本研究未发现服用他克莫司前后患儿血肌酐有显著性改变。但是仍建议服用他克莫司每3个月监测肾功能,如果血肌酐较基础值增高30%以上或伴有肾小管功能异常时,应将减少他克莫司剂量或停药。
根据2016年中华医学会儿科学分会肾脏病学组制定的儿童 NS 诊治指南,推荐他克莫司有效血药谷浓度范围为 5~10 ng/ml[10]。本研究他克莫司血药浓度监测结果显示总体达标率较低,达标率为 48.26%。周艳等[11]对儿童肾病综合征患儿他克莫司血药浓度回顾性分析时报道,86例患儿,147例次血药浓度监测结果,仅有40.14%在目标血药浓度范围内。此外,研究发现不同疗效组平均他克莫司血药谷浓度显著差异,说明血药浓度是影响疗效的重要因素。他克莫司治疗窗窄,药动学个体差异大,一直是临床用药需要解决的难题,因此规律的监测他克莫司血药浓度为保证安全、有效、适宜治疗所必须。
Li等[12]研究结果表明他克莫司能够迅速减少成人肾病综合征患者的蛋白尿。本研究与之相仿,患儿服用他克莫司治疗1个月后,24 h尿蛋白比用药前显著降低。他克莫司能够降低蛋白尿可能的原因为TAC可直接抑制足细胞的磷酸酶、蛋白及其他足细胞裂孔隔膜(slit diaphragm,SD)成分的再分布,从而减少蛋白尿的形成[13]。此外本研究发现用药前血清白蛋白与用药1个月后比较显著升高(P<0.05),说明他克莫司对血清蛋白水平影响显著。王映俊等[14]研究报道,ALB水平与他克莫司浓度/剂量呈负相关。ALB水平是衡量难治性肾病综合征疾病进展情况的重要生化指标。ALB升高表明肾病综合征好转。朱旭等[15]对40例膜性肾病患者服用他克司疗效评价研究,结果应用他克莫司后血脂无显著性差异。本研究发现患儿应用他克莫司后血胆固醇在用药1个月后比用药前显著降低,三酰甘油而在治疗3个月后比用药前显著降低。本研究与报道不一致原因可能为患者年龄以及病理生理情况不同。
综上所述,他克莫司用于治疗肾小球疾病,疗效肯定,安全性高,是儿童难治性肾小球疾病的一个可靠的选择。治疗过程中需要规律监测他克莫司血药浓度以达到个体化用药。
