脓毒症并发ARDS患者血清sTM、suPAR、Ang-2水平与炎症因子及预后的关系
2022-04-26孙会志孙海英李亚平
孙会志,孙海英,李亚平
辽宁省丹东市第一医院重症医学科,辽宁丹东 118000
脓毒症是临床上常见的一种危急重症,其发病率为0.3%,随着侵入性治疗的与日俱增,以及人口老龄化问题的日益凸显,其发病率呈逐年攀升趋势[1]。脓毒症如不予以及时、有效的治疗,可能导致多器官受累,其中急性呼吸窘迫综合征(ARDS)是其较为常见的一种并发症,可加剧患者病情,增加病死率[2]。因此,有效评估脓毒症并发ARDS患者的病情及预后具有重要的意义。可溶性血栓调节蛋白(sTM)是近年来发现的一种新型内皮蛋白,具有抗炎以及细胞保护等作用,可有效反映内皮损伤[3]。可溶性尿激酶型纤溶酶原激活物受体(suPAR)是一种纤溶酶原激活物系统,是临床广泛认可的炎症标志物之一,在机体感染及慢性疾病的发病过程中起着至关重要的作用[4]。血管生成素-2(Ang-2)主要是源自内皮细胞的一种血管形成因子,可能介导了ARDS的肺血管神经性水肿过程[5]。鉴于此,本文通过研究脓毒症并发ARDS患者血清sTM、suPAR、Ang-2水平与炎症因子及预后的关系,旨在为临床治疗提供数据支持,现报道如下。
1 资料与方法
1.1一般资料 将本院2018年2月至2020年2月收治的315例脓毒症患者作为研究对象,通过医院的病历系统完成所有患者临床资料的统计,包括年龄、性别、BMI、合并基础疾病情况、急性生理学和慢性健康状况评价Ⅱ(APACHEⅡ)评分、序贯器官衰竭评估(SOFA)评分、感染类型、ARDS分级、机械通气时间。根据入院72 h内是否并发ARDS分为ARDS组103例、非ARDS组212例。ARDS组中男61例,女42例;年龄32~79岁,平均(52.89±4.30)岁;体质量指数(BMI)18~32 kg/m2,平均(23.62±1.40)kg/m2;有吸烟史30例,有饮酒史20例;合并基础疾病:高血压58例,糖尿病51例,冠心病30例;感染类型:泌尿系感染53例,导管相关血流感染69例,腹腔感染36例,其他13例;ARDS分级:轻度19例,中度36例,重度48例。非ARDS组中男121例,女91例;年龄31~79岁,平均(53.16±4.25)岁;BMI 18~32 kg/m2,平均(23.55±1.32)kg/m2;有吸烟史61例,有饮酒史43例;合并基础疾病:高血压101例,糖尿病94例,冠心病62例;感染类型:泌尿系感染98例,导管相关血流感染123例,腹腔感染73例,其他24例。2组性别构成、年龄、BMI等上述一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:(1)脓毒症诊断均符合《中国脓毒症/脓毒性休克急诊治疗指南(2018)》[6]中所制定的相关诊断标准;(2)ARDS诊断符合欧洲危重病医学会制定的ARDS相关诊断标准相符[7];(3)重症监护病房(ICU)住院时间>72 h。排除标准:(1)因其他疾病导致的ARDS;(2)伴有肺癌以及肺结核等肺部疾病者;(3)伴有严重血液系统疾病或(和)免疫系统疾病者。本研究经医院医学伦理委员会批准,所有患者或(和)家属均签署知情同意书。
1.2诊断标准 (1)脓毒症诊断标准[6]:在明确或疑似感染的基础上满足下述指标,①发热或低体温,心率及呼吸加快,意识改变;②白细胞计数>12×109/L或<4×109/L,血浆C反应蛋白(CRP)及降钙素原水平均>正常值2个标准差;③低血压,混合静脉血氧饱和度>70%;④氧合指数<300 mm Hg,急性少尿,凝血功能异常,肌酐增加≥44.2 μmol/L,血小板计数<100×109/L,总胆红素>70 mmol/L。(2)ARDS诊断标准[7]:①发病≤7 d,有已知呼吸系统受损相关表现或新/加重的呼吸系统症状。②双肺透光度减弱,且无法完全通过肺内液体漏出、大叶肺不张、结节病变解释。③呼吸衰竭,且无法完全通过心力衰竭或液体输入过多解释。④轻度,即呼气末正压(PEEP)或持续气道正压(CPAP)≥5 cm H2O时,200 mm Hg<氧合指数≤300 mm Hg;中度,即PEEP≥5 cm H2O时,100 mm Hg<氧合指数≤200 mm Hg;重度,即PEEP≥5 cm H2O时,氧合指数≤100 mm Hg。
1.3方法 所有患者入院后即刻采集静脉血5 mL,以10 cm为离心半径,3 500 r/min离心10 min,取血清置于-80 ℃冰箱中保存待检。其中血清sTM、suPAR、Ang-2及CRP、白细胞介素-6(IL-6)水平的检测方法均为酶联免疫吸附试验,使用仪器为DG5031型酶联免疫检测仪(购自南京华东电子集团医疗装备有限责任公司),相关试剂盒购自北京科美东雅生物技术有限公司,具体操作以试剂盒说明书为准。ARDS组患者根据28 d内死亡情况分为死亡组44例及存活组59例。

2 结 果
2.12组血清sTM、suPAR、Ang-2水平及炎症因子水平对比 ARDS组患者血清sTM、suPAR、Ang-2、CRP、IL-6水平高于非ARDS组,差异均有统计学意义(P<0.05),见表1。
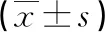
表1 2组血清sTM、suPAR、Ang-2水平及炎症因子水平对比
2.2ARDS组患者血清sTM、suPAR、Ang-2水平与炎症因子的相关性 Pearson相关分析显示,ARDS组患者血清sTM、suPAR、Ang-2水平与CRP、IL-6均呈正相关(r>0.500,P<0.05),见表2。

表2 ARDS组患者血清sTM、suPAR、Ang-2水平与炎症因子的相关性
2.3ARDS组患者预后影响因素的单因素分析 单因素分析显示,ARDS组患者中死亡组和存活组2亚组的APACHEⅡ评分、SOFA评分、ARDS分级、机械通气时间及血清sTM、suPAR、Ang-2、CRP、IL-6水平差异均有统计学意义(P<0.05),而年龄、性别构成、BMI及吸烟史、饮酒史、高血压史、糖尿病史、冠心病史、感染类型人数分布差异均无统计学意义(P>0.05),见表3。

表3 ARDS组患者预后影响因素的单因素分析或n/n或n(%)]

续表3 ARDS组患者预后影响因素的单因素分析或n/n或n(%)]
2.4ARDS组患者预后影响因素的多因素Logistic回归模型分析 以脓毒症并发ARDS患者28 d存活情况为因变量(存活=0,死亡=1),以APACHEⅡ评分、SOFA评分、ARDS分级、机械通气时间及血清sTM、suPAR、Ang-2、CRP、IL-6水平为自变量建立多因素Logistic回归模型。其中APACHEⅡ评分赋值为<25分=0,≥25分=1;SOFA评分赋值为<16分=0,≥16分=1;机械通气时间赋值为<5 d=0,≥5 d=1;ARDS分级赋值为轻度、中度=1,重度=2;血清sTM、suPAR、Ang-2、CRP、IL-6水平均为原值输入。经多因素Logistic回归模型分析显示,APACHEⅡ评分≥25分、SOFA评分≥16分、重度ARDS、机械通气时间≥5 d及血清sTM、suPAR、Ang-2、CRP、IL-6水平升高均是ARDS组患者死亡的危险因素(OR>1,P<0.05),见表4。

表4 ARDS组患者预后影响因素的多因素Logistic回归分析
3 讨 论
尽管近年来关于ARDS相关分子机制的研究日益深入,临床上针对该病患者的通气策略持续改进,但脓毒症并发ARDS患者的病死率仍居高不下[8]。既往,临床上主要是通过APACHEⅡ评分、SOFA评分对脓毒症并发ARDS患者的病情、预后进行评估,但均存在客观性较差的缺陷,在一定程度上受医生经验的影响,从而导致评估难度较大[9]。相关研究表明,脓毒症引起的炎症瀑布反应以及氧化应激反应均会导致呼吸系统受损,继而引发ARDS[10]。由此可见,和炎性反应以及内皮功能有关的指标可能具有评估脓毒症并发ARDS患者病情、预后的作用。sTM属于内皮损伤的重要标志物之一,其异常活化会导致中性粒细胞活化所参与的肺血管损伤,进一步对个体生命健康安全产生严重威胁[11]。suPAR是尿激酶型纤维酶原激活物受体的可溶形式,可通过和配体特异性结合参与纤溶酶原的活化、信号转导等过程,继而参与了炎性反应[12]。Ang-2位于人染色体8p21上,主要是由内皮细胞分泌、合成,在内皮细胞受损时,其表达明显异常,可能用于反映内皮功能[13]。
本研究发现ARDS组血清sTM、suPAR、Ang-2、CRP、IL-6水平均高于非ARDS组(P<0.05)。这提示了脓毒症并发ARDS患者血清sTM、suPAR、Ang-2水平均异常升高。究其原因:sTM是跨膜糖蛋白之一,可发挥抑制内皮细胞增殖、分化、抗炎以及维持内皮环境稳定等作用,参与了肺部炎性反应、细胞凋亡以及肺损伤等过程,ARDS的发生会对肺内皮细胞以及肺泡上皮完整性产生损伤,继而导致sTM水平的异常升高[14];suPAR可通过和其相关配体结合参与纤溶酶原活化、信号转导以及黏附转移细胞等过程,在炎性反应刺激下,suPAR过表达会引起大量炎症细胞的释放,并刺激T淋巴细胞以及中性粒细胞等的肺部浸润,加剧肺部炎性反应损伤,增加ARDS发生风险[15];Ang-2主要是由内皮细胞合成而来,直接作用于内皮细胞特异性受体Tie-2,致内皮细胞特异性受体Tie-2和Ang-1的结合受阻,进一步引起血管通透性的增加,导致血管渗漏的发生[16],增加了ARDS发生概率。CRP、IL-6则是临床上应用较为广泛的炎症细胞因子,其表达水平的升高反映了机体炎性反应的加剧,对ARDS的发生、发展具有积极促进作用[17]。此外,血清sTM、suPAR、Ang-2与CRP、IL-6水平均呈正相关(r>0.500,P<0.05)。分析原因,可能是随着炎性反应的加剧,患者病情加重,ARDS风险增加,血清sTM、suPAR、Ang-2水平随之升高,进一步促进了机体炎性反应的加重以及内皮损伤的加剧,继而引起CRP、IL-6水平升高。另外,多因素Logistic回归模型分析显示,APACHEⅡ评分≥25分、SOFA评分≥16分、重度ARDS、机械通气时间≥5 d及血清sTM、suPAR、Ang-2、CRP、IL-6水平升高均是脓毒症并发ARDS患者死亡的危险因素。究其原因,APACHEⅡ评分、SOFA评分的增加以及ARDS分级的严重,意味着患者病情加重,临床治疗难度明显增加,预后明显不良。机械通气属于有创治疗方式,可能会对患者造成一定的创伤,同时增加了感染的风险,不利于患者预后。此外,sTM的过度释放会激活中性粒细胞,对内皮完整性产生破坏,继而引起肺泡表面活性剂活性的下降,最终加剧患者炎性反应[18],不利于预后。血管外纤维蛋白沉积以及纤溶异常均是ARDS的重要表现,而suPAR可通过诱导肺纤维化介导ARDS的病情恶化,继而对患者预后产生负面影响。Ang-2的升高可能导致毛细血管渗漏增强,继而加重患者的肺部损伤[19],增加死亡的风险。CRP、IL-6水平升高会加剧病情的恶化,致使预后较差。林天来等[20]的研究发现,APACHEⅡ评分是ARDS患者预后的影响因素,这与本研究结果一致,然而,该研究提示SOFA评分及机械通气时间均与患者预后无关,和本研究结果存在明显差异,可能与研究对象年龄段不同及疾病类型差异有关。
综上所述,sTM、suPAR、Ang-2在脓毒症并发ARDS患者血清中均异常高表达,3项指标水平与CRP、IL-6均呈正相关。此外,脓毒症并发ARDS患者APACHEⅡ评分、SOFA评分、ARDS分级、机械通气时间及血清sTM、suPAR、Ang-2、CRP、IL-6水平与其预后密切相关。
