免疫学指标、炎性因子联合临床特征对卵巢癌患者预后的预测价值
2022-04-26崔娇姣周鹏翔高翠红
崔娇姣,周鹏翔,高翠红
卵巢具有排卵、内分泌及维持女性体内激素水平稳定的功能,其结构复杂,是女性易患肿瘤的高危部位[1-2]。有文献报道,卵巢癌的病死率占妇科恶性肿瘤之首[3]。由于卵巢解剖部位较隐蔽,加上早期并无明显临床症状,致早期诊断困难,发病时大部分患者已处于晚期,患者生存率较低[4]。虽然进行较理想的减瘤手术联合系统性的化疗可使大部分患者达到临床缓解,但部分患者仍会复发,预后较差[5]。机体的免疫状态变化情况与肿瘤的发生密切相关,近年来研究显示,肿瘤患者往往都有严重的免疫抑制甚至免疫缺失[6]。各种炎性因子、炎症反应物和抗炎因子常被用来预测肿瘤的严重程度。因此免疫学指标、炎性因子对卵巢癌的预后有重要意义[7]。本研究回顾性分析我院134例卵巢癌患者的预后,探究免疫学指标、炎性因子联合临床特征预测卵巢癌患者预后的价值。现报告如下。
1 资料与方法
1.1临床资料 回顾性分析我院2018年3月—2019年3月收治的卵巢癌134例的临床资料。纳入标准:符合《卵巢恶性肿瘤诊断与治疗指南(第四版)》[8]中卵巢癌诊断标准,且经病理活检证实;非复发性卵巢癌患者;年龄≥18岁;病例资料完整者。排除标准:合并其他恶性肿瘤者;不耐受化疗者;伴认知功能障碍或精神病史;患者依从性较差,未按规定完成治疗方案者。根据随访2年内是否发生死亡将患者分为预后不良组32例和预后良好组102例。本研究经我院伦理委员会批准(批号2020-2号)。
1.2方法
1.2.1资料收集:收集2组入院时年龄、体质量指数、吸烟(连续或累计吸烟6个月或以上)、饮酒(每周饮酒至少1次,每次乙醇量>40 g,连续饮酒半年以上)、高血压病(符合《中国高血压防治指南(2010年修订版)》[9]诊断标准)、糖尿病(符合《中国2型糖尿病防治指南(2017年版)》[10]诊断标准)、血脂异常(符合《中国成人血脂异常防治指南》[11]诊断标准)、肺栓塞、恶性腹水、妊娠次数、流产次数、病理分期、组织学分级、CD4+、CD8+、CD4+/CD8+、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、C反应蛋白(CRP)。
1.2.2病理分期标准:将卵巢癌患者分为Ⅰ~Ⅳ期,其中Ⅰ期:肿瘤细胞只局限在卵巢,无其他任何部位转移;Ⅱ期:肿瘤细胞累及卵巢一侧或两侧,同时已伴有盆腔内部扩散;Ⅲ期:肿瘤细胞侵犯整个卵巢,并伴随局部淋巴结转移或盆腔外腹膜种植;Ⅳ期:肿瘤细胞侵犯整个卵巢,并伴随远处转移。
1.3检测指标 取患者静脉血5 ml,测定T淋巴细胞亚群CD4+、CD8+,并计算CD4+/CD8+,检测IL-6、TNF-α、CRP水平。

2 结果
2.1卵巢癌患者预后不良的单因素分析 预后不良组年龄≥60岁、病理分期Ⅲ~Ⅳ期、组织学分级低分化患者及CD8+、IL-6、TNF-α、CRP水平高于预后良好组,CD4+、CD4+/CD8+水平低于预后良好组(P<0.01)。
2.2卵巢癌患者预后不良的多因素Logistic回归分析 取有差异因素中位值作为截断值,并将上述存在差异的因素纳入Logistic回归分析模型,行量化赋值,年龄:<60岁=0,≥60岁=1;病理分期:Ⅰ~Ⅱ期=0,Ⅲ~Ⅳ期=1;组织学分级:中、高分化=0,低分化=1;CD4+:≥35%=0,<35%=1;CD8+:<32%=0,≥32%=1;CD4+/CD8+:≥1.1=0,<1.1=1;IL-6:<24 mg/L=0,≥24 mg/L=1;TNF-α:<28 mg/L=0,≥28 mg/L=1;CRP:<21 mg/L=0,≥21 mg/L=1;预后不良:否=0,是=1。结果显示,年龄≥60岁、病理分期Ⅲ~Ⅳ期、低分化、CD4+<35%、CD8+≥32%、CD4+/CD8+<1.1、IL-6≥24 mg/L、TNF-α≥28 mg/L、CRP≥21 mg/L是卵巢癌患者预后不良的独立影响因素(P<0.01)。见表1。
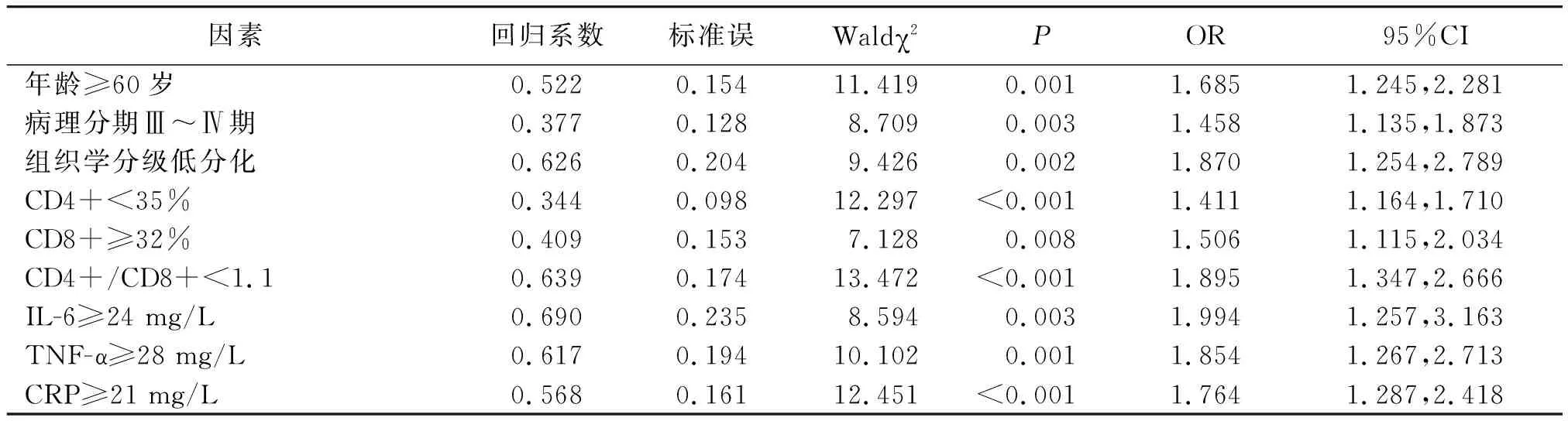
表1 卵巢癌患者预后不良的多因素Logistic回归分析
3 讨论
卵巢癌治疗效果差,目前的主要治疗方式是手术和化疗,但晚期患者,术后5年生存率低且术后仍有大部分患者复发,且化疗药物的毒副反应、化疗所产生的耐药反应都会导致卵巢癌预后效果较差[12]。卵巢癌的预后受多种因素影响,其中术后肿瘤残余灶大小和化疗敏感性是当前国内外公认的最有效的临床预后指标,但术后残余灶大小受术者的熟练程度及手术难度影响,而化疗敏感性往往需要术后数月才能做出评价,难以有效预测卵巢癌患者预后[13]。因此,寻找能够准确有效预测卵巢癌患者预后的生化标志物已成为临床研究的重点。
本研究结果显示,预后不良组年龄≥60岁、病理分期Ⅲ~Ⅳ期、组织学分级低分化患者占比高于预后良好组,提示上述因素可能是卵巢癌患者预后不良的危险因素。分析原因:年龄较大患者的机体状况较差,免疫能力较低,对疾病的抵抗性较差,同时老年患者对化疗的耐受性较差,导致老年患者预后较差。临床分期Ⅲ~Ⅳ期的患者,肿瘤细胞侵犯整个卵巢,并向盆腔外腹膜甚至远处转移,此时患者体内的肿瘤细胞难以控制,破坏相邻的正常器官和组织,影响患者预后[14]。低分化的肿瘤细胞分裂活性高,患者预后更差。与穆翔等[15]报道相符。
本研究结果显示,预后不良组CD8+水平高于预后良好组,CD4+、CD4+/CD8+水平低于预后良好组,分析原因:CD4+/CD8+可在一定程度反映机体的免疫功能,当肿瘤细胞累及淋巴系统时,肿瘤细胞与淋巴系统广泛密切接触,导致CD4+水平不断降低、CD8+水平不断升高,CD4+/CD8+的动态平衡被打破,患者病灶局部浸润淋巴细胞数目变少,且周围血液中淋巴细胞的数目也变小,使机体的免疫功能紊乱及免疫失调,削弱了机体对抗肿瘤细胞的能力,导致患者预后变差。赵艳勋等[16]研究发现,卵巢癌患者临床分期越高,CD4+/CD8+值越低,机体的免疫功能损伤越严重,本研究结果与文献报道相符。本研究中预后不良组患者IL-6、TNF-α、CRP水平高于预后良好组。其原因为由于机体肿瘤细胞的快速转移,IL-6通过增殖来调节B细胞的增殖与分化,从而促进T细胞的增殖,调节免疫应答与急性期反应[17]。当肿瘤细胞扩散时,TNF-α促进炎性细胞的扩散,引起组织损伤并激活其参与修复。肿瘤感染的急性期会引起CRP升高,持续的炎症且无好转或严重程度加重会导致CRP的持续升高。崔彭华等[18]报道,随着卵巢癌患者的病情恶化,其炎症反应也更加强烈,本研究与其报道一致。
经多因素Logistic回归分析证实,年龄≥60岁、病理分期Ⅲ~Ⅳ期、组织学分级低分化以及CD4+、CD8+、CD4+/CD8+、IL-6、TNF-α、CRP水平是卵巢癌患者预后不良的危险因素。
综上所述,免疫学指标、炎性因子联合临床特征对卵巢癌患者预后具有良好的预测价值,临床对卵巢癌患者进行治疗时应对上述指标密切关注,并及时进行干预,以改善患者预后。
