可视化高通量检测天冬氨酸转氨甲酰酶活性的方法
2022-04-26高博冯旭东李春
高博,冯旭东,李春,2
(1 北京理工大学化学与化工学院,北京 100081;2 清华大学化学工程系,北京 100084)
天冬氨酸转氨甲酰酶(ATCase,EC 2.1.3.2)催化L-天冬氨酸(L-Asp)和氨甲酰磷酸(CP)合成-氨甲酰基-L-天冬氨酸(-CP-L-Asp),是嘧啶生物合成途径的第一个酶。大肠杆菌来源的ATCase 是其中研究最多的酶,该酶是十二聚体,由两个三聚体催化亚基(c)和三个二聚体调节亚基(r)组成。每个催化亚基存在两个底物的结合域:Asp 结构域和CP 结构域。当L-Asp 和CP 与酶的催化亚基结合时,酶发生变构并使两个结构域之间距离缩短,进而引发L-Asp 的氨基对CP 的羰基碳进攻,发生转氨甲酰化反应。此外,ATCase的活性还受到嘌呤和嘧啶代谢途径产物的影响,三磷酸胞苷(CTP)和三磷酸腺苷(ATP)可以在ATCase 调节亚基的不同位点结合,并分别显著抑制和促进酶活。ATCase 的这一反馈调节机制具有重要的生理功能,它在生物体内控制嘌呤和嘧啶合成途径的代谢平衡,在生命活动中具有重要意义。
体外活性检测可以直观研究ATCase 反馈调节机制的影响。目前,检测ATCase 活性最普遍的方法是Kantrowitz 等提出的分光光度计法,该方法中使用了两个显色试剂,即2,3-丁二酮肟和安替比林,将它们分别溶于酸溶液中并混合。将显色剂加入反应后的溶液,在黑暗条件下室温静置16h,再在45℃水浴中加热并均匀光照30min,最后测定466nm 处的吸光度。尽管该方法与早期的pH 检测法和同位素示踪法相比,已经很大程度地简化了操作要求并提高了检测范围,但仍然需要过夜反应,且需要通过水浴和均匀光照来稳定显色产物的吸光度,因此无法满足高通量检测的需求。曹飞等研究表明,对二甲氨基苯甲醛(PDAB)可以在酸性溶液中与-CP-L-Asp 发生反应,产生黄色物质,并且在438nm处的吸光度与-CP-L-Asp的浓度呈现线性关系。因此,本研究使用PDAB 建立快速、简单和可视化的测定ATCase 活性的比色法,通过观察加入PDAB 显色剂后不同浓度的-氨甲酰基-DL-天冬氨酸(-CP-DL-Asp)的颜色变化,并测定吸光度,确定该检测方法的可行性;通过精密度实验和加标回收实验验证该方法的精确度;通过检测粗酶液和纯酶液反应,验证该方法检测ATCase 活性的准确度;通过酶标仪实验,确定该检测方法可以用于ATCase 的高通量检测。本研究为ATCase 的酶学研究和分子改造提供了更加方便、高效的检测方法。
1 材料和方法
1.1 材料
1.1.1 菌种、质粒和培养基
大肠杆菌DH5,BL21(DE3)以及DH5-pET28a 均为本实验室保存。原核表达质粒pET28a 通过天根生化科技公司的质粒提取试剂盒获得。LB 培养基:酵母膏5g,氯化钠10g,蛋白胨10g,蒸馏水1000mL。
1.1.2 试剂、仪器及软件
-氨甲酰基-DL-天冬氨酸(-CP-DL-Asp,纯度95%)、L-天冬氨酸(纯度98%),上海毕得医药;氨甲酰磷酸二钠盐(纯度80%,在冷的50%乙醇中重结晶纯化)、PDAB (纯度98%),Sigma-Aldrich;2×mix 聚合酶,聚合美公司;2×fastmix 聚 合 酶,Trans 2K、Trans 2K Plus DNA marker,全式金公司;质粒提取试剂盒,天根生化科技公司;胶回收试剂盒,Protein Ladder 26614,Thermofisher 公司;Gibson assembly master mix由实验室自制。
PCR 仪,型号GE-TOUCH,杭州柏恒公司;电泳仪, 型号DYY-7C, 北京六一公司;Nanodrop,型号Nano-500,杭州奥盛公司;台式摇床,型号ZQZY-CS9,知楚仪器公司;高速冷冻离心机,型号J6-XP,贝克曼公司;高压破碎仪,型号JN-3000,广州聚能纳米公司;AKTA 蛋白纯化仪(型号AKTA purifer)和His Trap FF 预装柱,GE Healthcare; 酶 标 仪, 型 号infinite M200,TECAN 公司。引物设计和序列比对使用SnapGene软件。
1.2 实验方法
1.2.1 目的基因的扩增与重组质粒的构建
在NCBI 数据库中检索大肠杆菌K12 MG1655中表达ATCase 的基因B 和I(在基因组中相邻),将这两个基因的序列在SnapGene中组合,并在其上下游设计引物P1、P2。在大肠杆菌DH5(大肠杆菌K12 系菌株)中扩增出BI 基因。同时,设计引物P3、P4,通过PCR 将pET28a 线性化。线性化的基因片段通过琼脂糖凝胶电泳验证,并通过胶回收试剂盒回收。通过Gibson 组装方法,将两个片段构建成含有Kan抗性标记的重组质粒。
用于扩增目的片段的引物序列如下:P1,5'-CTTGCGGCCGCACTCGAATGGCTAATCCGCTATAT CAG-3';P2,5'-GTGGTGGTGGTGGTGGTGATTGGC CAGCACCAC-3';P3,5'-CATAATGTGGTGCTGGCC AATCACCACCACCACCACCACTG-3';P4,5'-GATA TAGCGGATTAGCCATTCGAGTGCGGCCGCAAG-3'。
PCR 体系:Nuclease-Free Water,22μL;2×fastmix,25μL;引物(10μmol/L),1μL;模板(质粒或菌液),1μL。PCR 条件:预变性,95℃,2min;变性,95℃,20s;退火,60℃,20s;延伸,72℃,2kb/min;完全延伸,72℃,8min。共30个循环,最后存放于4℃冰箱。
1.2.2 重组质粒的大肠杆菌转化
将重组质粒pET28a-ATCase 转化至DH5中。在100μL DH5感 受 态 中 加 入10μL Gibson 组装的质粒,冰上孵育30min,42℃热击60s,冰上孵育5min,加入600μL LB 液体培养基,37℃、200r/min 摇床中复苏1h。菌液在5000r/min离心3min,并全部涂布于含有卡那霉素的LB 平板上,放于37℃培养箱中过夜。挑取单克隆,使用T7 引物进行菌落PCR 鉴定,将阳性克隆挑入含有卡那霉素的LB 液体培养基。使用天根生化科技公司的质粒提取试剂盒提取出重组质粒,并送金唯智公司测序。将测序正确的质粒转化到BL21(DE3)感受态中,用于表达目的蛋白。
1.2.3 目标蛋白的诱导表达和纯化
将转入重组质粒的BL21(DE3)菌液接种于400mL 含有卡那霉素的LB 液体培养基中,37℃、200r/min 培 养 至OD=0.6 左 右,加 入0.1mmol/L 的IPTG,16℃诱导20h。使用高速冷冻离心机收集菌体,用20mL 的50mmol/L 的Tris-HCl(pH8.0)缓冲液重悬,高压破碎,取上清液,在AKTA 蛋白纯化仪中用含0.5mol/L 咪唑的缓冲液洗脱,获得纯酶,并通过SDS-PAGE 验证。通过ATCase 的 吸 光 系 数,=0.59cm²/mg 计 算 纯 酶浓度。
1.2.4 ATCase活性的测定
酶活反应体系如下:5mmol/L 的L-Asp,5mmol/L 的CP,ATCase 纯酶液(浓度为6nmol/L),加入缓冲液补足至0.5mL,与25℃水浴中反应30min。反应结束后加入0.5mL 的10% PDAB 显色液(溶于2.4mol/L HCl 溶液中),避光静置15min。使用Nanodrop 检测438nm 的吸光度。定义每分钟催化生成1μmol-CP-L-Asp 为1 个酶活力单位(U),酶的比活力为酶活力除以蛋白质的质量。
粗酶酶活验证:在反应体系中,分别加入10μL、20μL、30μL、50μL ATCase 粗酶液替代纯酶液,其他条件不变。由于BL21(DE3)自身也表达ATCase,因此构建了含有pET28a 质粒的菌株作为对照。
高通量检测:配置0~5mmol/L 的-CP-DLAsp 溶液和纯酶反应体系各0.5mL,加入显色液反应后用酶标仪检测吸光度。
2 结果与讨论
2.1 重组质粒的构建与鉴定
将pET28a线性化片段和扩增得到的BI片段进行Gibson组装,将组装产物转入DH5中,挑单菌落,使用T7 引物进行菌落PCR 验证,结果如图1。

图1 重组质粒的菌落PCR验证
T7 引物是pET28a 上的特异性引物,因此菌落PCR 验证结果表明,目的基因已经被构建到载体上。将阳性菌落挑入液体培养基,通过质粒提取试剂盒提取质粒并送金唯智公司测序和比对,确认目的基因被成功构建到载体上,重组质粒命名为pET28a-ATCase。
2.2 ATCase的诱导表达和纯化
将转入重组质粒的BL21(DE3)菌株接种于液体培养基中,在对数生长阶段加入IPTG,16℃下过夜诱导,收集菌体并用高压破碎仪破碎。在AKTA 蛋白纯化仪中,将含有ATCase 的上清液用His Trap FF预装柱吸附,分别用含有0.5mol/L和1mol/L咪唑的Tris-HCl缓冲液洗脱,结果如图2。
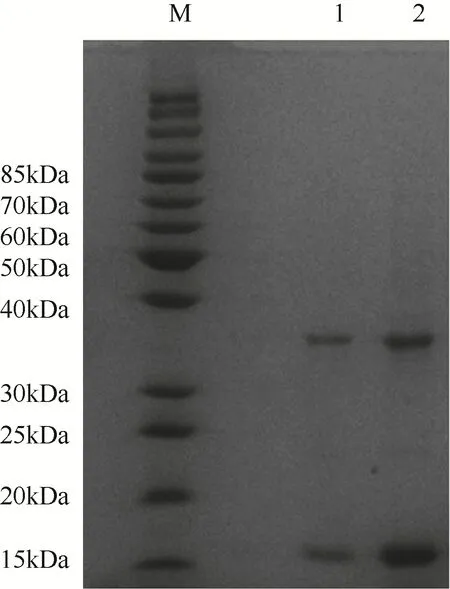
图2 ATCase的SDS-PAGE验证
ATCase 是十二聚体,因此重组蛋白含有12 个His标签,与His Trap FF预装柱的结合能力强,需要使用较高浓度的咪唑洗脱。SDS-PAGE的结果显示,两个梯度的洗脱液中均含有ATCase 的催化亚基(34kDa)和调节亚基(17kDa),表明蛋白的纯化成功。使用100kDa 的超滤浓缩管浓缩洗脱液,除去咪唑并将缓冲液替换为含有20%甘油的缓冲液,通过Nanodrop测定A280计算酶的浓度,-80℃低温保存酶液。
2.3 绘制标准曲线
在Tris-HCl 缓冲液中,加入-CP-DL-Asp,配置浓度为1~5mmol/L 的梯度溶液,按照体积比1∶1 加入10%PDAB 显色液,室温静置15min。通过Nanodrop 测定438nm 的吸光度。将Tris-HCl 缓冲液作为对照,显色反应及标准曲线如图3所示。
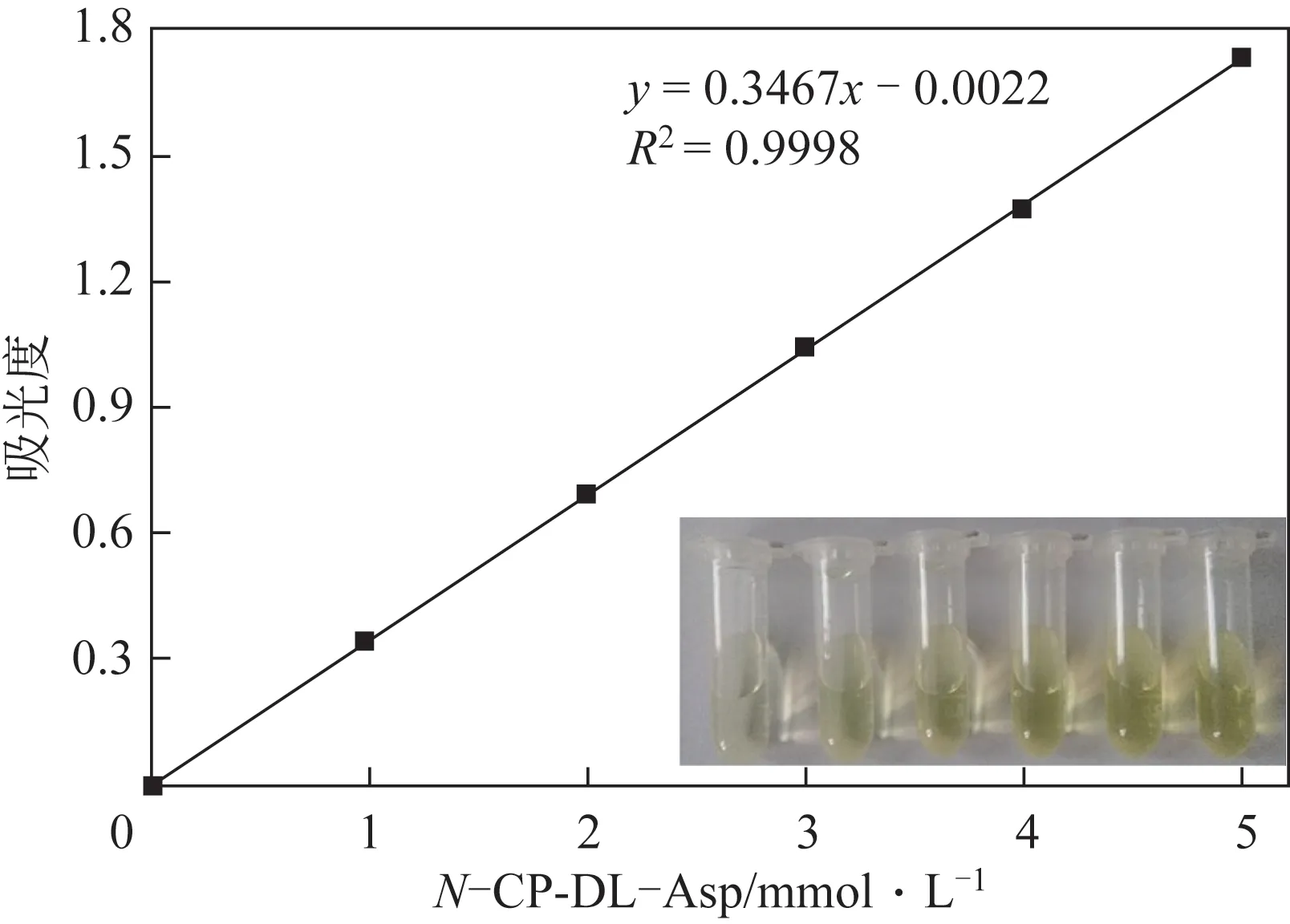
图3 N-氨甲酰基-DL-天冬氨酸的标准曲线
由图3 可以看出,随着-CP-DL-Asp 浓度的升高,显色反应后的溶液呈更深的黄色,表明在该浓度范围内,可以通过观察颜色变化判断-CPDL-Asp 的含量。通过紫外测定,得到的线性方程为=0.3467-0.0022,=0.9998,线性关系良好。为确定PDAB显色法的检测下限,通过梯度稀释配置了浓度为0.5mmol/L、0.1mmol/L、0.05mmol/L、0.01mmol/L 的-CP-DL-Asp 溶液并进行检测。在浓度为0.1mmol/L时,平均吸光度为0.036,与标准曲线的误差较小,而当浓度为0.05mmol/L时,平均吸光度为0.025,与标准曲线的误差较大,推测在此浓度下仪器的测量误差对吸光度影响比较明显。因此,PDAB显色法的检测范围为0.1~5mmol/L。根据文献,ATCase 对CP 的饱和浓度为4.8mmol/L,因此PDAB显色法可以满足ATCase酶活测定的要求。
2.4 精密度实验
为保证显色反应的可重复性,配置浓度为2mmol/L、3mmol/L、4mmol/L 的-CP-DL-Asp 溶液各6组,加入显色剂反应后测定吸光度。每个样品测定3次吸光度,取平均值。将6组样品测定结果取平均值,实验结果如表1。

表1 精密度测定结果
由表1 可得,PDAB 显色反应的精密度RSD 为0.87%~1.52%,表明检测结果精确度高。
2.5 加标回收率的测定
选择-CP-DL-Asp 浓度为1mmol/L 的溶液,加入-CP-DL-Asp 标准品使溶液浓度分别提高至2mmol/L、3mmol/L、4mmol/L。加入显色剂反应,测定吸光度,并根据图3 中的标准曲线计算回收率,实验结果如表2。
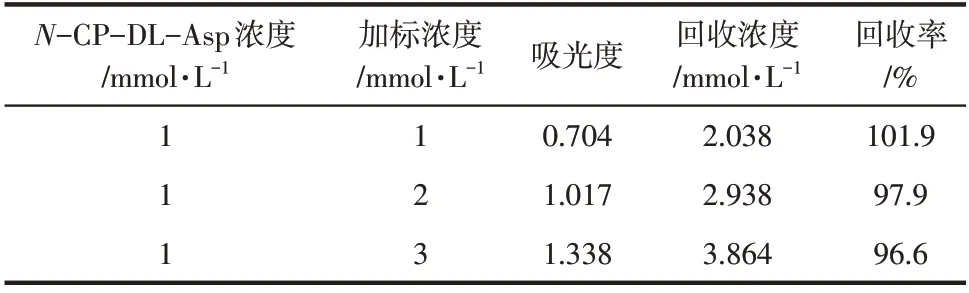
表2 加标回收率的测定
由表2 可得,在检测范围内进行加标回收时,PDAB 显色法具有良好的回收率,结果为96.6%~101.9%,准确度较高。
2.6 使用PDAB显色法测定ATCase的活性
根据1.2.4 节的方法进行ATCase 活性的测定,为证明该显色法测定ATCase 活性的高效性,首先使用粗酶液进行显色反应,实验结果如图4 和表3所示。

图4 粗酶液显色反应
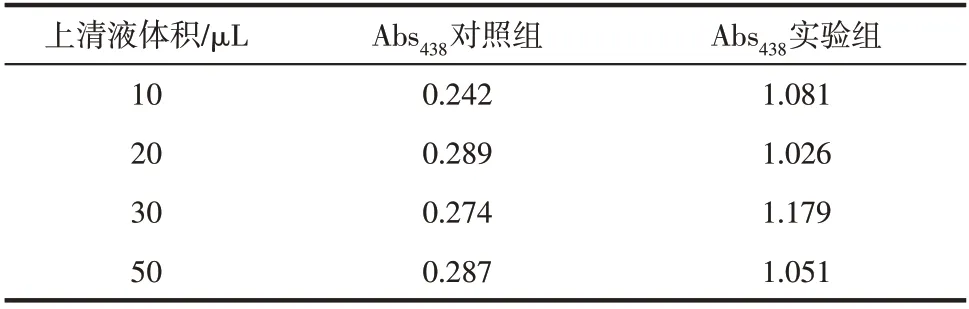
表3 粗酶液显色反应的紫外吸收
图4 表明,PDAB 显色法可用于定性检测ATCase 粗酶液的酶活。对照组显色结果表明,PDAB酸性显色液与大肠杆菌裂解液中的某些物质也会发生显色反应,颜色呈淡粉红色,同时还会与其他某些物质反应,产生沉淀。当加入粗酶液的体积大于20μL 时,能观察到显色液有浑浊。当加入含有ATCase 的粗酶液时,除了-CP-L-Asp 发生反应呈黄色以外,上述两个反应也会同时发生,随着加入粗酶液体积的增加,出现的沉淀明显增多,但是-CP-L-Asp和粉红色的显色反应没有明显增加,表明粗酶液与PDAB显色液发生沉淀的反应更优先。再根据表3 发现,粗酶液体积的增加对438nm的吸光度几乎没有影响,这表明沉淀的出现影响了PDAB 与-CP-L-Asp 的显色。当加入粗酶液体积为小于10μL 时,能更好地观察到显色反应的发生。粗酶液显色反应的结果表明,PDAB显色法可以用于高通量定性检测ATCase 的活性且不需要复杂耗时的蛋白纯化操作。
进一步使用PDAB 显色法测定ATCase 纯酶的比活性。根据1.2.4节的方法进行ATCase 纯酶活性的测定。定义每分钟催化生成1μmol-CP-L-Asp为1个酶活力单位(U),酶的比活力为酶活力除以蛋白质的质量,测定结果如表4。

表4 PDAB显色法测定ATCase纯酶的比酶活
由表4,通过PDAB 显色法测定三个平行反应的比酶活并取平均值,得到ATCase 的比酶活为56.83U/mg,RSD为2.60%,表明该检测方法准确。
2.7 使用酶标仪高通量测定ATCase的活性
为表明PDAB显色法可用于高通量测定ATCase的活性,使用酶标仪检测2.6 节中同一批纯酶液反应的样品,并与Nanodrop 的结果进行比对。配置0~5mmol/L 的-CP-DL-Asp 溶液,并根据1.2.4 节的方法,将每个样品取三组平行测定。酶标仪检测结果如表5、表6。
根据表5的结果,拟合酶标仪测定的标准曲线方程为=0.0989+0.0555,=0.9931,线性关系较好。由表6 得到ATCase 的比酶活为57.61U/mg,RSD为4.91%,结果与分光光度计误差很小,表明该方法可重复性较高。
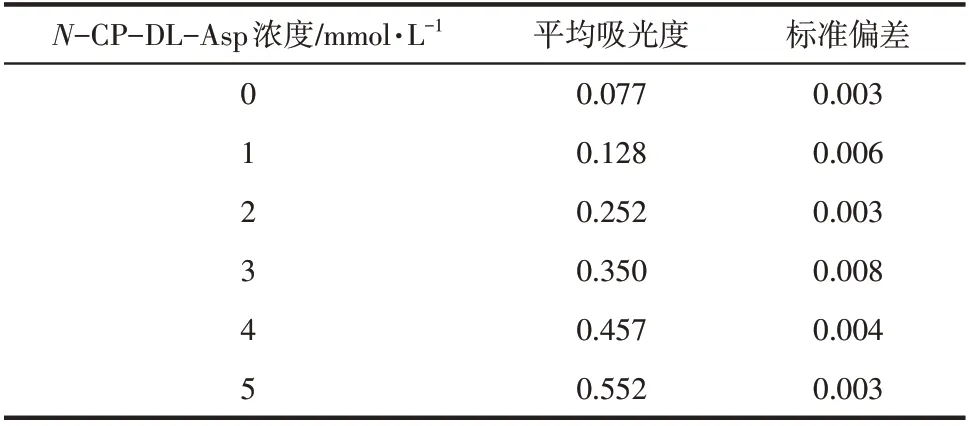
表5 酶标仪测定的N-CP-DL-Asp的吸光度
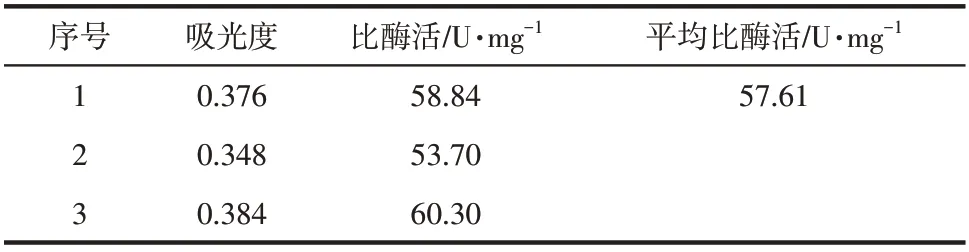
表6 酶标仪测定ATCase纯酶的比酶活
表7列出本文构建的PDAB检测法与Kantrowitz等的传统方法的对比。

表7 两种检测方法的对比
尽管与传统检测方法相比,本文建立的PDAB检测法的灵敏度有所下降,但由于ATCase 可以在30min 内生成浓度高达约3mmol/L 的产物,因此灵敏度对该方法的适用性没有显著影响。此外,PDAB检测法在保持高精确度的同时,大幅缩短反应时间并明显简化操作步骤,从而大幅提高测定效率,适用于高通量检测ATCase的活性。
3 结论
本研究基于PDAB与-氨甲酰基-天冬氨酸反应生成黄色物质的性质,建立了高效检测ATCase活性的比色法。实验结果表明,在0.1~5mmol/L 的浓度范围内,PDAB 对-氨甲酰基-DL-天冬氨酸显色后,在438nm 的吸光度具有良好的线性关系,且精确度高,加标回收准确度高。将该显色法用于测定ATCase 的活性时,可以通过颜色的变化可视化地判断反应进行的程度。对于粗酶液,该显色法可以定性检测酶促反应是否发生,对于纯酶液,该方法可用于定量检测。通过分光光度计比色法测定ATCase 的比酶活,三组平行实验证明该方法的可重复性高。与传统方法相比,该检测法还具有耗时短、操作简单等优点,可以满足高通量筛选ATCase的需求。
