艾司洛尔联合镇静镇痛治疗阵发性交感神经兴奋的效果
2022-04-25孙瑞迅李琳坤
孙瑞迅 李琳坤 刘 飒 刘 祯 董 辉
南阳市第二人民医院,河南 南阳 473300
1929 年,PENFIFIELD 描述了一种继发于三脑室肿瘤的综合征,该综合征有流泪、高血压、出汗和躁动等症状,将其命名为间脑癫痫发作,但之后的电生理学研究并未捕捉到异常脑电图活动[1]。之后该综合征曾有超过31 个不同的名字,包括自主神经功能障碍、阵发性自主肌张力障碍、阵发性交感神经风暴、交感神经风暴、间脑癫痫和自主神经功能障碍综合征等[2],导致很多临床医生对其认识和治疗混乱。尽管其病理生理学尚未完全了解,但大多数研究人员逐渐认同该综合征是由交感神经系统兴奋抑制的丧失且无副交感神经参与所驱动的[3]。结合神经影像技术,进一步研究发现在脑室周围白质、胼胝体、间脑或脑干有较深层脑损伤的患者比仅有皮质和皮质下损伤有更大可能发生该综合征[4]。2010 年该综合征被识别和简化为一个医学名词:阵发性交感神经过度兴奋(paroxysmal sympathetic hyperactivity,PSH)。2014 年,以BAGULEY 为代表的专家组制定了PSH 评估量表,PSH 的诊断才被医学界广泛认可。PSH 指交感神经出现阵发性、一过性的过度活动,主要临床表现为发热、心动过速、呼吸急促、血压升高、大汗、肌张力增高等,导致机体氧耗增加、循环负担加重,严重时可引起室颤,需要电除颤处理。而神经外科重症如脑出血、颅脑损伤患者,由于手术、疼痛、各种导管植入等各种应激因素,多有PSH 发作。早期将其与感染发热、癫痫发作、其他原因继发的血压升高区别并处理,将有助于改善神经重症患者的预后。PSH在神经重症患者的发病率在33%左右,流行病研究其显示与年轻和较低的GCS 评分等因素相关[5-6]。病程常持续数小时至2 周,个别病例甚至可持续数月。随着对PSH认知的进步,在治疗上人们做了许多尝试,但仍未形成统一的治疗共识。β受体阻滞剂、溴隐亭、巴氯芬、右美托咪定、苯二氮类药物均在不同地区被应用于PSH的治疗[7-8],目前其治疗策略仍是早期的识别和症状控制[9]。艾司洛尔是超短效β受体阻滞剂,起效及代谢快,能更安全快速抑制过量儿茶酚胺类神经递质的兴奋毒性作用,而镇静镇痛药物可以减少疼痛应激及恐惧感,降低代谢率,减少PSH的诱因,达到有效控制症状、减轻神经损伤的目的,有利于患者的恢复和治疗。
1 对象和方法
1.1 一般资料 以2019-01—2020-12 因神经外科重症于南阳市第二人民医院手术治疗并在术后并发PSH的患者为研究对象。入组标准:(1)年龄≥18周岁;(2)因脑出血或颅脑损伤等行神经外科手术治疗;(3)以术后GCS 评分≤8 分作为神经外科重症患者入选标准;(4)术后在重症病房治疗过程中并发PSH(PSH诊断临床特征评分≥7分)。排除标准:(1)合并其他系统严重基础疾病;(2)合并心脏外伤。根据标准入组研究对象96 例,随机分为对照组和观察组各48 例,对照组男27 例,女21 例,年龄21~80(56.33±12.59)岁;观察组男27例,女21例,年龄24~83(59.60±11.95)岁。PSH 严重程度:0 分:无;1~6分:轻度PSH;7~12 分:中度PSH;≥13 分:重度PSH。见表1。

表1 PSH诊断临床特征评分量表Table 1 PSH assessment measure scale
1.2 方法 2组患者术后均给予吸氧、控制颅压、抗感染、心电监护等基础治疗。出现PSH症状时记录血压及心率,并检查血清NSE、S100-β水平。2 组患者均给予艾司洛尔0.05 mg/kg 静推,之后经中心静脉0.05~0.2 mg/kg 泵入,根据血压及心率变化调整泵入速度。观察组联用右美托咪定经中心静脉泵入,必要时加用苯二氮类镇静药和阿片类镇痛药。镇静镇痛目标将RASS 镇静评分控制在 2~1 分,用药2 h后记录血压及心率,48 h 后再次检查血清NSE、S100-β水平。
1.3 观察指标 比较2 组患者治疗前后血压、心率变化及血清NSE、S100-β水平变化,观察治疗对患者神经系统和循环系统的影响。
1.4 统计学处理 数据分析采用SPSS 20.0软件,计量资料以均数±标准差(±s)表示,行t 检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2 组治疗前后血压和心率的变化对比 PSH 发作时2组患者心率、收缩压及舒张压均无显著性差异(P>0.05);治疗后2组患者血压及心率均有所降低,但观察组心率、收缩压及舒张压均低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 2组治疗前后血压和心率对比(±s)Table 2 Comparison of blood pressure and heart rate before and after treatment in two groups (±s)

表2 2组治疗前后血压和心率对比(±s)Table 2 Comparison of blood pressure and heart rate before and after treatment in two groups (±s)
组别对照组观察组t 值P值n 48 48心率/(次/min)用药前119.79±16.99 122.79±18.94—0.817 0.303用药后82.70±9.84 74.66±5.95 4.844 0.006收缩压/mmHg用药前158.60±17.71 155.85±17.53 0.764 0.846用药后122.91±8.05 110.66±6.43 8.23 0.017舒张压/mmHg用药前93.14±9.65 94.70±9.62—0.794 0.907用药后74.54±5.46 65.89±3.94 8.88 0.041
2.2 2 组治疗前后神经损伤指标对比 PSH 发作时2组患者血清NSE、S100-β水平均无显著性差异(P>0.05);治疗后2 组患者血清NSE、S100-β水平均有降低,但观察组血清NSE、S100-β水平均低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 2组治疗前后血清NSE和S100-β水平对比(ng/mL,±s)Table 3 Comparison of serum NSE and S100-β levels before and after treatment in the two groups (ng/mL,±s)
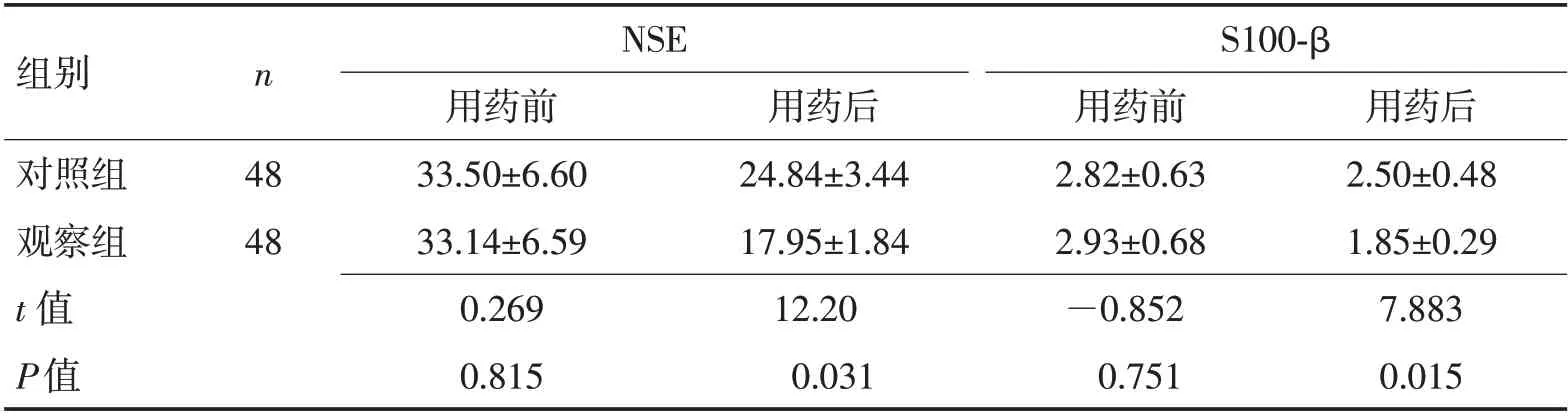
表3 2组治疗前后血清NSE和S100-β水平对比(ng/mL,±s)Table 3 Comparison of serum NSE and S100-β levels before and after treatment in the two groups (ng/mL,±s)
组别对照组观察组t 值P值n NSE 48 48用药前33.50±6.60 33.14±6.59 0.269 0.815用药后24.84±3.44 17.95±1.84 12.20 0.031 S100-β用药前2.82±0.63 2.93±0.68—0.852 0.751用药后2.50±0.48 1.85±0.29 7.883 0.015
3 讨论
PSH是神经外科重症病房急性弥漫性或多灶性颅脑疾病一种相对常见但往往易被忽略的并发症。统计数据显示,大多数PSH 病例为颅脑损伤(79.4%),其次是缺氧性脑损伤(9.7%)和脑卒中(5.4%)[10]。而弥漫性轴索损伤和较深部的脑损伤是PSH 明确的发病高危因素[11]。此外,较高的入院时血压、年龄、较低的GCS 评分也与PSH 的发生率相关。神经外科重症患者术后往往因手术的疼痛刺激、病房噪声和灯光刺激、各种导管留置和侵入性操作、约束或失去对肢体的控制、对疾病的恐惧等应激因素而出现紧张焦虑、心动过速、多汗、血压升高、呼吸急促等PSH症状,这种改变使患者氧耗增加、心肺负担加重、机体分解代谢增加等,若不及时处理,将不利于患者恢复,甚至出现心力衰竭、室颤等严重并发症,将延长ICU治疗时间和住院时间,以及更长的气管切开和机械通气时间、更严重的残疾[12]。
PSH 的发病机制主要有癫痫学说、抑制失衡和神经内分泌失调等。随着人们对PSH的认识提高和电生理学技术、影像学技术的进步,癫痫学说已被电生理学证实不能解释PSH 的发病机制。目前,有两种理论可以解释PSH 的病理生理学:第一种认为下丘脑和脑干的交感兴奋中心与大脑皮质等高级功能中枢的脱钩,导致交感兴奋状态;第二种理论认为,当控制脊髓传入刺激的中脑或脑干受损时,就不可能抑制刺激,从而导致脊髓传入通路的过度兴奋。目前,后一种理论得到更大的支持[2]。交感神经系统的作用是“战斗或逃跑”,而副交感神经系统是“休息和消化”[13]。而交感神经兴奋时,大量儿茶酚胺释放入血,其兴奋作用包括升高血压、体温、心率,以达到应对各种“战斗”应激的目的。在阵发性发作期间PSH患者的血清ACTH较基线增加40%,血清儿茶酚胺水平增加200%~300%,这些数据进一步证实了阵发性交感神经过度活跃的命名[14]。在神经外科重症患者中,PSH 多继发于颅内深处结构,如胼胝体、丘脑、间脑、脑干等处的损伤。
PSH的识别对于颅脑损伤或脑卒中患者的恢复至关重要,未能及时识别和处理与发病率和病死率的增加、更高的医疗费用、更长的住院时间和较差的预后相关[15]。非药物治疗措施主要包括在临床工作中尽量减少刺激和症状触发,主要包括气管内吸痰操作、翻身拍背或洗澡、各种侵入性操作等,这在住院患者的护理和治疗中是无法避免的[16]。报道显示气管切开患者PSH 发作更频繁[17],但气管切开的需要可能是持续缺氧脑损伤的间接反应。高压氧治疗可增加损伤脑组织的氧供,改善大脑有氧代谢,经历过气管切开术的PSH 患者通常已有脑缺氧;虽然气管切开术可有效改善脑缺氧,但既往缺氧引起的不可逆神经损伤仍可能影响PSH 的发展[17-18]。PSH 的药物治疗策略集中于症状的综合管理和控制,如对于发热,不论何种原因导致的发热均对患者有不良影响。除尽快明确病因外,区别感染或是中枢性,还是PSH 导致至关重要,对因治疗同时积极降温和补液,保证水电解质的平衡,PSH的发热症状常被误诊为感染。初始血清降钙素源(procalcitonin,PCT)常可用于区分感染性发热和PSH发热[19]。现有的药物干预主要关注症状的特异性治疗,包括苯二氮 类、阿片类药物、β受体阻滞剂和肌肉松弛剂等。溴隐亭、巴氯芬等也有报道对PSH 有较好的治疗效果[8]。普萘洛尔和右美托咪定均能系统地调节中枢神经系统,并减少PSH的相关症状,但远期治疗效果仍需进一步研究[20]。治疗药物的选择也大多基于当地医院习惯,而并不全是客观证据[21-22]。国外报道较多使用普奈洛尔,也可以较好缓解PSH 的症状。艾司洛尔是选择性短效β1受体阻滞剂,具有起效迅速、代谢快、安全有效等特点。β受体阻滞剂对抗儿茶酚胺类递质神经和血管毒性,还有抗高血压、心肌缺血,改善心脏功能和增加左心室射血分数、抗心律失常等作用。镇痛镇静可减少对血流动力学的影响,保证心率和动脉压的稳定性,降低缺氧和脑缺血对患者脑功能的影响[23]。但在神经外科重症病房常可见到艾司洛尔联用镇静镇痛药物之后,在PSH 的预防和治疗上效果优于单用艾司洛尔。去除病因是治疗PSH 的根本,艾司洛尔联用镇静和镇痛药物可解除疼痛刺激、减少应激,让患者得到良好的休息,从而减少PSH 对神经系统的损伤,改善患者预后[24]。神经元特异性烯醇化酶(neuron-specific enolase,NSE)存在于神经细胞内,当神经元、血-脑屏障破坏时,NSE 会进入血液和脑脊液。监测其血清水平的高低对于判断神经损伤程度和预后有很大意义[24]。血清NSE 作为神经组织损伤严重程度的生物标志物,表现出对人类大脑高度特异性,发现其升高与神经损伤的严重程度相关。对创伤性脑损伤患者的大量研究表明,血清NSE 浓度升高与不良结果相关,在轻度创伤性脑损伤患者中测量的NSE 浓度与对照组无显著差异,表明该生物标志物在轻度病例中的敏感性较低。中枢神经特异性蛋白(S100-β protein,S100β)则是中枢神经系统和血-脑屏障损伤的指标,其血清水平升高提示脑细胞的损伤。在神经元坏死的早期NSE 和S100-β即释放入血,并在体液中稳定,可在血液样本中进行测量,因此具有很好的神经元特异性,其水平高低与神经损伤和血-脑屏障损伤呈正相关[25]。研究证实,当MRI 上出现严重脑病、癫痫发作、异常脑电图背景或脑损伤的患者NSE水平显著升高,与不良预后相关[26]。在神经外科重症患者术后并发PSH 时,及时给予艾司洛尔联用镇静和镇痛药物,可降低PSH 的发作频率、强度和对抗儿茶酚胺类递质神经、血管毒性,降低氧气和能量消耗,缓解和改善脑组织缺血缺氧,为恢复创造有利条件,最终达到降低发病率和病死率的目的[27-28]。本研究中观察组在血压、心率及血清NSE、S100-β指标表现上均优于对照组,提示艾司洛尔联用镇静和镇痛药物在神经外科重症患者术后并发PSH 时,对于循环系统和中枢神经的保护上优于单独使用艾司洛尔,为神经科临床治疗PSH 提供了参考依据。
