宫颈癌脱落细胞RBL1启动子甲基化与患者放疗抵抗的关系
2022-04-25霍叶琳王月房国涛
霍叶琳,王月,房国涛
(1.保定市第一医院 妇产科,河北 保定 071000; 2.河北大学附属医院 肿瘤科,河北 保定 071000)
宫颈癌为常见妇科恶性肿瘤之一[1],虽然人乳头瘤病毒(human papilloma virus,HPV)疫苗接种和早期筛查已经成为预防该疾病的有效策略[2],但在低/中等收入国家其发病率仍然较高。目前,基于DNA甲基化的检测方法可以作为检测宫颈高级上皮内瘤变的重要工具,许多甲基化基因亦被证实为管理HPV阳性女性有希望的标志物。放化疗是宫颈癌的基本治疗手段之一,但肿瘤细胞辐射抵抗仍然是一个主要的治疗障碍[3- 4],因此有必要寻找新的分子靶点以评估治疗结局。视网膜母细胞瘤样基因1(retinoblastoma- like 1,RBL1)是一种肿瘤抑制基因,能够对放射线等的DNA损伤作出反应[5]。Pan等[6]研究表明RBL1/p107启动子甲基化可增强体外三维培养癌细胞的放射抵抗性,但RBL1在宫颈癌中的作用仍缺乏临床证据支持。本研究旨在探究RBL1甲基化状态在宫颈癌放疗早期反应监测中的应用价值,为深入探究宫颈癌放疗抵抗机制和寻找有效的生物标志物提供临床依据。
1 资料与方法
1.1 一般资料
本研究经保定市第一医院伦理委员会批准,所有治疗程序均按照相关指南执行。从2015年5月至2017年4月期间在该院接受治疗的宫颈癌患者中招募了82例患者,接受同步放化疗(concurrent chemo- radiotherapy,CCRT)为一线治疗。纳入标准:(1) 经病理活检诊断为宫颈癌;(2) 无宫颈癌手术及放化疗史。排除没有完成治疗方案者、复发患者、非初治患者或失访者。通知患者及其家属采集样本,并签署知情同意书。在CCRT之前(T0)进行组织基因甲基化检测,另外在T0及放疗期间(T1:放疗中期;T2:放疗结束)进行磁共振成像(magnetic resonance imaging,MRI)检查。通过将基线MRI结果与放疗后3个月的MRI结果进行比较,确定肿瘤早期治疗反应。
1.2 治疗
所有患者均接受体外放射治疗(external beam radiotherapy,EBRT)联合腔内近距离治疗(intracavitary brachytherapy,ICR)。治疗全程总剂量为45~50 Gy。每周1次联合35~40 mg·m-2顺铂治疗。根据患者的情况调整治疗方案。
1.3 MRI监测及肿瘤治疗反应评估
在T0进行基线肿瘤评估,治疗后3个月通过MRI、视觉诊断和体格检查确定最终治疗反应,并与基线进行比较。以完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、疾病稳定(stable disease,SD)或进展(progressive disease,PD)评价临床疗效。将获得CR或PR的患者纳入放疗敏感组,SD或PD的患者纳入抵抗组。根据T2加权像测量肿瘤的长度(length,L)、宽度(width,W)、高度(height,H),计算肿瘤体积为1/6π×W×H×L。肿瘤体积的变化(%)=(治疗前体积-治疗后体积)/治疗前体积×100%。
1.4 定量甲基化PCR(quantitative methylation- specific PCR,qMSP)检测RBL1基因启动子甲基化状态
宫颈脱落细胞在妇科检查时用子宫颈刷获得,离心后存放在-20 ℃磷酸盐缓冲生理盐水中,用标准酚- 氯仿法提取基因组DNA,并进一步纯化。利用EpiTect甲基化转化试剂盒(德国Qiagen公司)将200~500 ng DNA样本进行亚硫酸盐转化,纯化后用于后续测序。在LC480热循环系统(德国Roche Applied Science公司)上进行甲基化特异性PCR,以确定RBL1基因甲基化水平。RBL1甲基化特异性引物(M):正向5′- GGAGGTATTTTATTATGTTGTATGA- 3′,反向5′- TCCTTAACCCTTAACTAATCACAAA- 3′;RBL1非甲基化特异性引物(U):正向5′- GGAGGTATTTTATTATGTTGTATGA- 3′,反向5′- TCCTTAACCCTTAACTAATCACAAA- 3′。反应条件:94 ℃ 5 min;94 ℃ 30 s、52 ℃(U)或56 ℃(M)30 s,40个循环;72 ℃ 30 s。以Ⅱ型胶原基因(Type Ⅱ collagen gene,COL2A)作为内参。将上述反应的PCR产物在2%琼脂糖凝胶电泳分离基因条带,甲基化条带阳性和非甲基化条带阴性/阳性皆纳入甲基化组;否则为非甲基化组。此外利用以下公式评价甲基化水平,即交叉点值(crossing point,Cp)变化(ΔCp):ΔCp=Cp靶基因-CpCOL2A。ΔCp值越小表示甲基化程度较高。
1.5 统计学处理

2 结 果
2.1 治疗前RBL1基线甲基化状态与患者临床病理特征的关系
经qMSP法和琼脂糖凝胶电泳分析,治疗前68例患者宫颈脱落细胞中RBL1基因出现甲基化表达,纳入甲基化组,另14例则纳入非甲基化组。分析RBL1基线甲基化状态与临床结果的相关性发现,CCRT治疗前RBL1基线甲基化状态与早期治疗反应有关(P<0.05),而与患者年龄及肿瘤国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期、病理类型、HPV感染状态、淋巴结转移无关(P>0.05),见表1。

表1 患者治疗前RBL1基线甲基化状态与临床病理特征的关系
2.2 患者放疗期间RBL1基因启动子甲基化水平变化
重复测量的方差分析结果显示:(1) 不同时间点RBL1基因启动子甲基化ΔCp值差异有统计学意义,敏感组与抵抗组患者放疗后RBL1基因启动子甲基化ΔCp值均逐渐降低(F时间=44.015,P<0.001);(2) 敏感组与抵抗组患者RBL1基因启动子甲基化ΔCp值比较差异有统计学意义(F组别=38.757,P<0.001),各时间点抵抗组患者的RBL1基因启动子甲基化ΔCp值均低于敏感组(P<0.001);(3) 敏感组与抵抗组患者RBL1基因启动子甲基化ΔCp值变化趋势差异有统计学意义(F组别×时间=16.832,P<0.001),抵抗组患者放疗后RBL1基因启动子甲基化ΔCp值降低程度大于敏感组。此外抵抗组患者T1、T2时的ΔCp值较基线值变化率均大于敏感组(P<0.001)。见表2。
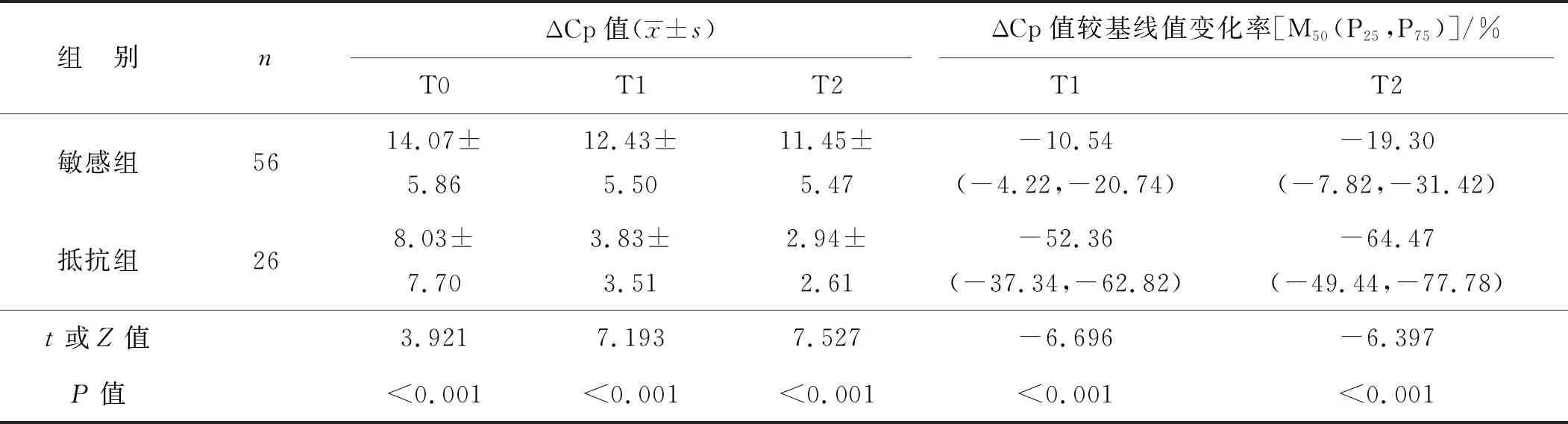
表2 放疗敏感组与抵抗组患者放疗期间RBL1基因启动子甲基化水平变化
2.3 单因素和多因素Logistic回归分析影响宫颈癌放疗早期反应的临床因素
以患者放疗抵抗=1、放疗敏感=0作为因变量,经单因素和多因素Logistic回归分析,肿瘤体积≥15.35 cm3和RBL1基线启动子甲基化都是影响宫颈癌患者发生放疗抵抗的独立危险因素(P<0.05),见表3。
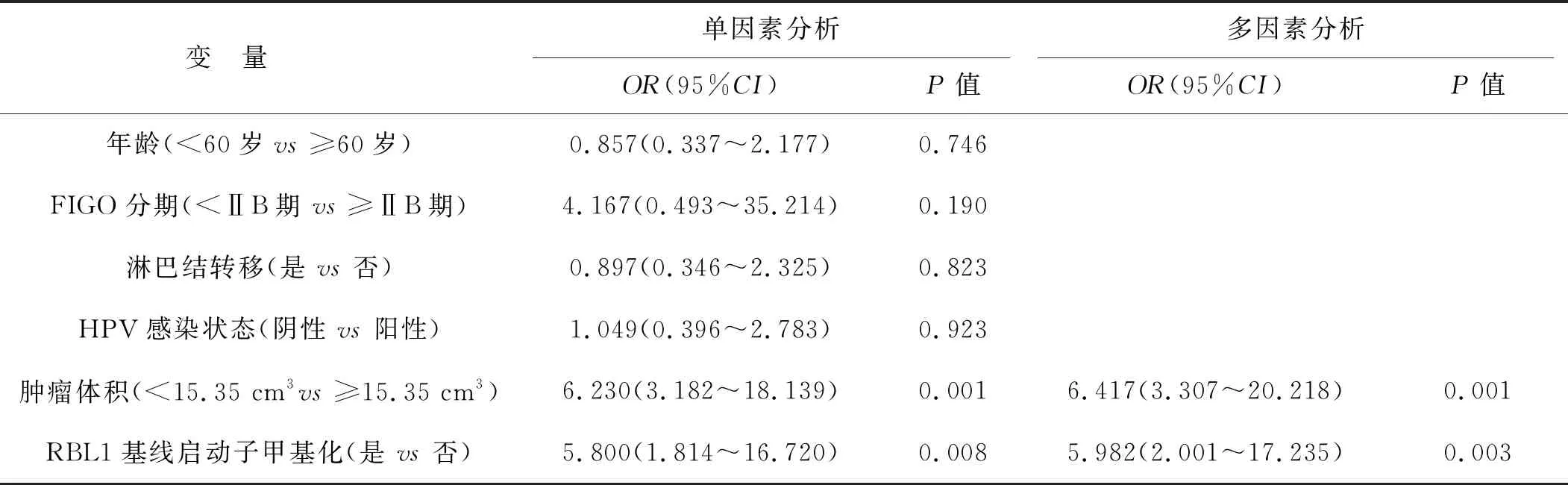
表3 单因素和多因素Logistic回归分析宫颈癌患者发生放疗抵抗的临床因素
2.4 RBL1基线甲基化ΔCp值对宫颈癌患者产生放疗抵抗的预测价值
经ROC曲线分析,RBL1基线启动子甲基化ΔCp值预测宫颈癌患者产生放疗抵抗的AUC为0.794(95%CI为0.697~0.892),最佳临界值为13.585,在该阈值下,灵敏度和特异度分别为96.2%和53.6%,约登指数为0.498。
3 讨 论
宫颈癌早期常无特异性症状,这导致大部分患者确诊时已处于中晚期,同步放化疗是治疗中晚期宫颈癌的首选方案[7],然而放疗抵抗被认为是导致治疗失败或预后不良的主要原因,因此早期准确评估宫颈癌患者放疗敏感性对预后有重要意义。基因甲基化检测在宫颈癌筛查和分层中的作用已得到证实[8]。本研究应用qMSP技术对不同时间点宫颈癌细胞RBL1基因进行检测,发现RBL1基因启动子甲基化水平可以预测和监测早期治疗反应。
肿瘤的发生、发展通常与遗传、表观遗传、环境因素紊乱有关,DNA甲基化属于表观遗传机制的基因表达调控方式,其可引起基因表达的改变及细胞的恶性转化,如致癌基因激活、抑癌基因转录沉默。视网膜母细胞瘤(retinoblastoma,RB)蛋白家族成员相关基因在多种人类恶性肿瘤(如乳腺癌、肺癌、胶质母细胞瘤)中都有不同程度的表观遗传学改变[9],如pRB/p105、RBL2/p130以及RBL1,因其保守口袋结构域被称为“口袋蛋白”,它们可通过该结构域与病毒癌基因蛋白结合[10- 11],进而促进细胞增殖及基因组的不稳定性,在宫颈细胞癌变进程中发挥作用。Ullah等[12]研究证实,RBL2基因启动子高甲基化的乳腺癌组织中RBL2 mRNA表达降低;潘冉冉等[13]基于美国公共癌症基因数据库分析发现,RBL1启动子甲基化与结肠癌发生风险及预后不良有关。在本研究中,我们在脱落的宫颈细胞中检测到RBL1甲基化率为82.93%,然而RBL1基因启动子甲基化组与非甲基化组在患者年龄及肿瘤体积、FIGO分期、组织学类型、HPV感染状态、淋巴结转移方面没有显著差异,提示RBL1甲基化状态可能不受其他临床因素的影响。
既往有研究[14- 15]已经发现基因甲基化状态可用于评估宫颈癌放疗敏感性。Pan等[6]通过体外三维培养MCF- 7和A549细胞证实,RBL1启动子甲基化导致RBL1基因低表达从而增强癌细胞放射抵抗性。这也从细胞学方面解释了本研究结果。我们的临床数据显示,RBL1基因高甲基化与肿瘤早期治疗反应不良有关,说明RBL1高甲基化可能是导致宫颈癌细胞对放射线不敏感的主要原因之一。此外,DNA甲基化状态会受到放射线的影响,可能是辐射诱发癌变的驱动机制之一[14,16]。在本研究中,RBL1基因ΔCp值随着放疗的进行逐渐降低,在放疗后期基本稳定,表明肿瘤细胞的表观遗传变化可能发生在治疗的早期阶段,从ΔCp值变化率分析,放疗抵抗组RBL1基因甲基化水平升高更明显,这也进一步证实RBL1基因甲基化是影响放疗敏感性的重要机制之一。
综上,我们发现,RBL1基因甲基化状态与宫颈癌放疗抵抗有关,因此RBL1甲基化作为一个有前途的生物标志物在宫颈癌的治疗随访中起着重要作用,监测RBL1甲基化的动态变化可以帮助优化个体化治疗策略。此外将RBL1甲基化检测与传统影像学方法相结合,可能为预测放疗抵抗提供一种新的方法。
