祁连山云杉林土壤溶磷细菌的分离及对白三叶的促生效应
2022-04-25李慧萍甘雅楠韩庆庆张明旭何傲蕾张金林
李慧萍, 甘雅楠, 韩庆庆, 姚 丹, 陈 佳, 张明旭, 何傲蕾, 张金林, 赵 祺
(兰州大学农业农村部草牧业创新重点实验室, 兰州大学草地微生物研究中心, 兰州大学草地农业生态系统国家重点实验室,兰州大学草地农业科技学院, 甘肃 兰州 730020)
磷元素是所有生命体必需的元素之一,在农业生产系统中必不可缺。全球土壤平均磷含量约为0.04%。其中,80%~90%与土壤中的Ca2+,Fe2+,Fe3+和Al3+结合,形成了无效态的难溶性磷酸盐复合物,剩余的10%~20%以缓效磷形式存在,很难被植物直接吸收利用[1-2]。此外,由于磷酸盐矿石的不可再生特性和土壤缺磷的广泛现象,导致磷素营养源已成为限制作物产量和品质的关键因素之一[3-4]。因此,为了解决磷素对可持续农业的限制问题,高效利用土壤中难溶性磷是解决上述问题的重要出路。
土壤微生物不仅是土壤无机质转化的媒介,还是植物营养元素的贮藏库,更是土壤磷循环的中心[5-6]。植物根际蕴藏丰富的微生物资源,其中具有溶磷能力的细菌群体在生态系统的功能调控中发挥着重要作用,这类细菌被统称为溶磷细菌(Phosphate solubilizing bacteria,PSB)。PSB能够通过酸化作用、螯合作用、交换反应产生葡萄糖酸等物质,将土壤中不可溶的磷转化为植物根系可吸收利用的磷,来满足植物生长对磷的需求[7-8]。此外,研究表明PSB还能通过提高生物固氮效率,增强其他微量元素(如铁,锌)的有效性以及产生植物激素来促进植物生长[8-9],或产生铁载体、抗生素和氰化物等物质来减缓或抑制病原微生物的活动,保护植物免受土传病原体的侵害[8]。因此,PSB与植物的相互作用对于提高作物产量和维持土壤肥力具有很大的实用价值。假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)和根瘤菌属(Rhizobium)的菌株通常是具有强溶磷能力的主要PSB[8,10-11];还有研究表明,PSB菌株在沙雷氏菌(Serratia)、节杆菌(Arthrobacter)、黄杆菌(Flavobacterium)、叶杆菌(Phyllobacterium)、红球菌(Rhodococcus)、固氮菌(Azotobacter)、黄单胞菌(Xanthomonas)、肠杆菌(Enterobacter)、伯克霍尔德氏菌(Burkholderia)、克雷伯氏菌(Klebsiella)、欧文氏菌(Erwinia)、大肠埃希菌(Escherichia)和微球菌(Micrococcus)等属少量分布[8,10,12]。
祁连山位于青藏、黄土和蒙新三大高原交汇地带,是我国西部生态安全屏障的重要组成部分[13]。该地区气候类型多变、辐射强、高寒、缺氧、植被类型丰富多样且空间分布差异明显[13]。青海云杉(Piceacrassifolia)是祁连山典型森林生态系统的优势乔木建群种之一[14]。近年来,有关祁连山地区土壤养分特征、群落结构和微生物多样性已有较多研究[15-17]。草地生态系统和森林生态系统作为祁连山主要的生态系统,自然条件下,其草地牧草和森林植被的磷素营养很大程度上依赖于土壤微生物对磷的周转[18]。PSB所具备的生理生化特性能使土壤中可利用态磷素更丰富,使营养物质容易被宿主植物吸收,从而促进植物的生长。近年来,已有学者使用微生物分离培养的方法,对祁连山生境中PSB菌株的溶磷能力进行了研究[18],但关于该生境中的PSB菌株与植物互作方面的相关报道较少。白三叶(TrifoliumrepensL.)作为我国西北地区的优质牧草资源,营养价值丰富、产量高、品质好。同时,其地上部茎叶繁茂,匍匐茎节较多,可扎根固定在土壤表面,能够有效防止水土流失,并对盐碱胁迫也有一定的耐受性,有利于其生态建设。可见,白三叶的培育和生产对于我国西北地区草牧业发展尤为重要[19]。因此,本研究使用选择性培养基,对祁连山云杉林土壤中的PSB菌株进行分离,分析评价从上述土壤所分离菌株的分类地位和溶磷性能。进一步采用盆栽试验研究其中四株PSB菌株对白三叶生长的影响,以期为研发应用于牧草栽培的微生物菌肥提供理论依据和菌种资源。
1 材料与方法
1.1 土样采集
供试土样收集自甘肃境内河西走廊南侧的祁连山(38°15′47″ N,99°32′32″ E,海拔2 750 m)林下,采样地优势植被类型为青海云杉林。随机选取5个采样地,去除地表苔藓层、枯落物和有机质层,用五点取样法对每个样地进行取样,采集土层深度为10 cm的土样。将采集的土样放置于无菌离心管中,并于4℃便携式小冰箱中保存,带回实验室立即进行溶磷细菌的分离。
1.2 PSB菌株的分离
称取10 g土样于100 mL 0.9% 氯化钠溶液的锥形瓶中,放置25℃、150 r·min-1摇床中振荡30 min,然后静置1 h,将土悬液上清缓慢倒入无菌离心管中,5 000 r·min-1离心8 min。离心完成后弃除大部分上清液,重悬剩余部分,吸取10 mL重悬液至灭菌离心管,由此得到10-1的土悬液。取10-1的土悬液1 mL至9 mL 0.9%的无菌氯化钠溶液得到10-2的土悬液,依此逐级稀释至10-6。然后,分别取100 μL稀释后的溶液涂布于难溶性无机磷固体培养基(National botanical research institute phosphorus,NBRIP):[葡萄糖 10 g·L-1,磷酸钙5 g·L-1,氯化镁5 g·L-1,七水硫酸镁 0.25 g·L-1,氯化钾 0.2 g·L-1,硫酸铵0.1 g·L-1,琼脂 15 g·L-1,pH值(7.0±0.2)]。置于28℃培养箱中培养5天。待培养基上菌落形态清楚可见,挑取在培养基上产生明显透明圈的单菌落于NBRIP液体培养基中富集培养,并收集菌液,再次划线纯化。最后将纯化后的菌株,加入甘油保存于-80℃超低温冰箱。
1.3 PSB菌株的分子生物学鉴定
PSB菌株基因组DNA的提取方法参照赵祺[20]及李惠茹[21]。使用细菌通用引物27F:5′-AGAGTTTGATCCT GGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′ 扩增菌株16S rRNA基因序列。PCR扩增体系:Taq预混酶(5 U·μL-1)10 μL,正向引物 27F(10 pmol·μL-1)0.5 μL,反向引物 1 492R(10 pmol·μL-1)0.5 μL,模板(细菌基因组DNA)0.5 μL,去离子水8.5 μL。扩增条件:94℃预变性3 min,94℃变性30 s,55℃复性30 s,72℃延伸90 s,进行30个循环,最后72℃延伸10 min。然后通过1%琼脂糖凝胶电泳检测PCR产物,PCR产物送北京奥科鼎盛生物技术有限公司测序。通过EzTaxon(https://www.ezbiocloud.net/apps)和Genbank(https://www.ncbi.nlm.nih.gov/genbank/)在线数据库比对分析上述测序得到的16S rRNA基因序列。使用MEGA 7.0软件构建Neighbor-joining系统进化树,同时使用Kimura的双参数模型计算进化距离,用bootstrap进行检验,并重复1 000次。
1.4 PSB菌株溶磷能力分析
将初筛得到的PSB菌株划线于TSA(15 g·L-1胰蛋白胨,5 g·L-1大豆蛋白胨,5 g·L-1氯化钠,琼脂 15 g·L-1,pH值(7.3±0.2)平板上,待培养基上菌落形态清楚可见。挑取单菌落于TSA液体培养基富集培养,离心收集对数生长期的菌体。用无菌生理盐水洗涤对数生长期的菌体3次后,重悬菌体,并将菌悬液的OD600调至0.8。取10 μL菌悬液点于NBRIP平板上,并按1%的接种量接种至NBRIP液体培养基,每个处理设置6个重复,28℃恒温培养。每隔24 h观察菌株的生长及溶磷情况,并用游标卡尺测量溶磷圈直径(D)和菌落直径(d),根据D/d比值的大小来初步判断菌株的溶磷能力[22-23]。用钼锑抗比色法测定发酵液的可溶性磷含量[24-25]。
1.5 PSB菌株对白三叶生长的影响
选取菌株LT-4,LT-T17,LT-A20和F1-P7开展促生试验。首先选取一批籽粒饱满和色泽形态一致的白三叶种子(cultivar Huia,由甘肃省农业科学院惠赠),并用70%的乙醇表面消毒1 min。然后用2%次氯酸钠消毒10 min后,用无菌水漂洗10次,洗涤过程中不断搅动。将表面消毒完全的种子浸泡在无菌水中,置于4℃冰箱春化24 h后平铺于培养皿中进行萌发。种子种植和生长均在兰州大学草地农业生态系统国家重点实验室植物生长室进行,培养条件如下:温度为(28±2)/(23±2)℃(白天/黑夜),光照周期为14 h/10 h(光照/黑暗),光强度为800 μmol·m-2·s-1,相对湿度为(70±10)%。待种子长出子叶后,挑取萌发整齐的种子移入灭菌蛭石中,并在生长10天后进行间苗,每盆留1株长势一致的白三叶幼苗。对每株幼苗茎基部接种2 mL OD600=0.8的菌悬液,同时接种等量的无菌生理盐水和大肠杆菌(EscherichiacoliDH5α)作为空白和阴性对照。接菌20天后取样,用刻度尺测量株高和根长;用称重法测定植株鲜干重;叶绿素含量和根系活力测定方法参考He等[26]。
1.6 数据分析
利用Excel 2010 整理数据,SPSS 19.0 进行单因素方差分析(P<0.05)及差异显著性检验,并采用Duncan法进行多重比较。
2 结果与分析
2.1 PSB菌株的筛选及溶磷能力定性分析
以菌株在NBRIP平板上是否产生明显、清晰的溶磷圈为筛选依据,初步获得12株具有溶磷能力的菌株(图1)。纯化初筛获得的菌株,对其溶磷特性进行分析,发现上述PSB菌株在NBRIP固体培养基中的生长特性和溶磷能力存在显著差异(P<0.05)(表1)。结果显示,12株PSB菌株的菌落直径、溶磷圈直径和D/d的比值范围分别为0.54~0.70,0.84~1.67和1.44~2.40。其中,菌株LT-0的菌落直径最大,F1-P7次之,LT-N17的菌落直径最小。与之对应的菌落直径分别为:0.70 cm,0.68 cm和0.54 cm。溶磷圈直径最大的为菌株LT-0,F1-P7次之,LT-A18最小,其值分别为:1.67 cm,1.56 cm和0.84 cm。菌株LT-0的D/d比值最大,F1-P7次之,LT-A18最小,其值分别为:2.40,2.28和1.44。此外,菌株LT-2和菌株LT-4的菌落直径比较接近,两者无显著差异,且溶磷圈直径及D/d的比值也无显著差异。

图1 PSB菌株的NBRIP平板初筛结果
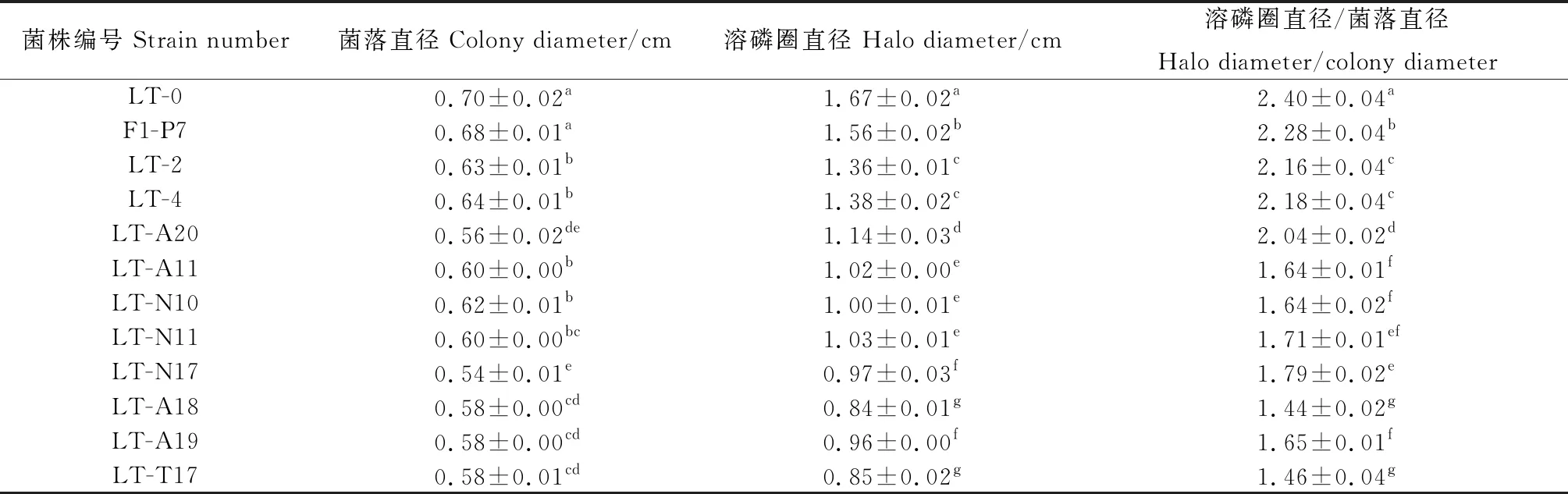
表1 12株PSB菌株的溶磷能力定性分析(平均值±标准误,n =6)
2.2 PSB菌株的16S rRNA基因序列分析
根据16S rRNA基因序列的鉴定和系统进化树分析,结果显示筛选获得的12株PSB菌株均属于假单胞菌属(Pseudomonas)。表2和图2分别是基于16S rRNA基因序列的相似度比对结果和系统进化树。其中,与菌株LT-2和LT-4的16S rRNA基因序列比对相似度最高的典型菌株皆为假单胞菌属的Pseudomonasyamanorum8H1T;系统进化树结果表明,菌株LT-2和LT-4与Pseudomonasyamanorum8H1T的亲缘关系最近。菌株LT-A11,LT-N11,LT-N17和LT-A18均与假单胞菌属的典型菌株PseudomonassilesiensisA3T的16S rRNA基因序列相似度最高;基于16S rRNA基因序列的系统进化树表明,这四株菌均与PseudomonassilesiensisA3T的亲缘关系最为相近。菌株LT-0的16S rRNA基因序列比对相似度与PseudomonasluteolaKS0921T最高;系统进化树结果显示,菌株LT-0与PseudomonasluteolaKS0921T位于同一分支,两者亲缘关系最近。菌株F1-P7的16S rRNA基因序列相似度与Pseudomonasbrassicacearumsubsp.neoaurantiacaCIP 109457T最高;系统进化树结果表明,菌株F1-P7与Pseudomonasbrassicacearumsubsp.neoaurantiacaCIP 109457T位于同一分支,两者亲缘关系最近。菌株LT-A20,LT-N10,LT-A19和LT-T17的16S rRNA基因序列相似度最高及系统进化树中亲缘关系最相近的菌株均分别为PseudomonasfrederiksbergensisJAJ28T,PseudomonasmarginalisATCC 10844T,PseudomonassalomoniiCFBP 2022T和PseudomonasavellanaeBPIC 631T。因此,在菌株溶磷能力定性分析和进化分析的基础上,选取了D/d比值较高的4株菌株LT-0,LT-4,F1-P7,LT-A20及D/d比值相对较低但其分类地位与其他菌株较远的菌株LT-T17进行下一步溶磷能力定量分析。

表2 基于16S rRNA基因序列的PSB菌株的鉴定
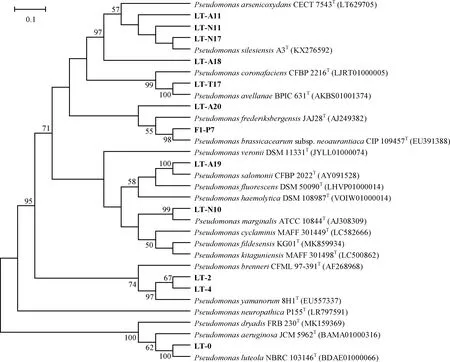
图2 基于16S rRNA基因序列的系统进化树
2.3 PSB菌株的溶磷能力定量分析
菌株LT-T17,LT-0,F1-P7,LT-4和LT-A20的溶磷能力定量分析结果如图3所示。所有菌株在NBRIP液体摇瓶中产生的可溶性磷含量随培养时间而显著变化,并且48 h内可溶性磷含量增长较快。其中,菌株LT-0,F1-P7和LT-4发酵液的可溶性磷在96 h达到最大值,其值分别为431.68 μg·mL-1,441.67 μg·mL-1和479.87 μg·mL-1。菌株LT-A20在144 h时,发酵液的可溶性磷含量达到峰值,其值为490.22 μg·mL-1。而菌株LT-T17培养液的可溶性磷含量随时间变化的峰值现象不明显,且可溶性磷含量的最大值为388.48 μg·mL-1。

图3 5株PSB菌株在NBRIP液体培养基中的溶磷能力定量分析
此外,菌株在溶解难溶性无机磷酸盐的过程中会伴随着发酵液pH值的下降。在培养过程中,5株菌株发酵液的pH值随培养时间的变化情况如图4所示。其中,菌株LT-0,F1-P7和LT-4发酵液的pH值在24 h内下降速度最快,pH值分别降低了2.87,2.84和2.77。随着培养时间的增加,菌株LT-0,F1-P7和LT-4发酵液的pH值缓慢增加。但在144 h后,菌株LT-0和LT-4发酵液的pH值呈现下降趋势。菌株LT-A20培养液的pH值在48 h内降低了2.4,之后基本趋于稳定。而菌株LT-T17发酵液的pH值在24 h时略有增加,之后随培养时间的增长而降低,并于72 h后基本趋于稳定。
2.4 PSB菌株对白三叶生长的影响
2.4.1PSB菌株对白三叶株高和根长的影响 基于系统进化分析和菌株溶磷能力结果,对菌株LT-4,LT-T17,F1-P7和LT-A20接种白三叶后植株的生长效应进行了研究(图5)。与空白对照相比,接种菌株LT-4,LT-T17,LT-A20和F1-P7后,白三叶株高分别增加了13.27%,3.26%,2.81%和1.35%(图5c),根长分别是空白对照的1.14,1.09,0.91和0.96倍(图5 d)。接种菌株LT-4的白三叶株高的增加与空白对照相比差异显著(P<0.05),菌株LT-T17,F1-P7和LT-A20对白三叶株高和根长的增加效果与空白对照相比差异不显著。另外与阴性对照(大肠杆菌DH5α)相比,经菌株LT-4和LT-T17处理的白三叶株高分别增加了12.51%和2.57%(图5c),根长分别是阴性对照的1.07和1.02倍(图5 d),并且接种菌株LT-4的白三叶株高的增加与阴性对照相比也存在差异显著(P<0.05)。经菌株F1-P7和LT-A20处理的白三叶株高和根长与阴性对照相比差异不显著。根据上述结果表明,接种菌株LT-4对白三叶株高增加效果显著;接种菌株LT-4对白三叶根长的增加效果虽未达到显著差异,但其根长在所有处理中是最长的。

图5 不同PSB菌株对白三叶株高和根长的影响(平均值±标准误,n =6)
2.4.2PSB菌株对白三叶生物量积累的影响 如图6所示,主要展示了本研究中筛选的PSB菌株对白三叶生物量积累的影响。与空白对照相比,接种菌株LT-4和LT-T17的白三叶的生物量积累增加效果较为明显。菌株F1-P7对白三叶地上部鲜干重和地下部鲜干重的增加效果均低于空白对照。菌株LT-A20对白三叶地上部鲜重和地下部鲜重的增加效果均低于空白对照,但对白三叶地上部干重和地下部干重的增加效果均略高于空白对照。接种菌株LT-4和LT-T17后白三叶地上部鲜重分别是空白对照的1.13和1.05倍,地下部鲜重分别是空白对照的1.25和1.19倍(图6a,6b);地上部干重分别增加了87.01%和45.12%,地下部干重分别增加了74.83%和49.57%(图6c,6d)。接种菌株LT-4的白三叶地上部干重和地下部干重的增加与空白对照相比差异显著(P<0.05)。
同空白对照结果类似,经菌株LT-4和LT-T17处理的白三叶生物量积累较阴性对照增加效果明显。接种菌株F1-P7的处理中,白三叶地上部鲜干重和地下部鲜干重的增加均低于阴性对照。接种菌株LT-A20的处理中,白三叶地上部鲜重和地下部鲜重的增加低于阴性对照,但白三叶地上部干重增加略高于阴性对照,白三叶地下部干重的增加与阴性对照相同。接种LT-4和LT-T17的白三叶地上部鲜重分别是阴性对照的1.33和1.24倍,地下部鲜重分别是阴性对照的1.71和1.63倍(图6a,6b);地上部干重分别是阴性对照的1.91和1.48倍,地下部干重分别是阴性对照的1.44和1.23倍(图6c,6d)。上述结果显示,菌株LT-4对白三叶生物量积累的提高效果最为显著(P<0.05),菌株LT-T17次之;而接种菌株F1-P7和LT-A20对白三叶生物量积累无显著提高。

图6 不同PSB菌株对白三叶生物量积累的影响(平均值±标准误,n =6)
2.4.3PSB菌株对白三叶根系活力和叶绿素含量的影响 接种PSB菌株对白三叶根系活力和叶绿素含量的影响如图7所示。接种LT-4,LT-T17,LT-A20和F1-P7后,白三叶根系活力分别是空白对照的3.09,1.75,1.72和1.24倍,是阴性对照的2.82,1.60,1.57和1.13倍(图7a)。菌株LT-4,LT-T17和LT-A20对白三叶根系活力的增加效果与空白对照相比差异显著(P<0.05)。但与阴性对照相比,仅菌株LT-4对白三叶根系活力的增加效果差异显著(P<0.05)。
经菌株LT-4,LT-T17,LT-A20和F1-P7接种处理的白三叶,叶绿素a含量分别是空白对照的1.88,1.57,1.57和1.29倍(P<0.05),叶绿素b含量分别是空白对照的1.27,1.01,1.12和0.92倍,且菌株LT-4对白三叶叶绿素b含量的增加效果与空白对照相比差异显著(P<0.05)。接种PSB菌株LT-4,LT-T17,F1-P7和LT-A20后,叶绿素a含量分别是阴性对照的1.56,1.31,1.31和1.07倍(P<0.05),叶绿素b含量分别是阴性对照的1.41,1.12,1.24和1.02倍(图7b),且菌株LT-4对白三叶叶绿素b含量的增加效果与阴性对照相比差异显著(P<0.05)。进一步分析发现,菌株LT-4与空白对照以及阴性对照相比,提升白三叶叶绿素含量的效果最为显著(P<0.05)。因此,根据PSB菌株对白三叶根系活力和叶绿素含量的影响,发现菌株LT-4对白三叶根系活力和叶绿素含量提高的效果最为显著(P<0.05)。
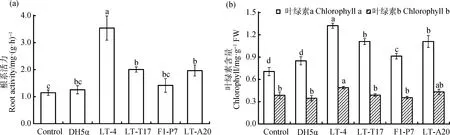
图7 不同PSB菌株对白三叶根系活力和叶绿素含量的影响(平均值±标准误,n =6)
3 讨论
溶磷细菌(PSB)是土壤生态系统的重要组成部分,它的生命活动直接或间接地影响着土壤健康[25,27]。长久以来,研究者们期望从不同的生态环境中筛选到强效的PSB。祁连山作为我国西部重要的生态安全屏障,气候多变,植被类型多样。这种独特而极端的生境中蕴藏着丰富的微生物资源,具有较高的研究价值[13,28]。张宇龙等[18]从东祁连山高寒草地土壤中筛选出三株具有较好溶无机磷能力的菌株。因此本研究聚焦于祁连山典型森林生态系的优势植被—云杉林,采用以磷酸钙为唯一难溶性磷源的选择性培养基从其生长的根际土壤中分离筛选出12株具有溶解磷酸钙能力的菌株,经16S rRNA基因序列的相似度比对和系统进化树分析,发现12株PSB均为Pseudomonas属的菌株,与之前学者们得出PSB的优势菌属是假单胞菌这一研究结果相吻合[8,10]。
PSB增溶难溶性磷的主要方式之一是通过分泌有机酸类物质,产生的有机酸类物质通过羟基和羧基螯合与磷酸盐结合的阳离子,或通过释放H+降低pH值,最终提供可溶性的磷酸盐供有机体生长所需[18,27,29-31]。因此,在PSB发挥功能的过程中,会伴随着pH值的下降,并且与菌株自身的溶磷能力密切相关。Pande等[32]采用磷酸三钙为唯一磷源的培养基,共分离鉴定出8个PSB菌株,其中3株具有较高的溶磷能力,其发酵液的可溶性磷含量在277.72~305.49 μg·mL-1之间,pH值下降到3.08~3.82之间。韩丽珍等[31]对2株具有较强溶磷能力的芽孢杆菌的溶磷机制研究发现,培养液中的可溶磷含量与pH值呈显著负相关。本研究发现菌株LT-4,F1-P7和LT-A20在培养6天时,发酵液的可溶性磷含量峰值在441.67~490.22 μg·mL-1之间,说明这三株菌株具有较好的溶解无机磷的能力。在这一过程中,发酵液的pH值降至5.12~4.36之间,进一步验证了难溶性磷增溶与pH值密切相关,且呈负相关。由上可见,本研究从祁连山云杉林下采集的土壤中,筛选到具有较强溶磷性能的PSB菌株,蕴藏着巨大的开发价值,有望为开发高效的生物溶磷菌肥提供菌种资源。
PSB作为一类优良的根际促生菌,主要是通过增加难溶性磷的溶解,提高土壤有效磷含量,易于为植物吸收利用,从而促进植物的生长[27]。在可持续农业生产中,常采用根际微生物管理的方法来提高磷对作物的生物有效性,以达到促进农作物生物量积累,提高其单产量的目的[8]。研究表明,无论是盆栽还是田间试验,接种溶磷微生物都可以促进植物生长和提高农作物产量[12,24,29,32-33],如李玉娥等[29]发现在盆栽条件下接种具有溶磷能力的解淀粉芽孢杆菌LM12和LM18后,苜蓿(Medicagosativa L.)株高分别增加43.9%和19.0%,干重分别增加24.5%和29.6%。关于PSB菌株对农作物的促生已有较多研究,但对牧草促生方面的相关报道较少[12,24,29,34]。吕俊等[12]从贵阳市花溪区马尾松人工林中筛选出1株溶磷效果最优的菌株Burkholderiasp.WJ27,其接种剂能够分别提高马尾松(PinusmassonianaL.)幼苗地上部鲜重,干重和根系鲜重,干重44.7%,60.0%,158.3%和100.0%。本研究获得的PSB菌株中LT-4可显著提高白三叶的株高、根长和鲜干重。接种LT-4的白三叶,其根系活力和叶绿素含量也得到显著增加,由此可知,接种菌株LT-4能显著促进白三叶根系发育以及提升其光合作用能力,最终表现为植物的生物量积累。这也验证了吕俊等[12]的研究结果,即PSB菌株的溶磷能力和促生效果之间存在一定的相关性。此外,溶磷能力和促生效果的相关性还可能来源于菌株LT-4分泌的有机酸类物质,其将不溶性的磷酸盐转化为可溶态供植物生长所需,菌株LT-4分泌的有机酸种类及相关作用机制有待进一步研究。此外,PSB菌株LT-4对其他牧草的促生稳定性和复合接种效果也需进一步展开试验进行验证。然而在本研究中发现筛选获得的同属不同种的PSB菌株F1-P7和LT-A20也具有较好的溶磷能力,但对白三叶的生长无明显促生效果。正如Taurian等[35]研究结果,菌株J157可以产生较大的溶磷圈,但对花生(ArachishypogaeaL.)产量没有明显的影响。这可能与菌株的遗传变异的多样性以及对宿主的选择性密切相关,这也是植物与微生物相互作用的研究热点,尚待于进一步从分子机制和生理机制深入挖掘。
4 结论
从祁连山云杉林下采集的土样中共分离筛选到12株PSB菌株,系统进化分析表明这12株PSB菌株都属于假单胞菌属。通过溶磷定量分析后,获得了5株具有较好溶磷能力的菌株(LT-A20,LT-4,F1-P7,LT-0和LT-T7)。接种牧草白三叶结果表明,菌株LT-4和LT-T17皆可促进白三叶的生长,以菌株LT-4效果最佳。本研究获得的菌株LT-4因其所具有的高溶磷性能和强促生效应可作为开发栽培牧草专用微生物菌剂或菌肥的菌种资源。
