施氮对贫瘠红壤定植芒草根际土有机碳矿化过程的影响
2022-04-25伍旖旎傅童成易自力薛帅
伍旖旎, 许 依, 傅童成, 易自力, 薛帅*
(1. 作物种质创新与资源利用重点实验室, 湖南农业大学生物科学技术学院, 湖南 长沙 410128; 2. 中国农业大学农学院,北京, 100193; 3. 芒属植物生态应用技术湖南省工程实验室, 湖南农业大学, 湖南 长沙 410128; 4. 国家能源非粮生物质原料研发中心湖南分中心, 湖南农业大学, 湖南 长沙 410128)
如今,我国人均耕地资源缺乏,承载力已达上限,粮食安全面临威胁。在此背景下,国家颁布并实施了“藏粮于地、藏粮于技”战略。其中,改良资源丰富的边际土地可作为实施“藏粮于地”战略的重要策略[1]。改良能使部分环境恶劣程度相对较轻的边际土地具备中低等地产能水平,以保障国家粮食安全。贫瘠红壤作为一种重要边际土地类型,主要分布在我国南方地区,面积约有1.6亿亩。和西北荒漠地、北方盐碱地等边际土壤类型相比,贫瘠红壤主要特点是高度风化、水土流失严重、土壤有机质匮乏,而其光温水条件较为充足,是改良难度最小,潜力最大的边际土地类型[2]。
植物改良与其他改良方法相比,具有成本低、易操作、无二次污染等优点,可使边际土地土壤有机质大量积累,土壤肥力与生产潜力大幅提高。理论上,芒草(Miscanthusspp.)、柳枝稷(PanicumvirgatumL.)等高大禾草在较为贫瘠的条件下依然能产生较高的生物量[3]。然后通过地上茎秆、落叶及地下老化根茎的腐烂将光合固定的碳输入土壤,从而增加土壤有机质的含量[4-5]。另外,有研究表明,芒草根系统可以富集固氮微生物,进而增加土壤中的氮含量;其根系中的解磷、解钾微生物的富集可以增加土壤中的有效磷和速效钾含量[6-8]。芒草产生的生物质还可以转化为生物能源(比如生物乙醇)、化工产品(比如低聚木糖、纳米纤维等)等增加植物改良的经济效益[9-11]。笔者所在课题组已经证明种植芒草可以改良盐碱土,促使盐碱土壤的pH值、电导率降低,土壤有机质、总钾含量增加,还可以改变土壤微生物群落的组成丰度,富集有益菌以促进土壤脱盐[12]。由此可见,芒草是一种改良边际性土地的优势植物类型。
土壤有机碳是土壤质量的核心,维系着粮食安全、气候变化等关于人类生存发展的诸多要素[1]。土壤有机碳的含量主要取决于土壤中有机物料的投入与降解,即碳输入与碳输出。其中,大部分外来有机物料如生物残体、有机肥料等被微生物降解生成CO2(即矿化),是微生物活动所利用碳源的主要来源,也是植物可利用养分的主要来源;而只有一部分不易被分解的成分以土壤有机质的形式储藏于土壤之中,形成了土壤中的碳固存量[13]。施氮是利用改良后边际土壤不可或缺的农艺措施,但人为添加氮后会迅速改变土壤中的C/N结构,从而影响土壤固定碳的重新释放[14]。与此同时,在以往的实地研究中,施氮对陆地生态系统(森林、草原、荒漠、湿地以及受人工干预的农田)的土壤有机碳矿化有着不同的影响,包括促进[15]、抑制[14]和无影响[16]三种情况,主要取决于氮输入后对土壤碳氮的存在形式与比值、植物根生长量与周转、土壤微生物群落结构、微生物生物量与活性的影响[17]。基于此,本试验拟在人工施氮条件下,将经长期种植芒属植物改良后的贫瘠红壤进行室内定温矿化培养,探究氮肥对芒属植物修复后的边际土地中固定的土壤矿化影响以及驱动机制,为南方贫瘠酸性红壤的改良修复后的田间管理提供参考依据。
1 材料与方法
1.1 土壤样品采集及矿化培养
2021年1月于试验基地采集芒属植物根际土壤样品:以“S”型随机选取5棵植株挖出,抖动其根系,对仍附着在根和根茎上的土壤进行采集并充分混合,然后人工去除土壤内的枯枝落叶和根系残茬,过2 mm网筛后,使用四分法采集4个重复总共收集200 g根际土壤样品。所采集的芒属植物为湖南农业大学培育的‘湘杂芒1号’,于2011年在湖南农业大学芒属植物实验基地(27°51′ N,113°10′ E)种植,详情参考侯维等人前期研究[2]。种植后,每年的11月底至12月初收获地上部生物质并将其移出。在2012年生长季节后,不进行任何其他田间管理措施。
土壤有机碳矿化培养试验采用室内恒温培养,碱液吸收法测定。将经上述处理后的新鲜土样称取30.0 g,置于250 mL广口培养罐底部,用NH4Cl溶液和去离子水设置空白(Control,CK)、低氮(Low nitrogen,LN)、高氮(High nitrogen,HN)三个氮添加水平,分别对应于0,52,208 mg N·kg-1soil,相当于在全国各地水稻目标产量4.5~10.5 t·hm-2的基础上其大田施氮量为0 kg·hm-2,75 kg·hm-2,300 kg·hm-2[18],且调节全土含水量至田间饱和持水量的70%。每个处理重复4次,密封并置于25℃恒温培养箱中预培养5 d(遮光)以恢复微生物活性,之后将盛有5 mL 1 mol·L-1NaOH溶液的小玻璃杯放入培养罐中,继续密封并置于25℃恒温培养箱中遮光培养。在培养后的第1,3,5,7,14,21,30,40,50 d更换碱液玻璃杯,并对置换出来的杯内碱液进行滴定。取1 mL碱液于小烧杯中,加入1 mL 1 mol·L-1BaCl2溶液,再滴加适量的酚酞指示剂,后用0.2 mol·L-1标准HCl溶液滴定直至红色消失。根据标准HCl溶液滴定量计算培养期内全土有机碳矿化量(Cumulative mineralization,CM,单位:mg C·kg-1dry soil)。试验培养周期为60 d。
1.2 土壤理化性质分析
将经矿化培养试验后的根际土壤样品进行理化性质分析。采用FiveEasyTMplus台式pH计-FE28(Mettler Toledo,瑞士)测定土壤pH值。采用重铬酸钾氧化法测定总有机碳(Total organic carbon,TOC,单位:g·kg-1)。采用自动凯氏定氮仪K9840(海能,深圳)测定全氮(Total nitrogen,TN,单位:g·kg-1);采用氯仿熏蒸浸提法(TOC总有机碳/总氮分析仪-multi N/C 3100,耶拿,德国)测定微生物生物量(Microbial biomass,MB,单位:mg·kg-1)和微生物生物量氮(Microbial biomass nitrogen,单位:mg·kg-1);在MB和MBN分析中测定未熏蒸样品中的可溶性有机碳(Dissolved organic carbon,DOC,单位:mg·kg-1)和可溶性有机氮(Dissolved organic nitrogen,DON,单位:mg·kg-1);采用可见分光光度计UV-8000(元析,上海)测定铵态氮(Ammonium nitrogen,NH4+-N,单位:mg·kg-1)和硝态氮(Nitrate-nitrogen,NO3--N,单位:mg·kg-1)。
1.3 数据处理
土壤有机碳矿化量、激发效应、相对激发相应、微生物代谢熵由公式1—4求得。
Cm=CHCl×(V0-V1)×30/m×1000
(1)
PE=Cn-Cc
(2)[14]
RPE=PE/Cc
(3)
qCO2=MR/MB
(4)
式中,Cm为土壤有机碳矿化量,单位:mg C·kg-1dry soil;CHCl为标准盐酸溶液浓度,单位:mol·L-1;V0为滴定空白的盐酸消耗量,单位:mL;V1为滴定碱液的盐酸消耗量,单位:mL;m为根际土壤样品的重量,单位:g;30为常数;1000为单位转换系数;PE为激发效应,Priming effect,单位:mg C·kg-1dry soil,若为正值则是正激发效应(即促进土壤有机碳矿化),反之则是负激发效应(即抑制土壤有机碳矿化);Cn为施氮处理矿化量,单位:mg C·kg-1dry soil;Cc为对照矿化量,单位:mg C·kg-1dry soil;RPE为相对激发效应,Relative PE,单位:%;qCO2为微生物代谢熵,The metabolic quotient,单位:mg C·mg-1biomass C·d-1;MR为矿化速率,Mineralization rate,单位:mg C·kg-1·d-1;MB为微生物生物量,Microbial biomass,单位:mg·kg-1。
采用公式5拟合土壤有机碳矿化量速率、激发效应、相对激发效应,采用公式6拟合土壤累积矿化量。拟合值准确性使用均方根误差和拟合度进行评价(公式7和公式8)。
y=a-bln(x+c)
(5)
y=a(1-e-kx)
(6)
(7)
(8)
式中,a,b,c均为模型拟合系数;RMSE为均方根误差,root mean square error;R2为拟合度,R-squared;Ct为模拟值,C0为实测值,Cavg为平均值。
试验数据采用IBM SPSS Statistics 22.0进行夏皮洛-威尔克检验(Shapiro-Wilk test)即正态性检验,正态性检验结果表明,各数据检验的P值均大于0.05,说明与正态性没有显著差异,成正态性分布(附表1)。在此基础上,对试验数据进行了单因素方差分析(one-way ANOVA)和Duncan差异显著性检验(P<0.05)。用OriginLab Origin 2021作图。
2 结果与分析
2.1 不同施氮量处理对芒草长期定植后的土壤有机碳矿化过程的影响
如图1A所示,在试验培养的第1~5 d,高氮处理下的土壤有机碳矿化速率大于低氮处理2.72%~28.59%,但在培养的第7 d开始,高氮处理下的土壤有机碳矿化速率小于低氮处理2.54%~24.76%。总体上,土壤有机碳矿化速率随着培养时间增加而逐渐下降且下降趋势趋于平缓,呈现对数曲线关系,施氮处理降低了土壤有机碳矿化速率,且施氮量越高,土壤有机碳矿化速率越低。矿化培养第7 d时,不同施氮量处理下的土壤有机碳矿化速率分别为21.60(CK),22.93(LN),22.35(HN) mg C·kg-1dry soil·d-1,且各处理间不存在显著差异。从矿化培养的7 d后开始,各处理之间的土壤有机碳矿化速率开始逐渐产生显著差异(P<0.01),且整体呈现对照>低氮>高氮趋势。在第60 d时,矿化速率分别降至12.04(CK),7.77(LN),6.57(HN) mg C·kg-1dry soil·d-1,与第7 d相比,降低了44.26%,66.11%,71.95%。和对照相比,60 d后低氮与高氮处理下土壤有机碳矿化速率分别降低了35.47%和45.43%(图1A)。
不同施氮量处理下的土壤累积矿化量也是以第7 d为分界点:在第7 d前,处理间无明显差异;在第7 d后,处理间开始产生显著差异,呈现对照>低氮>高氮(图1-B)。第60 d与第7 d相比,不同施氮量处理下的土壤累积矿化量分别增加了84.26%(CK),80.01%(LN),75.52%(HN)(图1-B)。60 d低氮与高氮处理下的土壤有机碳总矿化量较对照组分别降低了19.04%和27.85%,且高氮显著低于低氮处理下土壤有机碳总矿化量的10.88%(图2)。
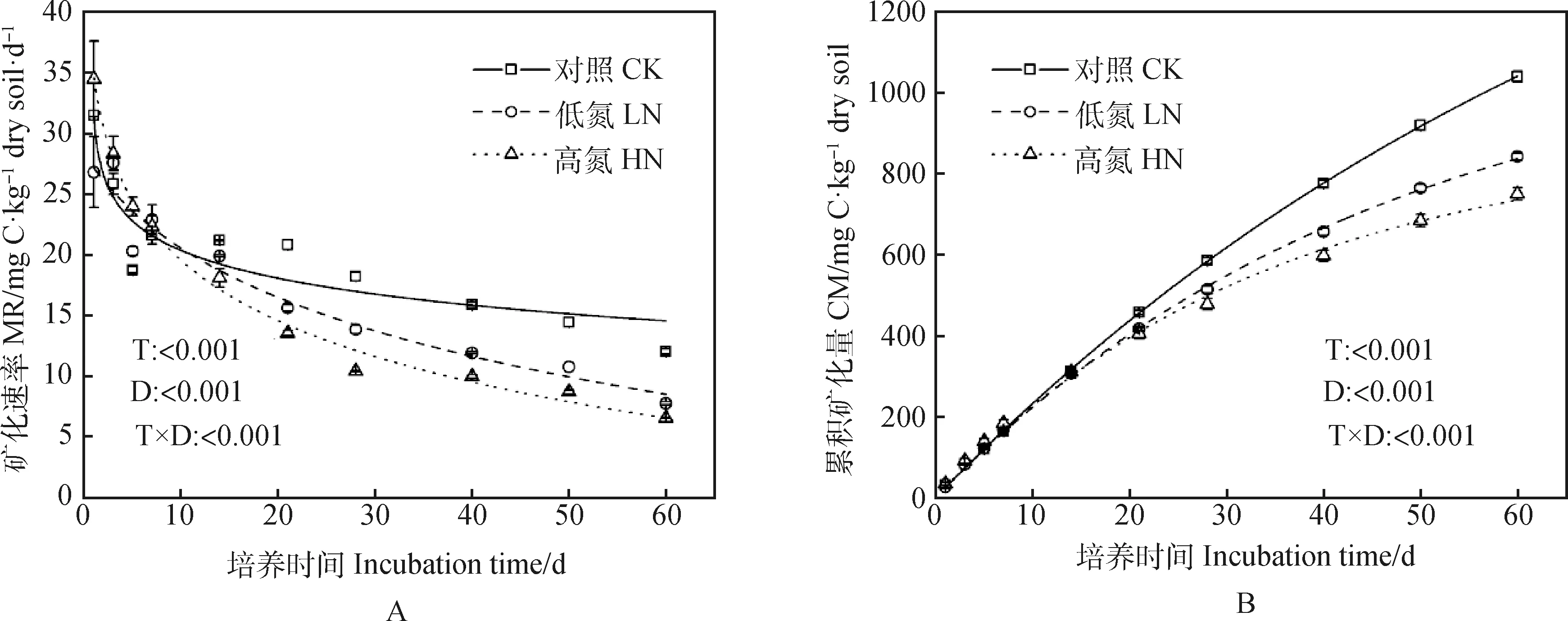
图1 不同施氮量对芒属植物长期定植后的根际土壤有机碳矿化过程的影响
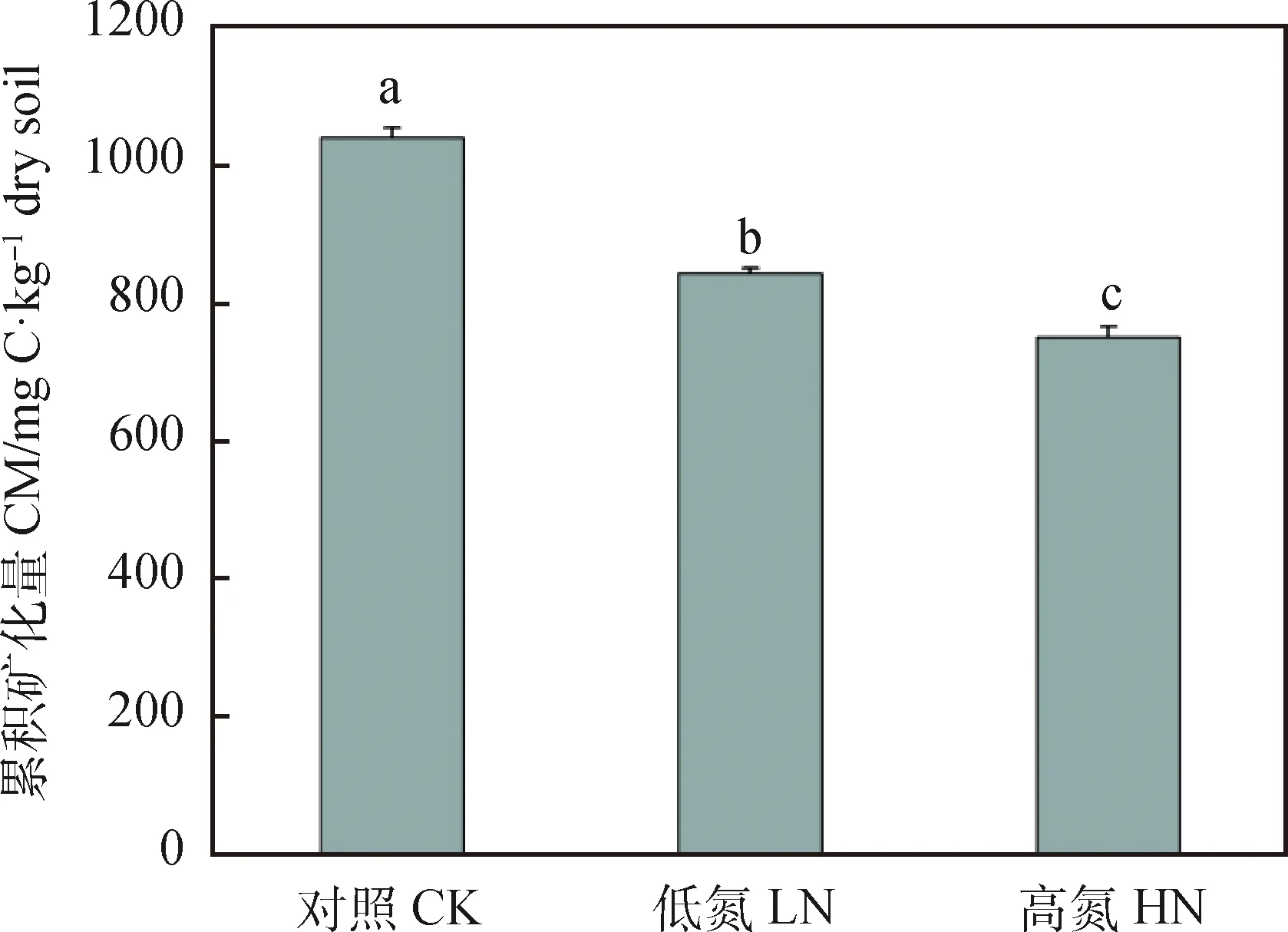
图2 不同施氮量对芒草长期定植后的土壤矿化培养60 d后根际土壤有机碳总矿化量的影响
在试验培养的前7 d,施氮处理下的土壤有机碳呈正激发效应,但在培养的第7 d开始,施氮处理下的土壤有机碳矿化呈显著的负激发效应。大体上施氮对土壤固碳呈正作用,随着施氮量的增加,激发和相对激发相应均会显著降低(P<0.01)(图3)。60 d后低氮与高氮处理下的土壤有机碳激发效应分别降至为-42.67和-54.67 mg C·kg-1dry soil,相对激发效应分别降至-35.44%和-45.40%。其一级反应方程土壤有机碳矿化量速率、累积矿化量、激发效应、相对激发效应的均方根误差(Root mean square error,RMSE)与拟合度(R-squared,R2)如表1所示。其中,土壤有机碳矿化速率均方根误差的值为0.752 1~1.950 6,说明该组实测值的离散程度较低;土壤有机碳累积矿化量的R2的值为0.996 2~0.999 8,约近于1,说明一级反应方程对累积矿化量实测值的拟合程度好。

表1 土壤有机碳矿化量速率、累积矿化量、激发效应、相对激发效应拟合方程的均方根误差与拟合度
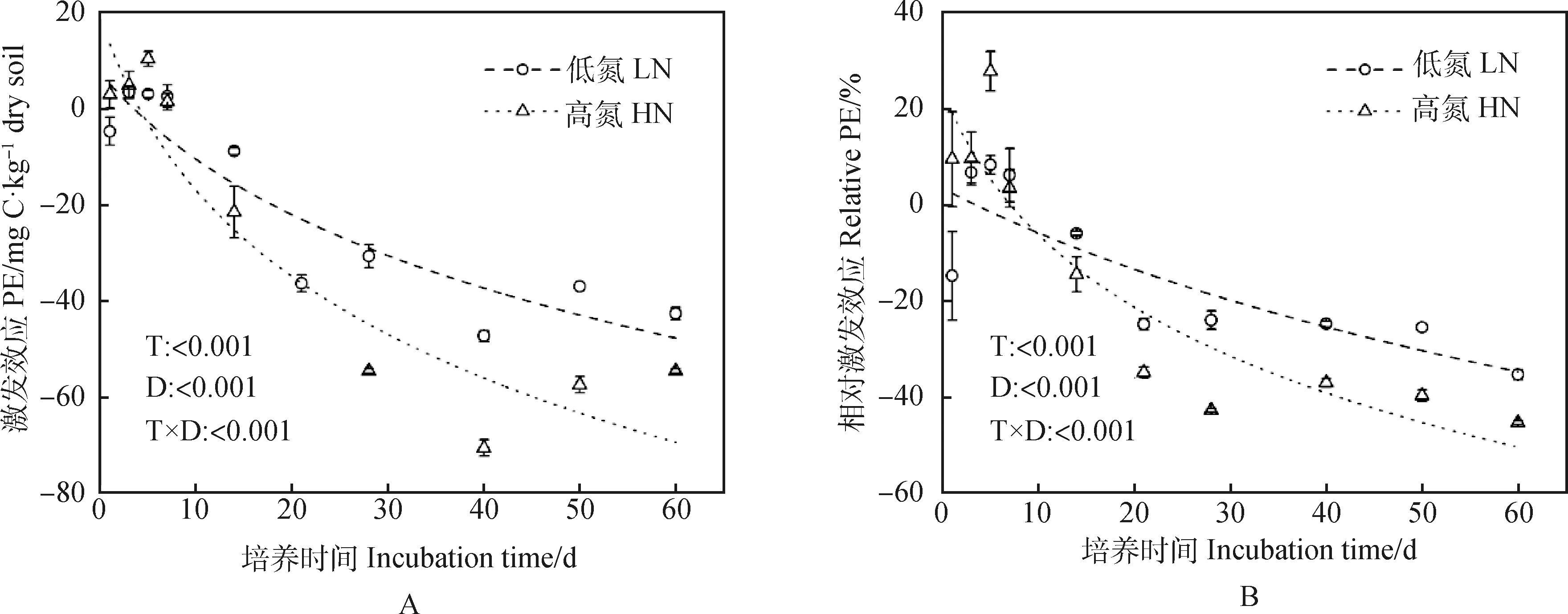
图3 高氮和低氮处理对芒属植物长期定植后的根际土壤有机碳矿化过程的影响
2.2 不同施氮量处理对矿化培养土壤理化性质的影响
不同施氮量处理下矿化培养后土壤理化性质差异如表2所示。施氮对土壤微生物生物量与微生物生物量氮的比值(MB/MBN)无显著影响,但对土壤pH值、总氮(TN)、总有机碳(TOC)、可溶性有机碳(DOC)、可溶性有机氮(DON)、可溶性有机碳与可溶性有机氮的比值(DOC/DON)、微生物生物量(MB)、微生物生物量氮(MBN)、铵态氮(NH4+-N)、硝态氮(NO3--N)以及微生物代谢熵(qCO2)有显著影响(P<0.05)。随着施氮量的增加,土壤pH值、DOC、qCO2呈现下降趋势,减幅分别为10.46%~14.07%,63.00%~68.36%,38.21%~46.44%。土壤TOC在低氮与高氮处理下无显著差异,但与对照处理下的土壤有显著差异(P<0.05);土壤TN与DOC/DON在对照与低氮处理下无显著差异,但与高氮处理下的土壤具显著差异,其中高氮组TN增加,DOC/DON下降。相较于对照组,土壤DON与NO3--N在低氮处理下显著降低,高氮处理下显著上升。不同施氮量处理下土壤MB,MBN与NH4+-N均显著上升,且在低氮水平达到最高值,分别为272.62 mg·kg-1,42.59 mg·kg-1和33.14 mg·kg-1。
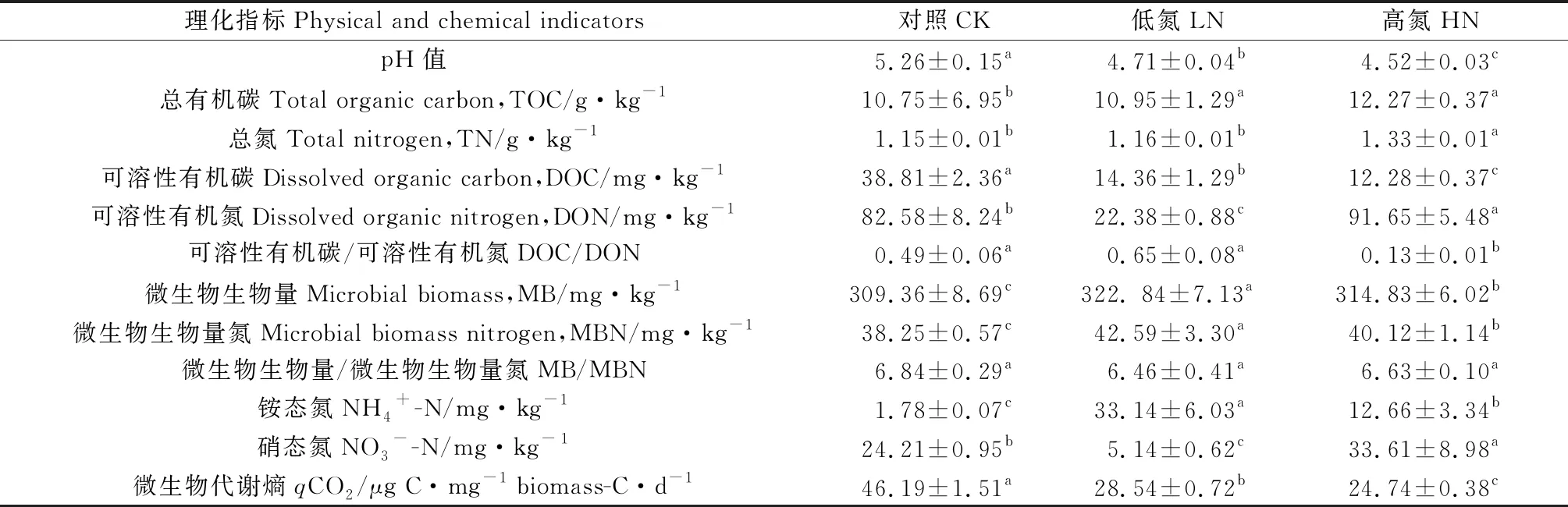
表2 不同施氮量对长期定植芒草根际土壤矿化培养后(60 d)理化性质的影响
分析不同施氮量处理下土壤理化指标及有机碳总矿化量之间的相关性发现(表3),供试土壤有机碳总矿化量(TM)与土壤pH值、总氮(TN)、可溶性有机碳(DOC)、微生物代谢熵(qCO2)之间均存在着极显著正相关性关系(P<0.01),且作线性拟合得出最佳理论曲线及方程(图4),拟合度为0.82~0.91;而与可溶性有机氮(DON)、可溶性有机碳与可溶性有机氮的比值(DOC/DON)、微生物生物量(MB)、微生物生物量氮(MBN)、铵态氮(NH4+-N)、硝态氮(NO3--N)之间无显著相关性关系。土壤NH4+-N与NO3--N之间存在着显著负相关性关系(P<0.05),而土壤DOC,DON,MBN之间均无显著相关性关系,其中的土壤NH4+-N与DOC,DON,MBN之间呈现显著负相关(P<0.05),土壤NO3--N与DON之间呈现显著负相关(P<0.05)。
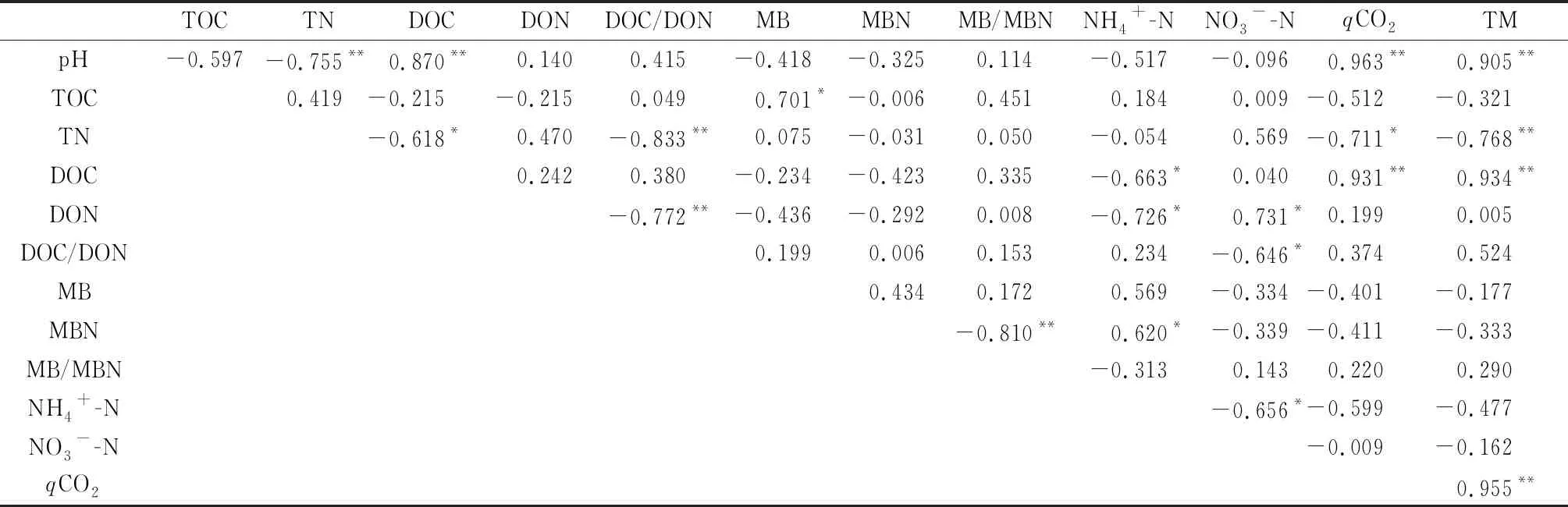
表3 土壤理化性质之间、土壤有机碳总矿化量与土壤理化性质的相关性
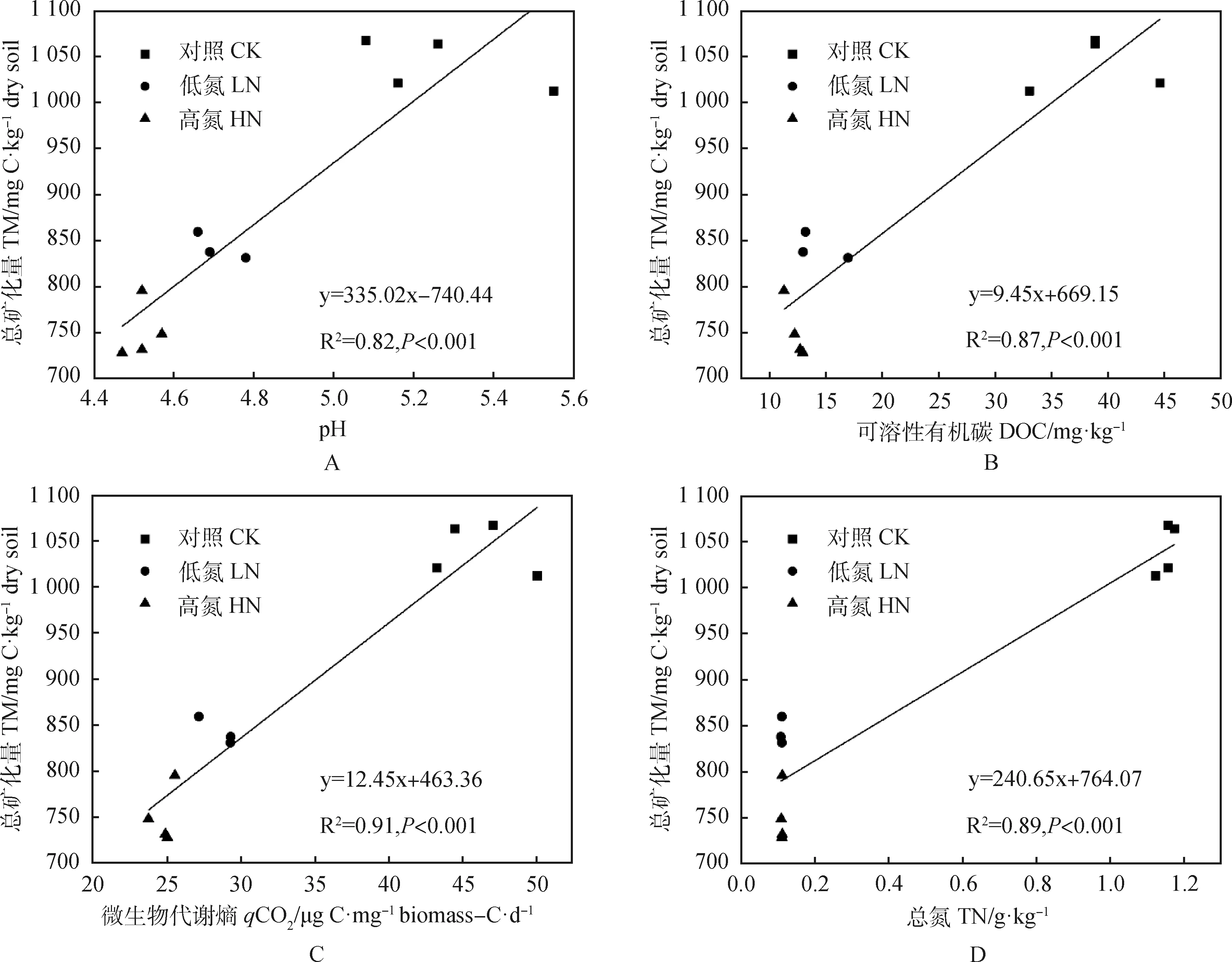
图4 土壤有机碳总矿化量与土壤pH值、可溶性有机碳、微生物代谢熵、总氮的并置拟合图
3 讨论
本论文研究施氮对芒草修复后的贫瘠红壤土壤矿化过程的影响,发现在试验培养第1—5 d,高氮处理下的土壤有机碳矿化速率高于低氮处理2.72%~28.59%,且呈正激发效应,但在培养的第7 d开始,高氮处理下的土壤有机碳矿化速率低于低氮处理2.54%~24.76%,呈显著的负激发效应。与对照组相比,60 d低氮与高氮处理下土壤有机碳矿化速率分别降低了35.47%和45.43%,土壤有机碳累积矿化量分别降低了19.04%和27.85%。可能是由于供试根际土壤中氮量受限,培养前期氮素处理对此起到缓解的作用,短时间内表现为土壤有机碳矿化速率增加,进而施氮对土壤矿化呈正激发效应。随着培养时间的延长,土壤中易被利用的碳被大量消耗的同时,高氮与土壤中易被利用的碳反应也变得结构复杂化不易分解[19],两者共同影响导致土壤中易被利用的碳含量降低,微生物碳源进而受到限制,所以在培养的第7 d后土壤有机碳矿化速率降低,呈现负激发效应。Zang等人对小麦(TriticumaestivumL.)根际土进行不同施氮量处理培养56 d后,土壤有机碳累积矿化量与对照(不加氮)相比下降了27%~42%,和本研究结果趋势一致[14]。但其他研究也有发现施氮对土壤矿化会出现促进、抑制和无影响三种情况。对此差异,Zang等人分析了13项研究中施氮对土壤激发效应的影响,包括158项不同土壤类型和利用方式的试验结果,表明大多数研究发现激发效应随施氮量的升高而呈指数下降[14]。除此之外,也有研究认为施氮或会降低了酸性土壤pH值[20-21]、qCO2,从而改变了土壤理化性质,使土壤微生物呼吸速率降低[22],抑制土壤有机碳的矿化。综上所述,在芒草改良后的土壤进行农业生产活动时,依然需要严格控制施氮量,以维持改良后的土壤质量。
土壤理化性质是体现土壤综合质量的重要指标[23]。本研究以氯化铵作氮素对土壤进行处理,土壤pH值随施氮量的增加而降低,这与前人的研究结果一致[24-25]。铵态氮可溶解在土壤溶液中,供植物直接吸收利用;也可被土壤胶体吸附呈交换态,通过硝化作用转化为硝态氮并释放出H+。与此同时,植物吸收NH4+的同时释放H+以维持体内的电荷平衡,从而酸化土壤[26]。可溶性有机碳(DOC)是土壤微生物最容易利用的碳源,微生物代谢熵(qCO2)是指每单位微生物CO2排放速率,两者均随施氮量的增加而降低。说明微生物从土壤中吸收的有机碳更多用于其自身的生长发育,而不是转化为CO2排放[14]。
不同施氮量处理下土壤微生物生物量(MB)、微生物生物量氮(MBN)均显著上升,且在低氮水平达到最高值,分别为272.62 mg·kg-1,42.59 mg·kg-1,比高氮处理高2.54%,6.16%,而MB/MBN无显著差异。和对照组相比,低氮处理中的MB,MBN含量上升,结果与前人研究相似[27]。朱灵等[27]认为这是由于在土壤本身氮素亏缺情况下,通过一定量的氮投入,使原本受氮素限制的土壤微生物含量与活性上升,因而使土壤MB,MBN含量在一定范围内上升。本研究中,高氮处理下MB,MBN含量明显降低,这是由于土壤中氮含量超过一定范围后,造成土壤酸化和土壤团聚体结构改变[28-29],进而改变土壤微生物的生长环境,阻碍施氮对土壤MB,MBN的正激发效应。
目前关于施氮对土壤有机碳矿化影响的研究,其设定的最高施氮量为208 mg N·kg-1soil,暂未发现其氮阈值[14]。猜想若施氮量达到阈值的基础上,再添加施氮量,其土壤有机碳矿化量为一定值,不再随着施氮量的变化而变化,但仍需要更加详细的试验进行验证。
4 结论
施氮显著降低了芒草改良后贫瘠红壤土壤有机碳矿化量且随着施氮量的升高而降低,呈现负激发效应;施氮通过降低土壤pH值、土壤可溶性有机碳来抑制土壤有机碳矿化过程。随着人为添加氮素的持续增加,修复后的边际贫瘠红壤有机碳的矿化作用会受到抑制,有利于土壤有机碳的稳定与积累。但对于改良修复后的贫瘠红壤田间管理,施加少量氮肥更能丰富土壤微生物生物量,有利于作物生长;而施加大量氮肥反而导致土壤酸化,不利于耕作。
