EDTA体内络合减低223Ra胃肠道辐射损伤的初步实验动物研究
2022-04-24李丹妮李潇杨剑贾国荣彭烨左长京
李丹妮 李潇 杨剑 贾国荣 彭烨 左长京
(上海长海医院核医学科 上海 200433)
肿瘤骨转移,尤其是前列腺癌骨转移给肿瘤晚期病人带来巨大痛苦[1]。223RaCl2(Xofigo®)注射液利用Ra2+离子与Ca2+离子类似的体内生化性质实现在骨转移病灶的特异性沉积[2],通过α内照射减轻成骨性骨转移病人的骨痛,具有良好的临床价值。除聚集于骨骼部分之外,223RaCl2主要以粪便形式经肠道 排 出 体 外(50%~60%)[3]。临 床 实 践 表 明,在223RaCl2注射4 h后,有约49%的核素存在于肠道当中[4],加之前列腺癌患者整体年龄偏大且身体机能退化,往往需要长达数天时间才能通过消化系统排泄清除[5]。由于223Ra发射高能量α射线,当其进入消化系统后,容易对脏器造成辐射损伤,引起恶心、腹泻、呕吐、外周水肿等副作用,甚至有可能造成不可逆转的内照射损伤。因此,促进非特异性的消化系统223Ra清除,降低治疗产生的副作用具有迫切的临床需求。乙二胺四乙酸(Ethylenediaminetetraacetic Acid,EDTA)作为优良的金属螯合物,对于含镭在内的多种金属具有明确的络合效能,络合后可形成一种水溶性复合物,通过泌尿系统排出[6]。
本研究拟利用223Ra容易与EDTA络合的化学性质,通过体内络合改变Ra2+体内清除机制,建立清除胃肠道中游离223Ra的快速排毒方式。
1 材料与方法
1.1 材料
223RaCl2(Xofigo®)购于中国同辐股份有限公司,乙二胺四乙酸(分析纯)购于Greagent公司。
1.2 实验动物
实验动物购置于维通利华,并在清洁级环境长期饲养。研究符合海军军医大学第一附属医院伦理委员会要求。考虑到223RaCl2的应用场景(前列腺癌骨转移),本研究采用10月龄、体重在400 g左右的雄性大龄Wistar大鼠作为研究对象。研究期间实验动物维持正常饮食及12 h/12 h的正常光照并单只分笼饲养。图像采集期间,动物按照1.5 mL·kg-1体重给予3%戊巴比妥钠进行腹腔麻醉,麻醉时间维持在60~90 min。
1.3 给药方式
223RaCl2注射:将223RaCl2(Xofigo®)注射液按照10倍于临床用量(220 kBq(200µL/只))的方式进行尾静脉给药,注射时严格防止药物进入皮下或者渗出导致辐射损伤或给药量不够。
EDTA静脉注射:将EDTA配制成饱和溶液(0.5 mg·mL-1)后,按照1 mg·kg-1体重经尾静脉注射EDTA。
EDTA灌胃给药:将EDTA饱和溶液采用灌胃针在大鼠清醒状态下经口按照10 mg·kg-1体重灌注EDTA。
1.4 SPECT/CT扫描
Wistar大鼠随机分为4组,包括空白组(注射223RaCl2)、EDTA灌胃组(注射223RaCl2加灌胃)、EDTA静注组(注射223RaCl2加静注EDTA)、对照组(注射223RaCl2加注射生理盐水),每组3只。对于223RaCl2在大鼠的体内分布研究,采集注射223RaCl2后2 h、5 h、12 h、24 h、48 h和72 h的SPECT/CT断层图像。对于EDTA干预223RaCl2方式的对比研究,采集注射223RaCl2注射液12 h后,再经EDTA尾静脉或灌胃给药后1 h的SPECT/CT断层图像。对于223RaCl2注射后经尾静脉给EDTA的优化研究,采集注射223RaCl2注射液2 h后经尾静脉EDTA给药30 min、75 min、2.5 h、4 h和6 h的单光子发射计算机断层成像术(Single-Photon Emission Computed Tomography,SPECT)/电 子 计 算 机 断 层 扫 描(Computed Tomography,CT)断层图像。核医学图像使用德国西门子Symbia T16型SPECT/CT进行采集,具体扫描方式如下:
SPECT采集使用高能通用型准直器,选取223Ra衰变过程中的三种特征能峰进行采集,能峰分别是85 keV、154 keV和270 keV,窗宽分别是20%、20%和15%,矩阵128×128,放大倍数1.45,双探头顺时针旋转180°采集32帧,每帧75 s;CT参数:电压130 keV,电流35 mAs,重建层厚1 mm。重建获得SPECT与CT同机融合图像。
3D融合图是运用CT容积重建技术与SPECT断层图像的融合,具体方法:加载CT数据到3D视图,选择SPECT断层融合数据后选择3D Fusion卡片进行融合,进入Free View界面进行3D融合图像加载,运用VOI Punch Mode对多余图像进行切割。
对于感兴趣区的定量分析运用Volumetric Activity软件,加载CT与SPECT断层融合图,选择Multi-frame Polygon模式进行多层面勾画感兴趣体积(Volume of Interest,VOIs),获得感兴趣区的放射性总计数。对于骨摄取,选取不受腹部图像干扰的肋骨与胸椎对应位置逐层勾画胸1~胸12锥体并融合为VOI;对于肠道和膀胱,选取腹部根据解剖结构逐层进行ROI勾画并融合为VOI。
1.5 统计分析
肠道辐射累积量和泌尿系统排泄量评估通过绘制肠道和膀胱摄取剂量与时间的变化曲线,并计算曲线下面积进行EDTA干预前后的对比分析。统计分析采用SPSS 19.0进行,单组数据采用不少于三重复样本,组间差异由paired t-test判断其显著性,p<0.05为显著性差异。图表由Origin 8绘制。
2 结果
相较于人的代谢速率,大鼠更快地完成223RaCl2的血液清除、体内分布、代谢及全身清除(图1)。在药物注射后24 h,胃肠道及膀胱未见明显的放射性富集,223Ra主要富集于头部骨骼、脊柱及四肢关节处。
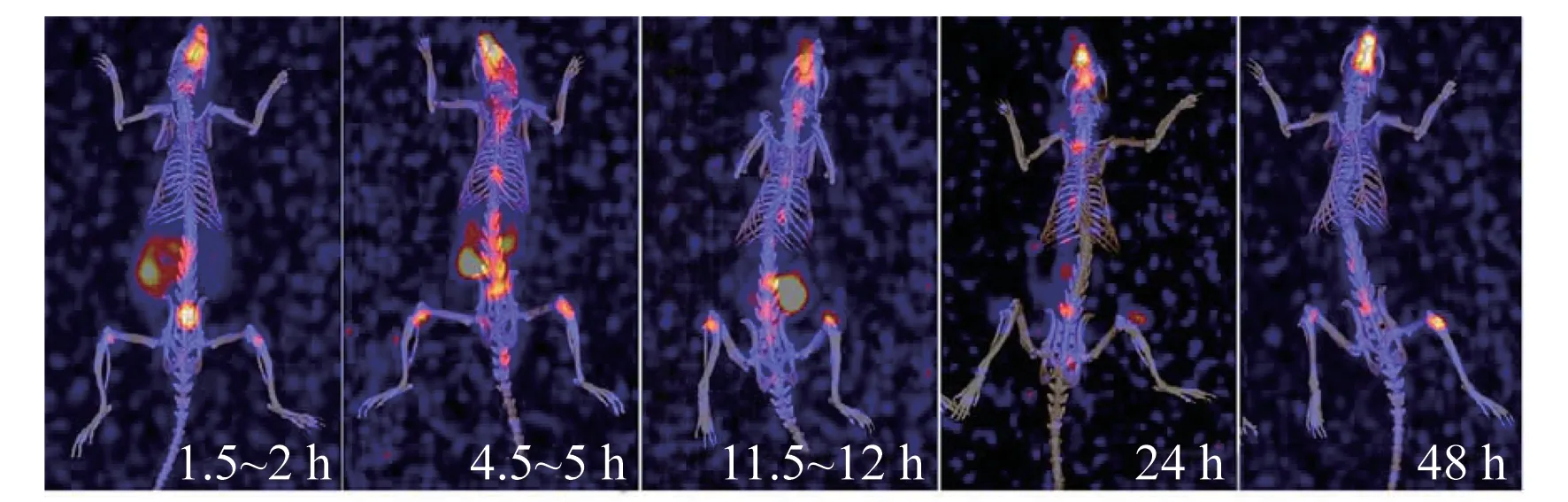
图1 大鼠静脉注射223RaCl2注射液后的剂量动态分布图(3D SPECT/CT重建图,骨窗)Fig.1 Dynamic distribution of radioactive dose in rats after intravenous administration of 223RaCl2 injection(representative 3D-reconstruction SPECT/CT images,bone window)
大鼠骨(胸椎1~胸椎12)的放射性摄取总计数在223RaCl2药物注射后2 h,已达峰值的86.3%(图2),注射后12 h达到该部位总计数的峰值(1 405±21)。到达摄取峰值后的计数随时间降低符合223Ra的衰变规律(t1/2=11.4 d)和骨沉积以后“只衰变不清除”的特征。后续研究将223RaCl2注射后12 h(骨摄取的峰值)或者2 h(骨摄取峰值的86.3%)作为EDTA介入的起始时间点。
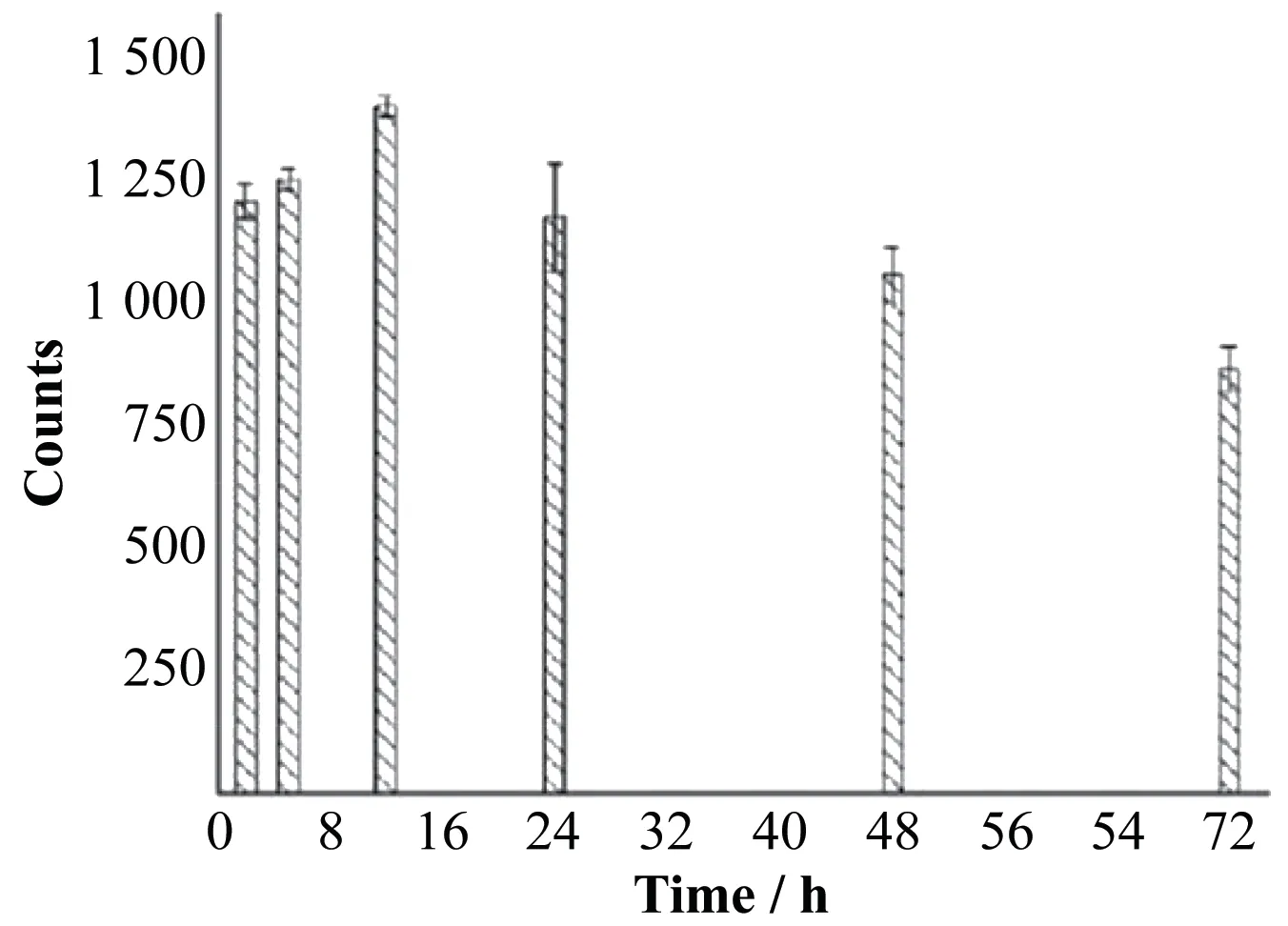
图2 大鼠代表性骨摄取灶(胸1~胸12锥体)摄取223Ra的放射性总计数随时间的动态改变Fig.2 Dynamic changes of the total radioactive counts of223Ra uptake in representative bone uptake foci(T1 to T12 vertebral bodies)in rats over time
灌胃和静脉注射EDTA对于223RaCl2的体内代谢清除方式有明显的影响。如图3所示,223RaCl2注射12 h后行EDTA灌胃,灌胃后1 h可见223Ra在胃部的二次富集(图3(a)),而静脉注射EDTA未引起胃部的二次富集(图3(c))。EDTA的两种给药途径对于223Ra经肠道的代谢方式未引起明显区别,但是两种方式都引起肠道223Ra的局部增高。上述结果证明EDTA可以明显改变早期223Ra的胃肠道清除过程,静脉注射更有利于胃肠道的保护。
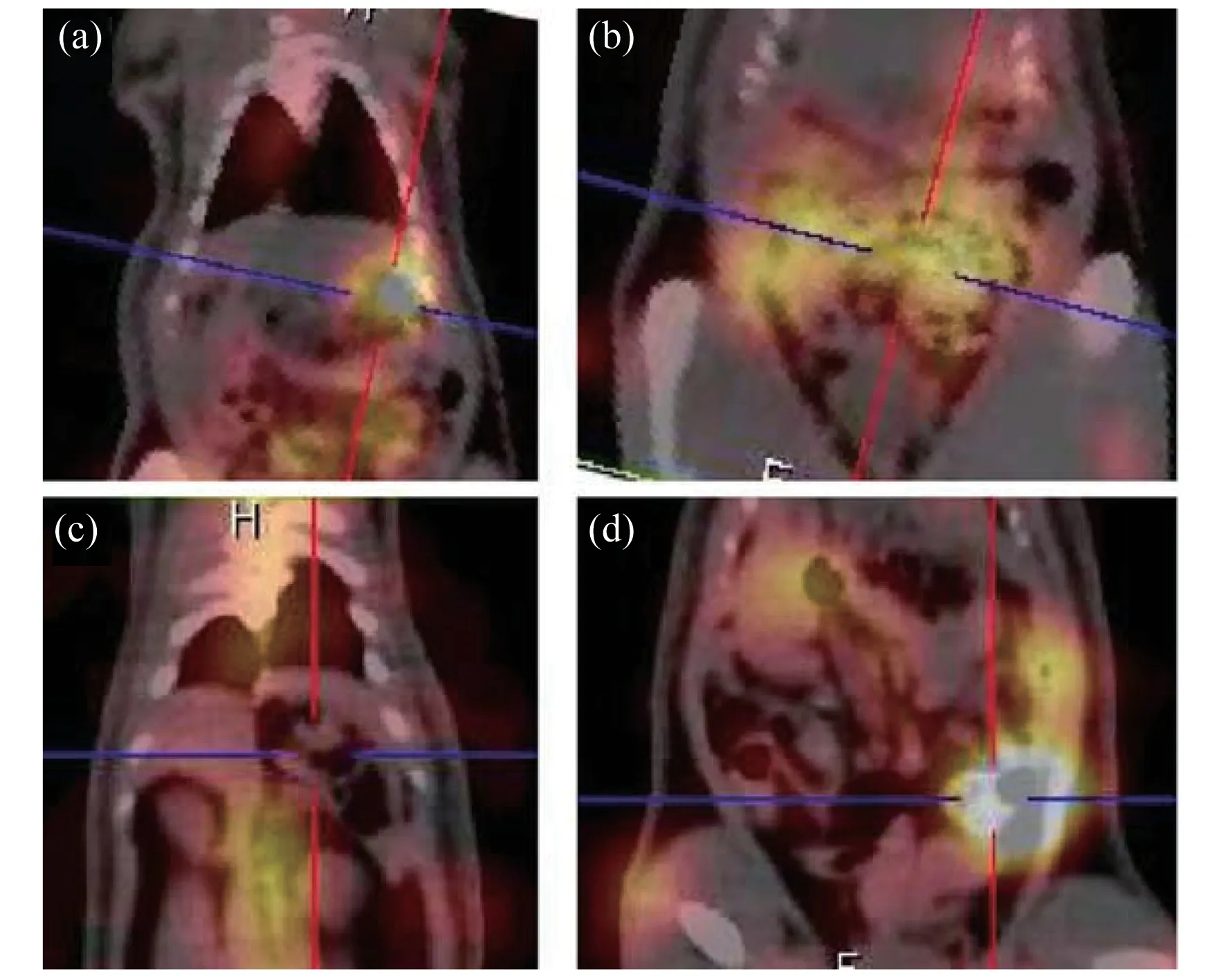
图3 EDTA在体干预223Ra代谢方式对比的典型SPECT/CT断层显像EDTA灌胃后1 h的胃部冠状位(a)及肠道冠状位(b),可见胃部的223Ra富集(十字定位区),经尾静脉注射EDTA后1 h的胃部冠状位(c)及肠道冠状位(d)Fig.3 Typical SPECT/CT tomographic imaging of EDTA intervening in 223Ra metabolism in vivo.Coronal image of stomach(a)and intestine(b)1 h after EDTA gavage,showing the enrichment of 223Ra in the stomach(cross-localized area),coronal image of stomach(c)and intestine(d)1 h after EDTA injection via tail vein
静脉注射EDTA或生理盐水对223Ra的动态分布对比如图4所见,为充分降低胃肠道所受辐射,静脉注射EDTA干预的时间提前到223RaCl2注射后2 h(223Ra骨沉积已完成86.3%)。在骨摄取未受影响的前提下,EDTA可导致肠道223Ra的快速清除,而对照组生理盐水则未对223Ra的肠道清除产生明显的促进作用。
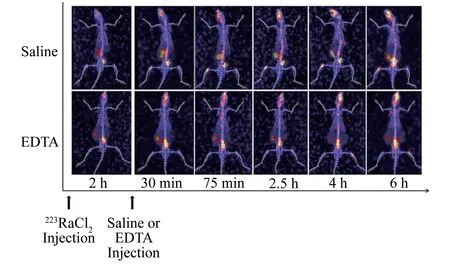
图4 静脉注射EDTA对223Ra的动态分布对比图(3D SPECT/CT重建图,骨窗),上排为静脉注射生理盐水后的动态显像,下排为静脉注射EDTA后的动态显像Fig.4 Dynamic distribution of 223Ra in rats after injection of saline(top panel)or EDTA(bottom panel)(representative 3DSPECT/CT reconstruction images,bone window)
EDTA干预对骨(胸椎椎体)摄取的影响和对肠道的保护作用,以及EDTA络合游离223Ra后的代谢清除由图5定量分析结果所示。EDTA静脉注射(设定为0 h)后,特定骨骼的摄取仍在上升(图5(a)),与对照组没有显著性差异。此时,由于EDTA的络合作用,血液中的223Ra优先被络合并排出,所以肠道中的223Ra未继续上升(图5(b));EDTA络合肠道组织中的223Ra,改变代谢方式,经泌尿系统代谢排出(图5(c))。相比之下,对照组的223Ra继续在肠道富集,在75 min达到峰值并随后开始逐渐代谢清除。在EDTA给药后6 h的肠道223Ra清除率由(21.3±5.6)%(对照组)提高到(46.9±4.4)%(EDTA干预组),而干预组的6 h内肠道累积辐射剂量较对照组下降了25.1%。

图5 EDTA干预对于骨(胸椎椎体)摄取的影响和对于肠道的保护作用(a)骨的223Ra摄取趋势不变,(b)肠道中223Ra在EDTA作用下迅速下降,(c)膀胱中223Ra在EDTA作用下迅速累积Fig.5 Effect of EDTA intervention on bone(thoracic vertebrae)uptake and protective effect on the gut(a)The trend of bone uptake of 223Ra remained unchanged,(b)223Ra in the intestine decreased rapidly with EDTAintervention,(c)The bladder demonstrated relatively high radioactive accumulation
3 讨论
由于第二主族元素,尤其是Ca、Sr、Ba、Ra相似的元素化学性质和接近的离子半径,上述4种元素在体内的分布情况基本相似[7]。与Ca2+的体内骨沉积性质相似,核医学治疗应用较广的89Sr作用于肿瘤骨痛的治疗已经具有多年的临床应用,并取得了较好的临床效果[8]。223Ra2+也被用于肿瘤骨转移的治疗,同时,由于223Ra衰变过程中产生少量的β和γ衰变,使得该核素的检测方式较89Sr更为丰富,尤其是γ射线可以用于单光子成像,对于223RaCl2给药后药物的病灶沉积和沉积强度、时长有更为精准的把控。SPECT显像提示,较大比例的肠道富集和较慢的清除速率是引起223RaCl2给药后副作用的主要原因。
EDTA作为优良的金属离子络合剂,对于含镭在内的多种金属具有明确已知的络合效能,例如0.01 mol·L-1的EDTA溶液被推荐用于223RaCl2的除污剂[9]。EDTA已经作为排毒试剂用于重金属中毒后的体内络合[10],说明EDTA具有在体络合Ra2+的潜能。同时,由于已经完成骨沉积的Ra2+与骨骼中的羟基磷灰石形成复合物,则不会被EDTA带出体外。由于EDTA是由肾脏排泄,因此患有活动性肾脏疾病以及少尿或无尿的患者应禁用。
本研究选用10月龄的成年大龄雄性大鼠,便于模拟潜在的中老年病患胃肠道代谢减慢的特征。本研究证实EDTA灌胃可以导致游离Ra2+在胃部的富集,但是较大的α核素浓度不利于减轻消化道副作用,因此选择静脉方式,在体结合Ra2+进行体内排毒具有更高的推广价值。本研究选择大鼠223RaCl2给药后2 h按照1 mg·kg-1体重静脉注射EDTA干预的方案,用量远低于小鼠静脉给药半数致死剂量(250 mg·kg-1)[11]。在较早的时间进行干预有效降低非靶器官辐射累积剂量的同时,未对骨沉积产生影响,具有一定的借鉴价值。由于大鼠整体上较人的代谢清除速率更快,因此本研究中的EDTA给药时间和给药方式有待结合人体相关代谢特征进一步优化。
作者贡献声明李丹妮、李潇:负责研究设计、解释分析数据及论文撰写;杨剑、贾国荣:负责动物研究及成像采集;彭烨、左长京:负责实验技术指导和监督。
