LPM3480226联合索拉菲尼抗小鼠肾癌Renca
2022-04-24李晓鹏刘塑杰杜广营田京伟
郑 爽,李晓鹏,刘塑杰,杜广营,田京伟
(烟台大学药学院,烟台大学新型制剂与生物技术药物研究山东省高校协同创新中心,烟台大学分子药理和药物评价教育部重点实验室,山东 烟台 264005)
吲哚胺2,3-双加氧酶(Indoleamine 2,3-dioxygenase, IDO, EC 1.13.11.42)催化必需氨基酸色氨酸(Trp)降解途径中的起始和限速步骤,表达于抗原呈递细胞(APC)、血管内皮细胞和肿瘤细胞,与肿瘤免疫耐受密切相关,可通过多种途径介导肿瘤免疫逃逸[1]。近年发现,免疫调节功能并非IDO的唯一功能,其在肿瘤的侵袭、转移和血管生成中亦发挥重要作用。多项研究表明IDO可诱导肿瘤血管生成,发挥非免疫作用[2-5]。肿瘤与非恶性组织相比,其血管结构和功能异常,可通过破坏灌注促进肿瘤进展,进而导致肿瘤缺氧和肿瘤内pH值低,也会限制免疫细胞从循环进入肿瘤发挥抗肿瘤活性[6-7]。
临床前研究结果提示,IDO抑制剂单用的肿瘤杀伤活性较弱,抑制率在30%~50%[8]。肿瘤免疫治疗的效果依赖于肿瘤微环境(TME)内免疫效应细胞的积累和活性,通过抑制肿瘤血管新生改善肿瘤血管功能和建立免疫支持的肿瘤微环境,可能提高肿瘤免疫治疗的有效性并降低免疫相关不良反应。鉴于IDO肿瘤新生血管之间的关系,推测IDO抑制剂与抗血管形成药物联用可协同抑制肿瘤血管新生和改善肿瘤免疫微环境,发挥更好的抗肿瘤作用。
索拉菲尼是一种口服多靶点激酶抑制剂,同时阻断RAF/MEK/ERK途径,可有效抑制肿瘤生长和血管生成,已获FDA批准用于治疗肝细胞癌和肾细胞癌[9]。LPM3480226是山东绿叶制药有限公司开发的小分子IDO抑制剂,结构如图1所示,目前正在中国开展临床一期试验,注册登记号为CTR20182328。
本研究以小鼠肾癌Renca荷瘤小鼠为模型,考察IDO抑制剂LPM3480226联合索拉菲尼的抗肿瘤作用,为IDO抑制剂的开发以及临床研究方案提供理论基础和依据。

图1 LPM3480226的化学结构
1 实验材料
1.1 细胞株与实验动物
小鼠肾癌细胞Renca.WT,由中国科学院典型培养物保藏委员会细胞库提供,培养基为DMEM完全培养基,含10% 胎牛血清、0.25% Trypsin,37 ℃,5% CO2培养。
BALB/c小鼠,雌性,试验开始时,6~7周,体重17.9~21.2 g。购自上海灵畅生物科技有限公司,实验动物合格证编号:2020001828945。SPF级饲养环境,温度20~25 ℃,湿度36%~50%,10~20次/h换气,昼夜明暗交替时间12 h/12 h。所有实验动物相关的实验方案与操作均经过烟台大学实验动物伦理委员会审核及批准。
1.2 供试品与主要试剂
LPM3480226,白色粉末,批号:H21383-029-P1,分子式为:C12H12BrFN6O3S,相对分子质量419.23,15~25 ℃,遮光保存。溶液配制:称取化合物1 344 mg,加入67.2 mL 30% solutol HS 15(37 ℃水浴融化),即得所需浓度溶液,分装4.8 mL/瓶×14瓶,一周内用完。
索拉菲尼(Sorafenib),白色至灰白色固体粉末,CAS:284461-73-0,上海瀚香生物科技有限公司生产,分子式为C21H16ClF3N4O3,相对分子质量464.82,4 ℃密封保存。溶液配制:称取24 mg索拉菲尼,加入2 mL聚氧乙烯蓖麻油和2 mL的95%乙醇,涡旋超声溶解得到4 mL浓度为6 mg/mL的储存液。取1.2 mL储存液加入3.6 mL注射用水涡旋混匀得到4.8 mL 1.5 mg/mL溶液,现用现配,避光存放。
2 实验方法
2.1 Renca荷瘤小鼠制备
收集指数生长期的Renca细胞,PBS重悬至1×107个/mL于小鼠背部皮下接种,制备Renca荷瘤小鼠模型。待肿瘤平均体积达到约100 mm3时,据肿瘤体积随机分组,肿瘤体积为0.5×长径×短径2,其中长径和短径分别指肿瘤的最长直径和最短直径。
2.2 剂量设计
前期药效研究显示,LPM3480226在200 mg/kg剂量下,每天灌胃给药2次(BID),动物体内肿瘤抑制率已达到最大药效水平;索拉菲尼在 15 mg/kg剂量下,每天灌胃给药1次(QD),可有效抑制Renca移植瘤的增殖,抑制率40%~60%。因此,在本研究中LPM3480226的剂量设为200 mg/kg,BID;索拉菲尼的剂量设为15 mg/kg,QD,均灌胃给药。
2.3 实验分组与给药
待肿瘤体积长至约100 mm3,根据肿瘤体积,将24只荷瘤小鼠随机分为4组:对照组,LPM3480226组,索拉菲尼组,LPM3480226+索拉菲尼组,每组6只动物。对照组灌胃给予溶媒30% solutol HS 15,BID;LPM3480226组灌胃给予200 mg/kg的LPM3480226,BID;索拉菲尼组灌胃给予15 mg/kg的索拉菲尼,QD;LPM3480226+索拉菲尼组,灌胃给予200 mg/kg的LPM3480226,BID及15 mg/kg的索拉菲尼,QD。各组给药体积均为10 μL/g。分组当天开始给药,定义为1 d,连续给药19 d。
2.4 观察指标
2.4.1 动物体重及一般状态观察 试验期间,观察肿瘤生长及药物治疗对动物的影响,包括但不限于动物死亡,动物体重,一般精神状态及被毛,摄食和饮水情况。试验结束时,以试验分组时动物体重为基础,计算体重相对变化率。
2.4.2 肿瘤体积 试验期间,每周测量2次各组动物的肿瘤体积。瘤体积测量方法为:游标卡尺测量肿瘤最大直径和最小直径,根据0.5×长径×短径2计算肿瘤体积。根据肿瘤体积绘制肿瘤生长曲线,动态观察药物的抗肿瘤效应。
2.4.3 肿重 试验结束时(第19天),手术剥取动瘤块,快速称重后用于后续其他试验。根据瘤重,计算每组的平均瘤重。相对肿瘤抑制率TGI(%):TGI=1-T/C。T/C为相对肿瘤增值率,即在某一时间点,治疗组和对照组相对肿瘤体积或瘤重的百分比值。T和C分别为治疗组和对照组瘤重。依据瘤重计算LPM3480226和索拉菲尼联用的联合指数(CI)。计算公式为CI=Wcomb/(WLPM3480226×W索拉菲尼),Wcomb、WLPM3480226、W索拉菲尼分别为LPM3480226和索拉菲尼联用组、LPM3480226组、索拉菲尼组的平均瘤重与对照组平均瘤重的比值。CI值<1表示有协同作用,CI值=1表示有相加作用,CI值>1表示有拮抗作用。
2.5 流式细胞技术分析肿瘤浸润淋巴细胞亚群
手术剥离各组动物的肿瘤组织,将肿瘤组织切取1/2用于制备肿瘤浸润T细胞(TILs)。主要操作流程为:用无菌手术剪刀和镊子将肿瘤解离成1~2 mm3小块并转移至50 mL离心管中,每0.25 g肿瘤组织加10 mL消化液(DMEM培养基,0.5 mg/mL胶原酶A,0.2 mg/mL透明质酸酶V,0.02 mg/mL DNA酶I),37 ℃,孵育45 min。消化液经1500 r/min离心10 min,弃上清,培养基重悬后分别过滤网,细胞悬液用DMEM漂洗重悬。采用小鼠淋巴细胞分离液分离上述细胞悬液中的淋巴细胞即得TILs。获得TILs后,随即采用流式细胞术分析技术检测其中淋巴细胞亚群。利用PerCP-Cy5.5标记的Rat Anti-Mouse CD45筛选出淋巴细胞(CD45+),PE-cy7标记的Rat Anti-Mouse CD11b去除淋巴细胞中单核细胞和巨噬细胞(CD45+CD11b+)保留活化淋巴细胞(CD45+CD11b-),APC标记的Rat Anti-Mouse CD3分选出活化淋巴中T淋巴细胞(CD45+CD11b-CD3+),PE标记的Rat Anti-Mouse CD4和FITC标记的Rat Anti-Mouse CD8对T淋巴细胞中CD3+CD4+和CD3+CD8+亚群进行分析。Accuri TM C6 流式细胞仪进行荧光激活细胞分选(FACS)测定和分析。计算CD11b-CD3+CD4+和CD11b-CD3+CD8+细胞在肿瘤浸润淋巴细胞中的绝对比例:CD11b-CD3+CD4+细胞绝对比例=(CD11b-)×(CD3+)×(CD4+),CD11b-CD3+CD8+细胞绝对比例=(CD11b-)×(CD3+)×(CD8+)。
2.6 免疫组织化学分析肿瘤组织CD34-MVD
CD34是一种跨膜糖蛋白,表达于血管内皮细胞、某些干细胞及祖细胞等细胞,是目前肿瘤新生血管评价中特异性较好的标记物,因此本研究选择CD34阳性血管的微血管密度(CD34-MVD)作为肿瘤血管生成水平的替代指标[10]。
取试验中剩余1/2部分肿瘤组织用于免疫组织化学分析。参考文献[11],各组肿瘤组织切片常规脱蜡并抗原修复后,滴加CD34(1∶2000)抗体,4 ℃过夜孵育,DAB免疫组化检测试剂盒处理,苏木素复染,脱水、封片。先于低倍镜(×100)下全面观察切片以确定肿瘤内高血管密度位置,高血管密度区多位于肿瘤边缘。再于高倍镜(×400)下,以肿瘤中CD34阳性内皮细胞或细胞丛作为一个血管,结构不相连的分支结构也作为一个血管计数。记录5个视野内的微血管数,取其平均数作为该切片CD34-MVD值。
2.7 统计分析
3 实验结果
3.1 荷瘤小鼠动物体重和一般状态
试验期间,各组动物均未出现死亡或濒死,动物一般精神状态、被毛、摄食和饮水正常。体重统计结果如图2所示,与对照组相比较,LPM3480226组、索拉菲尼组及LPM3480226和索拉菲尼联用组的动物平均体重在各时间点均无显著改变(P>0.05),表明LPM3480226与索拉菲尼联用没有增加动物体重降低的毒性作用。


图2 LPM3480226联用索拉菲尼对Renca荷瘤小鼠体重的影响
3.2 肿瘤体积
肿瘤生长曲线如图3所示,LPM3480226和索拉菲尼单用或联用均可显著抑制肿瘤生长。LPM3480226组在给药后第13天开始平均肿瘤体积显著小于对照组(P<0.05),索拉菲尼组和LPM3480226+索拉菲尼组均在给药后第7天开始肿瘤体积显著小于对照组(P<0.05)。在实验后期(第13~19天)LPM3480226+索拉菲尼的平均肿瘤体积小于LPM3480226和索拉菲尼单用组(P<0.05)。上述结果显示,LPM3480226和索拉菲尼联用时对肿瘤生长的抑制作用优于药物单用。
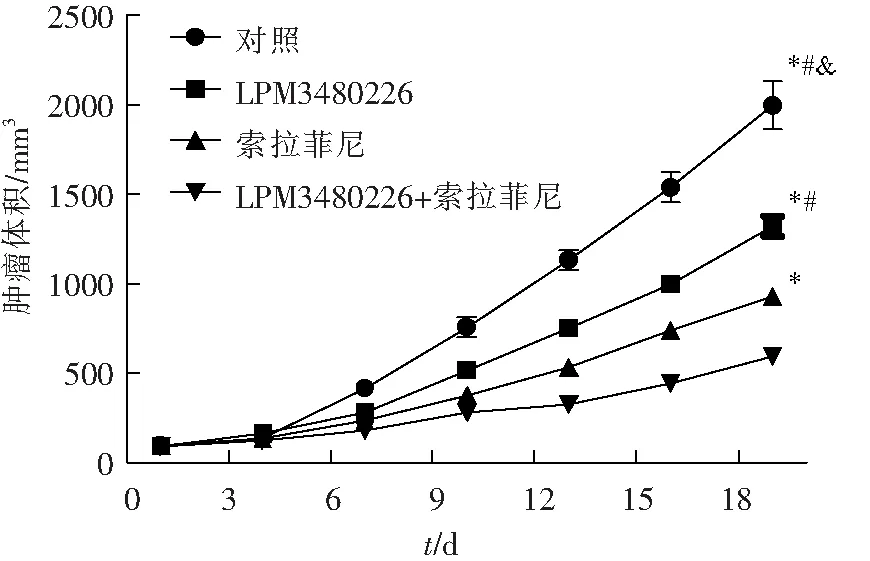
与对照组比较;#P<0.05,与LPM3480226组比较;&P<0.05,与索拉菲尼组比较。
3.3 肿瘤重量及抑制率
实验结束时,各组肿瘤平均重量如图4所示。LPM3480226组,索拉菲尼组,LPM3480226与索拉菲尼联用组的平均肿瘤重量均显著小于对照组(P<0.05),计算得肿瘤抑制率分别为32.56%,50.45%,71.92%。LPM3480226与索拉菲尼组平均肿瘤重量显著小于LPM3480226组和索拉菲尼组(P<0.05),索拉菲尼组肿瘤重量显著小于LPM3480226组(P<0.05)。根据肿瘤平均重量计算LPM3480226和索拉菲尼联用的CI值为0.41,其小于1,且联用组肿瘤重量显著亦小于单用组,提示LPM3480226和索拉菲尼联用具有一定协同效应。

与对照组比较,#P<0.05,与LPM3480226组比较;&P<0.05,与索拉菲尼组比较。
3.4 肿瘤浸润淋巴细胞亚群
利用流式细胞分析技术对肿瘤浸润淋巴细胞的亚群进行分析,结果如图5所示,LPM3480226的CD3+CD4+、CD3+CD8+细胞百分比均显著高于对照组(P<0.05);索拉菲尼组的CD3+CD4+和CD3+CD8+细胞百分比均略高于对照组,但无统计学差异;LPM3480226+索拉菲尼组的CD3+CD4+和CD3+CD8+细胞百分比均既显著高于对照组(P<0.05),又显著高于LPM3480226单用组(P<0.05)。上述结果提示,LPM3480226和索拉菲尼联用可协同激活肿瘤免疫,提高CD3+CD4+和CD3+CD8+T细胞比例。
3.5 肿瘤组织CD34-MVD水平
利用免疫组化对肿瘤组织CD34-MVD水平进行分析,结果如图6所示,LPM3480226组,索拉菲尼组于对照组(P<0.05),又显著低于LPM3480226单用组(P<0.05)。上述结果提示,LPM3480226和索拉菲尼联用可协同抑制肿瘤血管生成。
4 讨论与结论
临床前研究结果显示,IDO抑制剂单用时的抗肿瘤作用较弱,且IDO与肿瘤血管新生密切相关,因此,将IDO抑制剂与抗血管生成药物联合使用有可能提高临床治疗效果。本研究结果显示,LPM3480226与索拉菲尼联用未增加不良反应(体重未降低),表明动物对于LPM3480226与索拉菲尼的联合治疗有良好的耐受性。药效方面,LPM3480226与索拉菲尼联用组的平均肿瘤重量显著小于对照组,抑制率显著提高,达到71.92%,而LPM3480226与索拉菲尼单用组的抑制率较低,分别为32.56%和50.45%,且根据肿瘤平均重量计算LPM3480226和索拉菲尼联用的联合指数小于1,且联用组肿瘤重量显著亦小于单用组,表明LPM3480226和索拉菲尼联用具有一定协同效应。
机制研究发现,LPM3480226联合索拉菲尼可以显著增加肿瘤内CD3+CD4+和CD3+CD8+浸润T淋巴细胞的比例,推测可能的机制为:索拉菲尼抑制血管生成,破坏了肿瘤内血管组织结构,增加了T淋巴细胞的浸润;同时索拉菲尼可诱导肿瘤细胞凋亡,释放更多肿瘤抗原,可与LPM3480226协同激活T细胞应答。本实验室另有研究表明,肿瘤细胞分泌的IDO可通过IL-6/STAT3/VEGF通路促进肿瘤血管新生(文章待发),因此,LPM3480226除了可激活免疫T细胞外,还可在一定程度通过抑制肿瘤血管生成发挥作用,本研究结果也显示联用组肿瘤中CD34-MVD水平显著降低,这可能是LPM3480226与索拉菲尼联合使用具有协同抗肿瘤作用的另一个机制。
综上,本实验条件下,索拉菲尼与LPM3480226联用在Renca小鼠模型中具协同抗肿瘤作用,与增加肿瘤浸润淋巴细胞比例和降低血管形成有关。基于IDO抑制剂的免疫治疗与抗血管生成药物联用可能成为提高肿瘤临床治疗效果的重要策略之一。
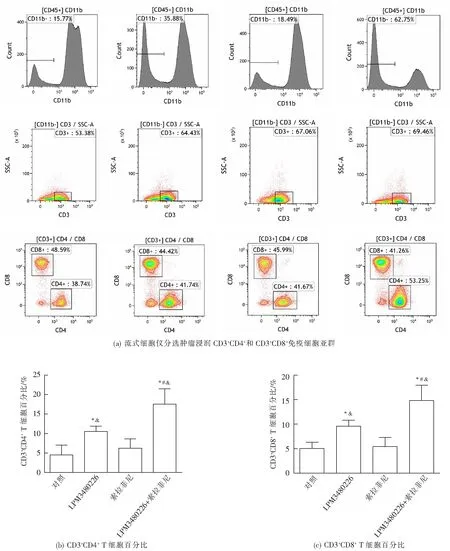
与对照组比较;#P<0.05,与LPM3480226组比较;&P<0.05,与索拉菲尼组比较。

与对照组比较;#P<0.05,与LPM3480226组比较;&P<0.05,与索拉菲尼组比较。
