瑞芬太尼调控Linc00462/miR-2355-5p对肾癌细胞生物学行为的影响*
2022-04-24文竹,李军,何洁
文 竹,李 军,何 洁
(电子科技大学医学院附属绵阳医院/绵阳市中心医院麻醉科,四川绵阳 621000)
肾癌(RCC)是泌尿系统常见的恶性肿瘤,近年其发病率呈上升趋势。手术、放疗和分子靶向治疗的应用在一定程度上改善了RCC患者生存现状,但其5年生存率仍非常低,其中远处转移和复发是RCC患者治疗失败和复发的主要原因[1]。瑞芬太尼是μ-阿片类全身麻醉药物,具有麻醉起效快、镇痛作用强、代谢快、不良反应少等优势。近年研究表明,瑞芬太尼可抑制T淋巴细胞增殖和炎症因子释放,从而缓解结肠癌患者术后氧化应激和炎性反应[2]。此外,瑞芬太尼通过激活糖原合成酶激酶3β(GSK-3β)诱导胶质瘤细胞凋亡[3],并通过上调微RNA-206(miR-206)、miR-519d-3p表达水平抑制胃癌细胞增殖并诱导凋亡[4-5]。然而瑞芬太尼抗RCC的相关研究十分有限。长链非编码RNA(lncRNA)是长度超过200 nt但不编码蛋白的RNA分子,其参与基因调控和肿瘤细胞稳态的各个方面,可能表现出肿瘤抑制和促进功能[6]。研究发现基因间lncRNA00462(Linc00462)在肝癌中显著上调,并通过激活磷脂酰肌醇-3-羟激酶(PI3K)/蛋白激酶(AKT)通路增强肝癌细胞侵袭表型[7]。但目前Linc00462在RCC中的表达和功能尚不清楚。miR-2355-5p在膀胱癌中表达水平减少,过表达miR-2355-5p能够抑制膀胱癌细胞恶性表型[8]。但目前Linc00462、miR-2355-5p在RCC中的表达和功能尚未见研究。本研究通过观察瑞芬太尼、Linc00462对RCC细胞786-0增殖、迁移、侵袭的影响,旨在揭示瑞芬太尼在RCC中的抗癌机制。
1 材料与方法
1.1 细胞和试剂
RCC细胞786-0购自美国ATCC公司;瑞芬太尼购自江苏恩华药业股份有限公司;Linc00462小干扰RNA(si-Linc00462)、小干扰RNA阴性对照(si-NC)、Linc00462过表达载体(pcDNA-Linc00462)、荧光素酶报告质粒由上海吉凯基因公司合成或生产;四甲基偶氮唑蓝(MTT)试剂盒购自南京森贝伽生物公司;Transwell小室购自美国Corning公司;E-cadherin兔抗单克隆抗体、N-cadherin兔抗单克隆抗体、GAPDH兔抗多克隆抗体购自美国Abcam公司;miRNA荧光定量PCR检测试剂盒购自上海联迈生物工程公司;化学发光试剂盒购自南京诺唯赞生物公司;Prime Script逆转录试剂盒、SYBR Prime Script实时荧光定量(RT-qPCR)试剂盒、miRNA cDNA合成试剂盒购自大连宝生物工程公司。
1.2 方法
1.2.1细胞培养和实验分组
786-0细胞用含100 U/mL青霉素、100 μg/mL链霉素、10%胎牛血清的RPMI-1640培养基于37 ℃、含5% CO2、湿度饱和的培养箱培养。胰酶消化80%融合细胞,1∶3传代。以3×105/孔的细胞密度接种对数期786-0细胞至6孔板,参照LipofectamineTM 2000说明书分别转染si-NC、si-Linc00462、pcDNA-Linc00462至50%融合的786-0细胞,转染48 h用RT-qPCR检测转染效果后进行下一步实验。实验分组,对照组:正常培养的786-0细胞;瑞芬太尼10 nmol/L组、瑞芬太尼20 nmol/L组、瑞芬太尼40 nmol/L组:分别用含有10、20、40 nmol/L瑞芬太尼[4]的培养液孵育细胞24~72 h;si-NC组、si-Linc00462组、pcDNA-Linc00462组:分别转染si-NC、si-Linc00462、pcDNA-Linc00462的786-0细胞;瑞芬太尼+pcDNA-Linc00462组:用含40 nmol/L瑞芬太尼的培养液孵育转染pcDNA-Linc00462的细胞48 h。
1.2.2MTT法检测细胞活力
以6×103/孔的密度接种786-0细胞至96孔板,分别用含10、20、40 nmol/L瑞芬太尼的培养液孵育细胞,在培养24、48、72 h时分别取出1板细胞,每孔加入20 μL的MTT,孵育4 h后终止培养,吸尽孔内培养液。每孔内加入150 μL的二甲基亚砜,至摇床上低速震荡10 min,酶标仪检测490 nm处吸光度(A)值。
1.2.3克隆形成实验检测细胞克隆能力
以500/孔的细胞密度接种786-0细胞至6孔板,轻轻抖动平板使细胞分散均匀,放入培养箱常规培养直至出现细胞集落。用甲醇固定集落10 min,结晶紫染色15 min,显微镜下计数含有50个以上细胞的集落数。
1.2.4Transwell实验检测细胞迁移和侵袭
将各组786-0细胞重悬于无血清培养基中,取100 μL细胞悬液转移至未包被(迁移)或包被(侵袭)基质胶的Transwell上室,下室中加入约600 μL含10%胎牛血清的培养基。培养24 h后,用甲醇固定Transwell底部膜表面细胞,用结晶紫染色,光镜下计数5个视野细胞数总和,以均值表示细胞侵袭或迁移数。
1.2.5蛋白免疫印记(Western blot)检测E-cadherin、N-cadherin蛋白表达
用预冷的PBS洗涤各组786-0细胞1次,于冰上加入细胞裂解液提取细胞总蛋白。取30 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,设置电压为100 V、电泳100 mA。用湿式转膜装置将蛋白转移到聚偏氟乙烯(PVDF)膜,电流设置30 mA。室温下,用封闭缓冲液孵育5 h;然后用E-cadherin(1∶10 000)、N-cadherin(1∶5 000)、GAPDH(1∶2 500)一抗溶液孵育PVDF膜2 h;随后用二抗溶液与PVDF膜反应1 h。用化学发光试剂盒检测PVDF膜上的免疫条带,以Image软件测得相对灰度值表示目的蛋白表达水平。
1.2.6RT-qPCR检测Linc00462、miR-2355-5p表达
根据TRIzol试剂说明书提取各组786-0细胞总RNA。利用Prime Script反转录试剂盒合成cDNA,再用SYBR Prime Script RT-qPCR试剂盒进行PCR反应。Linc00462正向引物5′-ACT AGG TCC TTC TGG TGT TTT-3′,反向引物5′-GTA AAA CTT GCT GCT GAT G-3′;GAPDH正向引物5′-CGG AGT CAA CGG ATT TGG TCG TAT-3′,反向引物5′-AGC CTT CTC CAT GGT GGT GAA GAC-3′;miR-2355-5p正向引物5′-ATC CCC AGA TAC AAT GGA CAA-3′,反向引物5′-CCA GTG CAG GGT CCG AGG T-3′;U6正向引物5′-CTC GCT TCG GCA GCA CA-3′,反向引物5′-AAC GCT TCA CGA ATT TGC GT-3′。采用2-ΔΔCt法计算靶基因表达水平。GAPDH为Linc00462的内参,U6为miR-2355-5p的内参。
1.2.7双荧光素酶报告基因实验
为确定Linc00462与miR-2355-5p的靶向关系,利用LipofectamineTM 2000将miR-2355-5p mimic或miR-NC分别转染miR-2355-5p结合位点的Linc00462野生型(wt-Linc00462)及突变型(mut-Linc00462)荧光素酶报告载体。在转染后48 h利用双荧光素酶活性检测试剂盒分析荧光素酶活性。
1.3 统计学处理
2 结 果
2.1 瑞芬太尼对786-0细胞增殖及Linc00462、miR-2355-5p表达的影响
与对照组比较,瑞芬太尼10、20、40 nmol/L组786-0细胞克隆形成数、细胞A值(48 h、72 h)、Linc00462表达水平显著降低(P<0.05),miR-2355-5p表达水平显著增加(P<0.05)。见图1和表1。
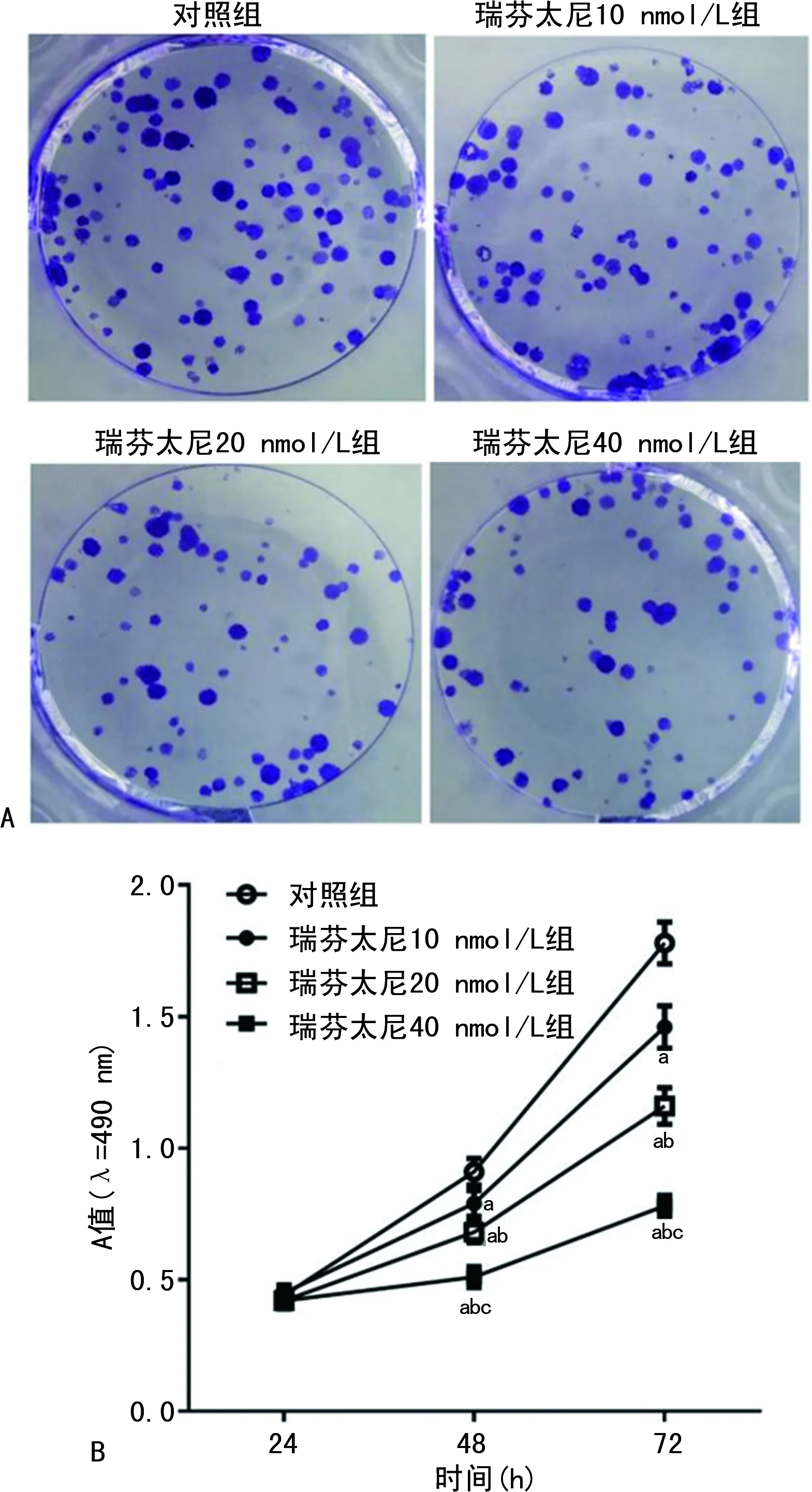
A:克隆形成实验;B:MTT实验。a:P<0.05,与对照组比较;b:P<0.05,与瑞芬太尼10 nmol/L组比较;c:P<0.05,与瑞芬太尼20 nmol/L组比较。

表1 瑞芬太尼对786-0 Linc00462、miR-2355-5p表达水平和细胞克隆形成的影响
2.2 瑞芬太尼对786-0细胞迁移、侵袭的影响
与对照组比较,瑞芬太尼10、20、40 nmol/L组786-0细胞迁移数、侵袭数、N-cadherin蛋白表达水平显著降低(P<0.05),E-cadherin蛋白表达水平显著增加(P<0.05)。见图2和表2。
2.3 沉默Linc00462对786-0细胞增殖、迁移、侵袭的影响
与对照组、si-NC组比较,si-Linc00462组786-0细胞Linc00462表达水平、克隆形成数、侵袭数、迁移数、N-cadherin蛋白表达水平显著降低(P<0.05),E-cadherin蛋白表达水平、miR-2355-5p表达水平显著增加(P<0.05)。见图3和表3。
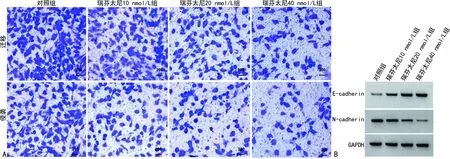
A:Transwell实验;B:Western blot。

A:克隆形成实验;B:Transwell实验;C:Western blot。

表2 瑞芬太尼对786-0组迁移、侵袭的影响
2.4 Linc00462能逆转瑞芬太尼对786-0增殖、迁移、侵袭的影响
与对照组比较,瑞芬太尼组(40 nmol/L)786-0细胞Linc00462表达水平、克隆形成数、侵袭数、迁移数、N-cadherin蛋白表达水平显著降低(P<0.05),E-cadherin蛋白表达水平、miR-2355-5p表达水平显著增加(P<0.05);与对照组比较,pcDNA-Linc00462组786-0细胞Linc00462表达水平、克隆形成数、侵袭数、迁移数、N-cadherin蛋白表达水平显著升高(P<0.05),E-cadherin蛋白表达水平、miR-2355-5p表达水平显著降低(P<0.05);与瑞芬太尼组比较,瑞芬太尼(40 nmol/L)+pcDNA-Linc00462组786-0细胞Linc00462表达水平、克隆形成数、侵袭数、迁移数、N-cadherin蛋白表达水平显著升高(P<0.05),E-cadherin蛋白表达水平、miR-2355-5p表达水平显著降低(P<0.05)。见图4和表4。

表3 沉默Linc00462对786-0细胞克隆形成、迁移、侵袭及Linc00462及miR-2355-5p表达的影响

表4 过表达Linc00462逆转瑞芬太尼对786-0克隆形成、迁移、侵袭的抑制作用
2.5 Linc00462靶向miR-2355-5p
Starbase预测到miR-2355-5p是Linc00462的潜在靶基因,miR-2355-5p与Linc00462之间的预测结合区域见图5。进行双荧光素酶报告基因检测,miR-2355-5p mimics和wt-Linc00462共转染后相对荧光素酶活性与miR-2355-5p mimics和mut-Linc00462共转染比较显著降低(P<0.05),见表5。

图5 Starbase预测Linc00462和miR-2355-5p的靶向关系

表5 荧光素酶活性
3 讨 论
麻醉是手术治疗的重要组成部分,但手术过程中麻醉药与癌细胞的接触可能直接影响癌细胞生物学行为,甚至影响癌症的复发和转移。因此,探讨麻醉药对RCC细胞生物学行为的影响对临床治疗RCC意义重大。
瑞芬太尼因其起效快、麻醉苏醒时间快、不良反应发生率低、代谢可预测等优点在临床肿瘤切术中应用广泛[8]。LU等[9]研究发现瑞芬太尼对宫颈癌根治术患者的认知功能、T淋巴细胞和炎症因子的影响相对较小。唐优仕等[10]、赵莉等[11]证实瑞芬太尼在体外能抑制胰腺癌细胞、结肠癌细胞增殖,并促进其凋亡。孟俊青[12]研究表明瑞芬太尼以剂量依赖方式诱导肺癌细胞G2/M期周期阻滞和凋亡。可见,瑞芬太尼对肿瘤细胞生物学行为具有重要影响。本研究以10、20、40 nmol/L瑞芬太尼处理RCC细胞786-0,结果表明786-0细胞活力、克隆能力、迁移和侵袭能力均显著下降,且呈浓度依赖性,提示瑞芬太尼对RCC细胞恶性表型具有抑制作用。E-cadherin和N-cadherin参与细胞上皮间质转化(EMT)调控,N-cadherin表达水平上调、E-cadherin表达缺失是肿瘤细胞侵润、转移的重要机制,通过调控二者的表达情况可有效调节肿瘤细胞迁移和侵袭行为[13]。本研究中瑞芬太尼处理明显下调N-cadherin蛋白表达水平,上调E-cadherin蛋白表达水平,这与瑞芬太尼的抗迁移、抗侵袭作用相符和。以上研究表明瑞芬太尼对RCC细胞恶性生物学行为具有抑制作用。
lncRNA通过在转录和转录后水平调控基因表达,在细胞增殖、分化、凋亡和转移中具有关键作用,与肿瘤发生、转移关系密切。Linc00462是长度为1 023 nt的lncRNA,胰腺癌中Linc00462表达水平显著上调,其表达水平与肿瘤大小、肿瘤分化、TNM分期和远处转移有关,过表达Linc00462显著抑制胰腺癌细胞凋亡和黏附,促进胰腺癌细胞增殖、迁移、侵袭和细胞周期过程[14]。Linc00462表达水平与肝癌患者生存相关,Linc00462和其他4个lncRNA联合检测是肝癌预后的可靠标志物[15]。本研究探讨Linc00462在RCC中的功能,结果表明转染si-Linc00462沉默Linc00462表达可明显抑制786-0细胞克隆形成、迁移和侵袭能力,抑制N-cadherin蛋白表达,促进E-cadherin蛋白表达,而转染pcDNA-Linc00462过表达Linc00462则增强786-0细胞克隆形成、迁移和侵袭能力,提示Linc00462在RCC中表现出肿瘤促进功能。同时,本研究发现瑞芬太尼处理后786-0细胞中Linc00462表达水平以剂量依赖方式降低,且瑞芬太尼与沉默Linc00462的抗癌效果类似,提示瑞芬太尼可能通过下调Linc00462在RCC中发挥抗癌功能。深入研究显示,过表达Linc00462还可明显削弱瑞芬太尼对786-0细胞克隆形成、迁移和侵袭的抑制作用,并改变N-cadherin和E-cadherin蛋白表达水平。
多项研究证实lncRNA充当miRNA海绵作用是其参与调控肿瘤进展的重要机制,例如lncRNA面生殖发育不良基因5反义RNA1(FGD5-AS1)通过靶向抑制miR-5590-3p促进RCC细胞增殖、迁移、EMT和侵袭[16]。研究表明miR-2355-5p在膀胱癌中表达水平减少,过表达miR-2355-5p能够抑制膀胱癌细胞恶性表型[17]。miR-2355-5p可作为lncRNA WD重复和FYVE结构域蛋白3反义RNA2(WDFY3-AS2)的靶基因,介导WDFY3-AS2对食管鳞癌细胞增殖、迁移的促进作用[18]。此外,lncRNA受体活性修饰蛋白2-反义RNA(RAMP2-AS1)通过下调miR-2355-5p表达促进血管生成[19]。本研究证实miR-2355-5p是Linc00462的靶基因,且miR-2355-5p的表达受到Linc00462的负性调控。瑞芬太尼处理后miR-2355-5p表达上调,这与沉默Linc00462上调miR-2355-5p表达的作用一致,提示瑞芬太尼可能通过调控Linc00462/miR-2355-5p通路对RCC具有抗癌作用。然而,本研究仍存在不足之处,如敲低或过表达miR-2355-5p对RCC细胞生物学行为的影响仍需验证。
综上所述,本研究首次证实瑞芬太尼对RCC细胞的增殖、迁移和侵袭具有抑制作用,其机制可能与下调Linc00462/miR-2355-5p通路有关,这些发现为瑞芬太尼在RCC治疗中的应用奠定了理论基础,为RCC的基因治疗提供潜在有效靶点。
