普罗布考对脑出血模型小鼠血肿周围脑组织MST1和LATS1及YAP蛋白表达的影响*
2022-04-24董晓柳刘蔚然司味鑫张秀清宋丽华
董晓柳,刘蔚然,高 铭,司味鑫,张秀清,宋丽华,张 利,董 伟
(河北省唐山市人民医院:1.神经康复科;2.神经外科 063000)
脑出血(intracerebral hemorrhage,ICH)是指非外伤性脑实质内出血,临床症状主要表现为脑卒中发作,出现头痛、呕吐、偏身瘫痪及(或)感觉障碍甚至意识障碍等,仅有20%的患者在ICH后6个月达到功能独立[1-2],是死亡率和致残率较高的疾病。因此,截至目前ICH的防治仍是我国疾病防控的重点。普罗布考不仅具有降脂、抗氧化等作用,亦具有抗炎、减轻脑水肿、改善认知功能、减轻神经功能障碍等脑保护作用[3],但其发挥保护作用的具体机制目前尚不完全清楚。Hippo信号通路是首次在果蝇体内被发现[4],在组织修复、调控组织器官大小、调节细胞增殖与凋亡等方面具有重要的作用[5]。哺乳动物不育系20样激酶(MST1)是Hippo信号通路的核心组件,大肿瘤抑制因子1(LATS1)是Hippo通路的核心激酶[6],其下游分子Yes相关蛋白-1(YAP)是Hippo通路的主要转录调控激活因子[7]。有研究报道,在ICH中,抑制Hippo通路可减轻脑损伤[8]。然而,普罗布考是否通过Hippo通路在ICH脑损伤中发挥保护作用目前尚不明确。因此本研究通过观察普罗布考对MST1和LATS1及YAP表达的影响,为急性期ICH临床治疗寻找新靶点。
1 材料与方法
1.1 实验动物
正常健康雄性C57BL/6J小鼠,6~8周龄,体重20~25 g,购自北京华阜康生物科技股份有限公司[许可证号:SCXK(京)2019-0008]。实验动物在华北理工大学屏障环境动物实验室由专人饲养,饲养条件为通风,清洁,自然光线12 h/12 h昼夜交替照明,昼夜室温控制在20~25 ℃,相对湿度控制在45%~55%,分笼饲养,避免强光及噪音,给予充足自来水和标准颗粒饲料喂养。动物适应性喂养7 d后进行造模,在实验设计及实际操作过程中尽可能降低实验动物的需要量,尽量避免实验动物因不合理操作导致死亡,同时减轻其在实验过程中所承受的痛苦。
1.2 药物与试剂
普罗布考片(齐鲁制药有限公司,批准文号:国药准字H10980054);兔抗MST1抗体、兔抗p-MST1抗体、兔抗p-YAP抗体、兔抗YAP抗体、兔抗p-LATS1、兔抗LATS1(美国Cell Signaling Technology公司,货号:49332、14946、13008、14074、8654、3477);兔抗Neun抗体(美国Abcam公司,批号:ab177487);兔抗β-肌动蛋白抗体、HRP标记的山羊抗兔二抗(北京中山金桥,货号:TA-09、87768);脱氧核糖核苷酸末端转移酶介导的缺口末端标记(TUNEL)试剂盒、伊文思蓝(EB)染液(北京索莱宝科技有限公司,货号:T2190、314-13-6)。
1.3 主要仪器
脑立体定位仪(北京金洋万达科技有限公司);Tissuelyser-192组织匀浆仪(上海净信实业发展有限公司);12003153型凝胶成像仪、酶标仪(美国Bio-Rad公司)。CM1900型冰冻切片机(德国Leica公司);免疫荧光显微镜(日本Nikon公司);-80 ℃冰箱(海尔公司);恒温水浴箱(美国Amersham Biosicences公司)。
1.4 动物分组及给药方法
采用随机数字表法将实验小鼠分为假手术组(sham组)、ICH模型组(ICH组)、ICH模型+普罗布考治疗组(ICH+PB组),每组18只。ICH+PB组于造模后6 h开始灌胃给药普罗布考(500 mg·kg-1·d-1),sham组和ICH组于相应时间点给予等体积的生理盐水。
1.5 模型制备
采用胶原酶法制作小鼠ICH模型[9]。将0.037 5 U的细菌胶原酶溶于0.5 μL 0.9%生理盐水,避光放置于冰上备用。造模前12 h禁食,4 h禁饮,5%水合氯醛(0.7 mL/kg)腹腔注射麻醉小鼠,将其固定在脑立体定位仪上,沿矢状位作一长1 cm的皮肤切口,前囟为原点,向前0.5 mm、向右2.3 mm处钻一直径为1 mm小圆孔作为注射孔,将吸入细菌胶原酶溶液的微量注射器固定好,针头沿注射孔垂直缓慢插入脑实质,深度约3.7 mm,以0.5 μL/min的速度注入细菌胶原酶溶液,注射完毕后停针10 min,缓慢向上拔针,每向上拔针1 mm停针5 min,直至全部拔出[10]。最后用骨蜡封闭注射孔,手术线缝合伤口,碘伏消毒。sham组除不注射细菌胶原酶溶液外,其余操作均与ICH组一致。根据BEDERSON等[11]的评定方法分为3级,0级:没有神经缺失症状;1级:提尾,瘫痪侧前肢回收屈曲腹下,健侧前肢向地面伸展;2级:除了有1级体征外,向瘫痪侧推小鼠时手所受到的阻力较对侧明显变小;3级:除以上体征外,小鼠行走时向瘫痪侧旋转或倾倒。ICH后1 h对小鼠进行评定。评定达1、2、3级判断为造模成功。
1.6 神经功能行为学评价
神经功能评估采用改良的神经功能损伤(mNSS)评分,主要内容包括感觉、运动、反射及平衡功能[12]等,分别在ICH后第1、3天分别进行。0分无神经功能缺损;1~6分为轻度神经功能缺损;7~12分为中度神经功能缺损;13~18分为重度神经功能缺损。
1.7 脑组织含水量测定
采用经典干湿重法测量各组小鼠脑组织含水量,含水量的多少可以反映脑水肿的严重程度。于ICH后第3天水肿高峰期时,采用颈椎脱臼法处死小鼠,取新鲜脑组织,自中线将大脑切分为左右两个半球,并分离出小脑组织。电子天平称得3部分组织湿重并记录(精确到0.1 mg)。测完后分别用锡纸包裹好,迅速置于100 ℃烤箱中,24 h后再称重,此时称得的重量即为干重。计算脑组织含水量=(湿重-干重)/湿重×100%。
1.8 血脑屏障(blood-brain barrier,BBB)渗透性测定
采用EB作为示踪剂来评估BBB渗透性。于ICH后第3天,尾静脉注射2% EB(2 mL/kg),注射成功标志:小鼠巩膜、耳廓、手掌、脚掌等部位迅速变为蓝色。注射成功2 h后,行心脏灌注后断头取脑,去掉嗅球及小脑,将取得的大脑半球在精度为0.1 mg的电子天平上称质量后将脑组织匀浆,并将其加入装有5 mL二甲基甲酰胺的试管中,于60 ℃恒温水浴锅孵育72 h,离心弃去沉淀,取上清液检测。采用分光光度计于波长450 nm的波谱处分析、测定吸光度(A)值,绘制标准曲线,根据以下方程计算脑组织EB含量:脑组织中EB含量(μg/g) =EB浓度×二甲基甲酰胺体积(mL)/湿重(g)。
1.9 神经元细胞凋亡检测方法
采用TUNEL法检测神经元细胞凋亡情况。于ICH后第3天,行心脏灌注取脑,脑组织冰冻切片均采用0.3% Triton-X100打孔,3%牛血清清蛋白(BSA)封闭,PBS洗3次,每次5 min ,滴加神经元标志性蛋白Neun一抗(1∶500),4 ℃过夜,在预先混合好的TUNEL反应液中加入荧光二抗,滴加40 μL于玻片上,37 ℃湿盒内避光孵育2 h,PBS洗3次,每次5 min,封片,荧光显微镜下观察免疫荧光结果。
1.10 MST1、LATS1、YAP表达情况检测
采用蛋白免疫印迹(Western blot)法检测血肿周围脑组织MST1、LATS1和YAP的表达变化。于给药后第3天,行心脏灌注取脑,取200 mg脑组织,加入1 mL预冷的(RIPA)缓冲液及10 μL 苯甲基磺酰氟(PMSF)裂解组织,组织匀浆仪研磨后,冰上放置30 min。将匀浆好的脑组织移入离心管中,离心,取上清液。应用蛋白浓度测量仪测定蛋白浓度,将提取的蛋白加入4×上样缓冲液,十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳分离蛋白,转至聚偏氟乙烯(PVDF)膜,用TBST于摇床上摇洗3次,每次10 min,洗完后将PVDF膜放入含有5%脱脂奶粉的容器中,常温慢摇1 h进行封闭。将膜与一抗(兔抗MST1抗体稀释比例1∶1 000;兔抗p-MST1抗体稀释比例1∶1 000;兔抗P-YAP抗体稀释比例1∶1 000;兔抗YAP抗体稀释比例1∶1 000;兔抗P-LATS1稀释比例1∶1 000;兔抗LATS1稀释比例1∶1 000;兔抗β-肌动蛋白抗体稀释比例1∶2 000)4 ℃孵育过夜。TBST洗涤PVDF膜3次,分别加入二抗(HRP标记山羊抗兔抗体稀释比例1∶5 000),室温孵育1 h。使用增强型化学发光(美国Cell Signaling Technology公司)试剂使印迹可视化。Bio-rad Quantity One4.4.0成像仪显影。目的条带采用ImageJ软件进行灰度值分析。
1.11 统计学处理
2 结 果
2.1 神经功能评分比较
与sham组比较,ICH组小鼠在ICH后第1、3天mNSS评分明显增加(P<0.01);与ICH组比较,ICH+PB组小鼠在ICH后第1、3天mNSS评分明显减低(P<0.05)。见图1。
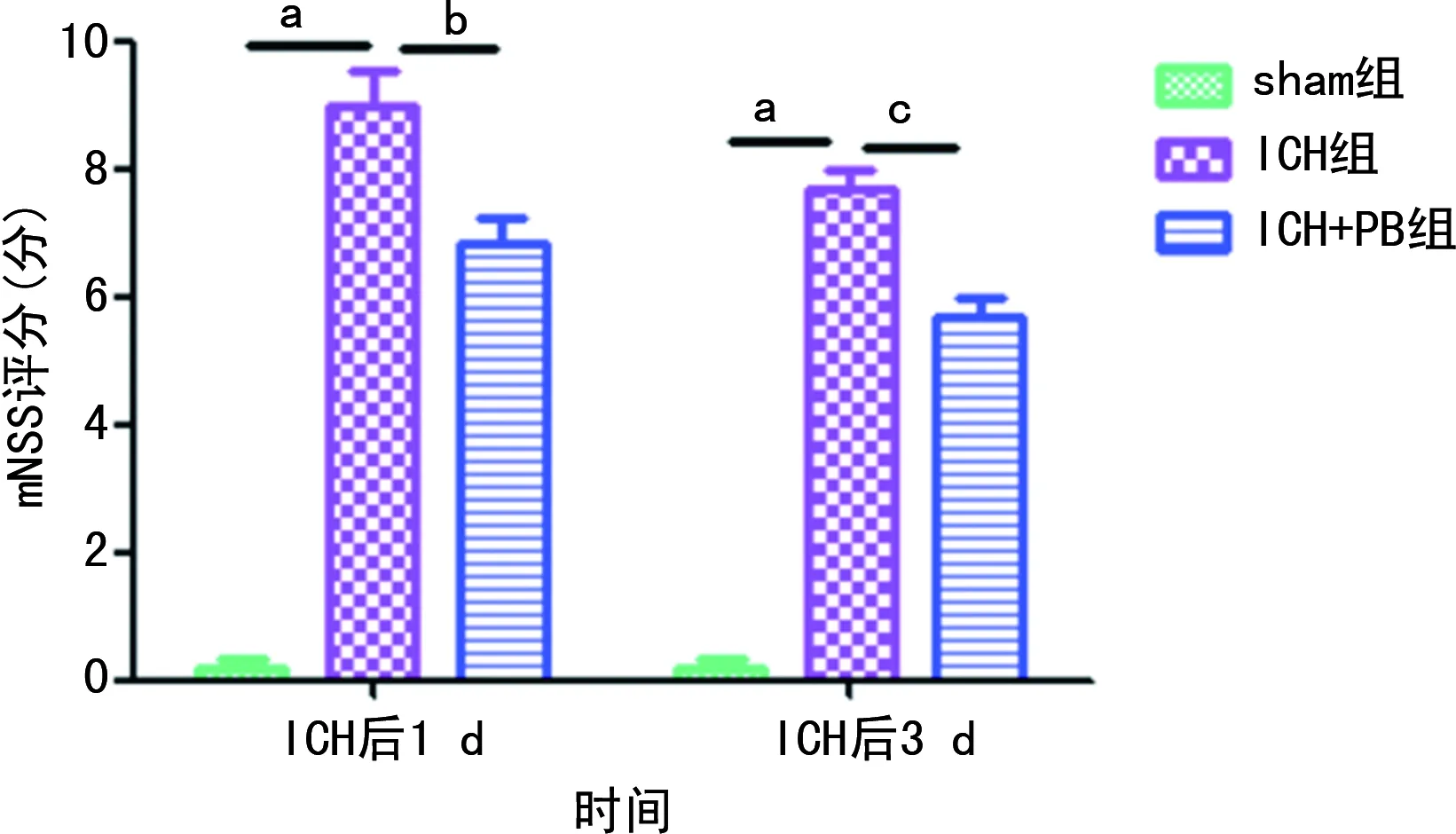
a:P<0.01,与sham组比较;b:P<0.05,c:P<0.01,与ICH组比较。
2.2 BBB渗漏性测定
与sham组比较,ICH组小鼠在ICH后第3天EB含量明显增加(P<0.01);与ICH组比较,ICH+PB组小鼠在ICH后第3天EB含量明显降低(P<0.05)。见图2。
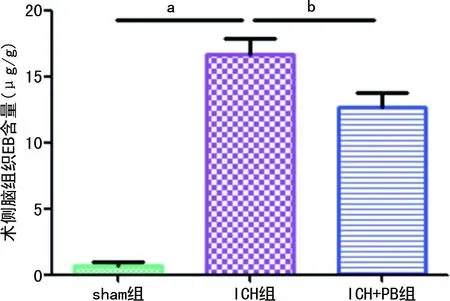
a:P<0.01,与sham组比较;b:P<0.05,与ICH组比较。
2.3 凋亡细胞数检测
与sham组比较,ICH组小鼠在ICH后第3天血肿周围脑组织神经元细胞数凋亡明显增加(P<0.01);与ICH组比较,ICH+PB组小鼠在ICH后第3天血肿周围脑组织神经元细胞数凋亡明显减少(P<0.05)。见图3。
2.4 MST1、LATS1、YAP表达检测结果
与sham组比较,ICH组小鼠在ICH后第3天血肿周围脑组织p-MST1、p-LATS1及p-YAP表达水平明显增加(P<0.05);与ICH组比较,ICH+PB组小鼠在ICH后第3天血肿周围脑组织p-MST1、p-LATS1及p-YAP表达水平明显减低(P<0.05)。见图4。
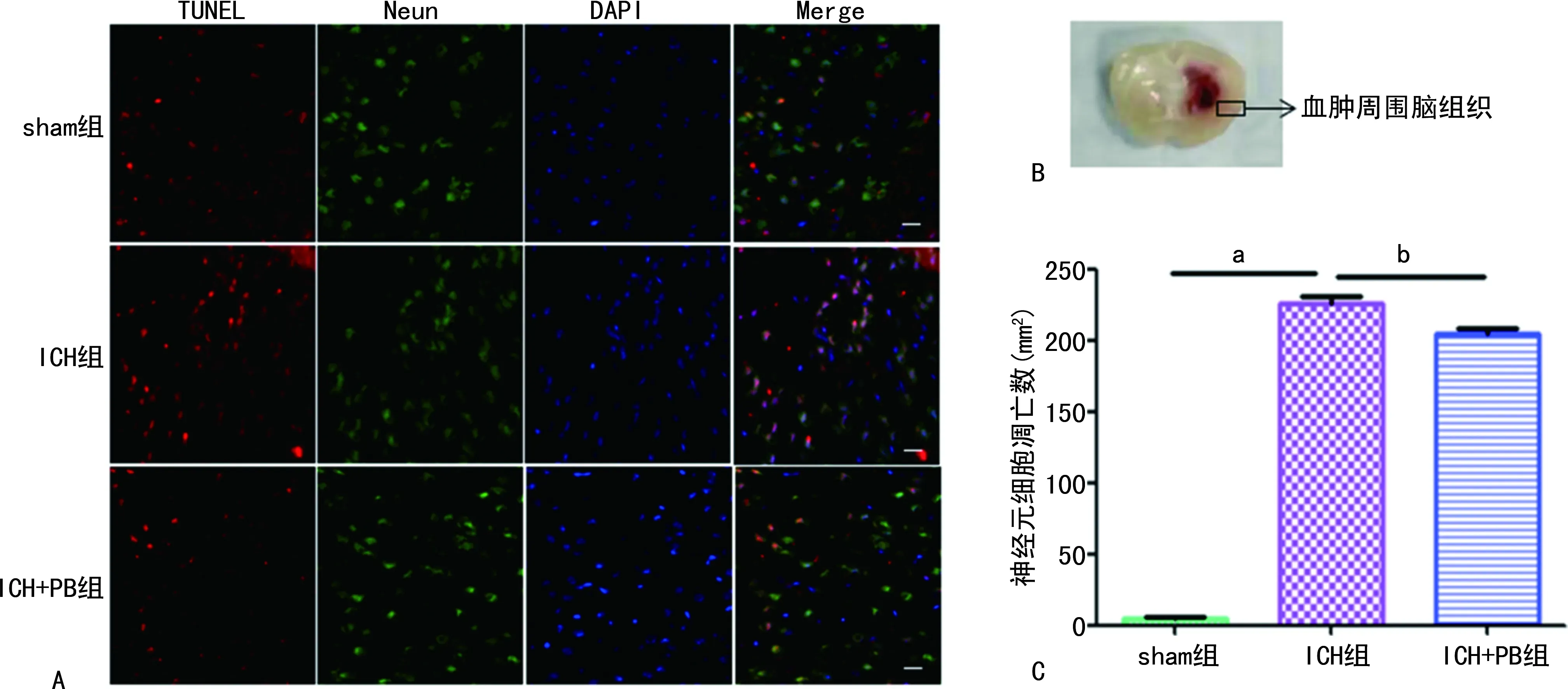
A:TUNEL荧光图;B:血肿周围组织;C:血肿周围神经元细胞凋亡分析;a:P<0.01,与sham组比较;b:P<0.05,与ICH组比较。
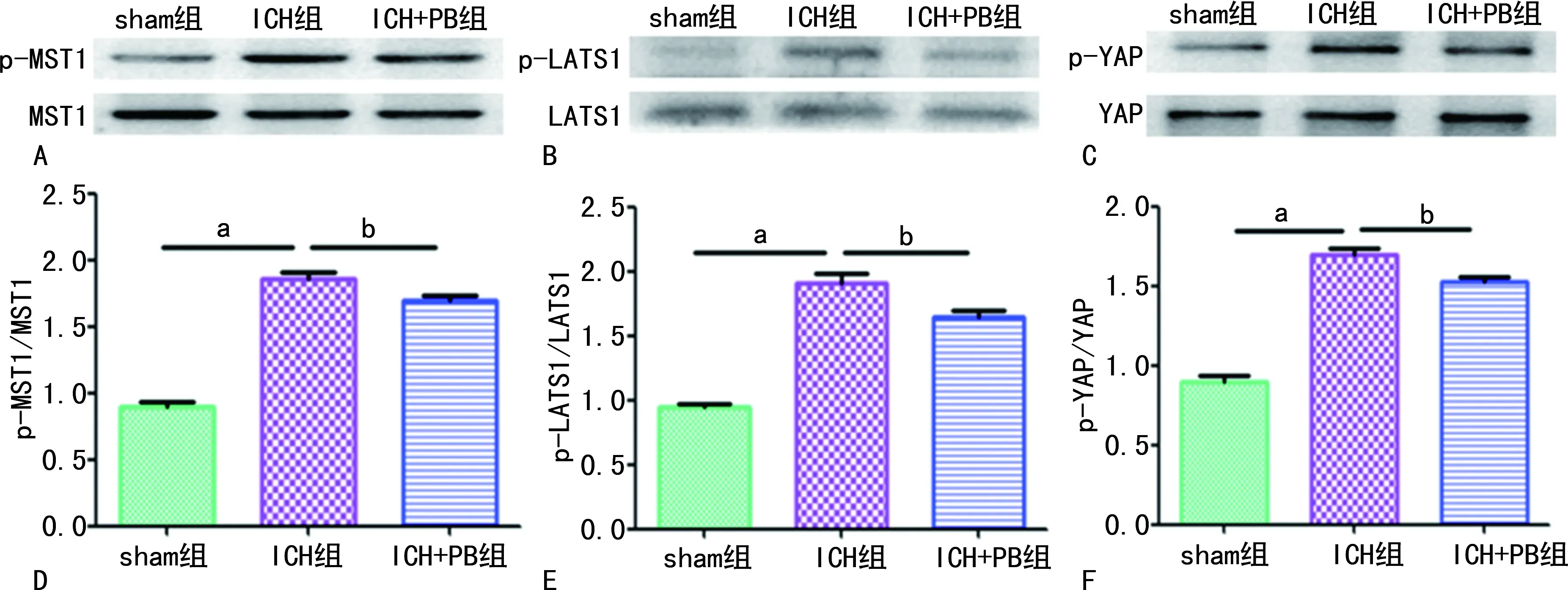
A、B、C:Western blot图;D、E、F:Western blot定量分析图;a:P<0.01,与sham组比较;b:P<0.05,与ICH组比较。
3 讨 论
ICH后脑损伤机制主要包括各种信号通路的激活,从而引发细胞的凋亡或者坏死。许多研究表明神经元细胞的凋亡和损伤是ICH后神经功能缺失的机制之一[13],是ICH后神经功能进行性发展、恶化的直接原因[14]。ICH后正常脑组织结构遭到破坏,从而引发BBB完整性破坏,导致有害物质进入脑组织从而造成脑损害。研究表明,ICH后继发的脑水肿危害巨大,是导致神经功能障碍的关键因素,其中BBB的破坏引起的血管源性脑水肿是继发性脑水肿的主要环节[15],并且BBB的破坏又能促进细胞凋亡、炎性反应、氧化应激的放大等[16-17],从而加重ICH后多种继发性神经损害。既往动物实验研究表明,ICH后第3天出现脑水肿和细胞凋亡高峰[18],一般最多持续10~14 d[19]。故本实验选择在ICH后第3天检测脑组织BBB渗透性及神经元细胞凋亡情况,以评估脑损伤程度及给予干预措施后的治疗效果。
普罗布考属于新型调脂药,相对分子质量小,易透过BBB。其作用除了调脂、抗氧化以外还具有下调炎症因子表达[20]、改善血管内皮功能[21]、改善认知[22]、清除氧自由基、抗神经细胞凋亡[23]等作用。研究表明,在缺血再灌注模型中[24],给予普罗布考进行干预后可减少梗死面积和血管渗漏,保持BBB的完整性,起到抗神经元细胞凋亡、改善神经功能障碍的作用。在血管性痴呆和阿尔茨海默病(AD)的早期,给予普罗布考可降低BBB通透性,从而改善认知[25]。在生理状态下EB在血管内与蛋白结合,很难进入脑组织,只有在BBB结构受损、通透性升高的情况下,EB才能进入脑组织,因此脑组织内EB含量可用来衡量BBB通透性的程度。本研究发现,ICH后小鼠BBB通透性明显升高,脑组织EB含量升高,经普罗布考干预3 d后,小鼠脑组织EB含量明显降低,同时神经功能障碍得到改善,提示普罗布考可减轻ICH所致的脑损害。
Hippo通路由丝氨酸激酶级联反应组成,通过激酶之间的相互作用和级联磷酸化来传导信号。Hippo通路可调控与生长相关的基因,参与细胞的增殖和凋亡过程,控制组织器官中细胞的数量和组织的大小。在哺乳动物中,Hippo通路的激活,可导致p-MST1水平升高,p-MST1与Sav形成复合物,可以磷酸化并激活LATS1,继而磷酸化YAP/TAZ使p-YAP/TAZ静置在细胞质中[26],因此YAP1的凋亡抑制作用将会消失[27],相反,YAP/TAZ去磷酸化可以使其发生核转位并激活转录因子促进细胞增殖、抑制凋亡[28]。既往研究表明,在ICH血模型中[29],Hippo信号通路的抑制可缓解缺血缺氧造成的BBB损伤,起到神经保护作用。在ICH模型中,Hippo信号通路的抑制可减轻ICH期间的脑水肿、BBB损伤和神经功能障碍[30]。本研究发现,ICH后血肿周围脑组织p-MST1、p-LATS1及p-YAP表达水平明显上升、EB渗漏增加、神经元细胞凋亡数明显增多,与既往研究一致。给予普罗布考干预后,与ICH组比较,血肿周围脑组织中p-MST1、p-LATS1及p-YAP表达水平明显下降,说明普罗布考可起到抑制Hippo通路的作用,并且给予普罗布考后EB渗漏降低、神经元细胞凋亡数减少,从而推测普罗布考可能通过抑制Hippo通路从而起到脑保护作用。
综上所述,普罗布考对ICH模型小鼠具有脑保护作用,该作用可能是通过抑制Hippo通路而发挥保护BBB、抗神经元细胞凋亡、改善神经功能障碍的作用,从而减轻脑损伤。
