胃癌术前免疫治疗的疗效及安全性初探:一项回顾性病例系列研究
2022-04-24王琦吴舟桥李子禹
王琦,吴舟桥,李子禹
北京大学肿瘤医院暨北京市肿瘤防治研究所胃肠肿瘤中心一病区 恶性肿瘤发病机制及转化研究 教育部重点实验室,北京100142
胃癌是全球常见的恶性肿瘤之一,也是东亚地区高发的癌症[1]。根据最新的癌症数据报道[2],2020年全球胃癌新发病例约100万例,死亡约7.7万人;胃癌发病率在恶性肿瘤中排名第六,死亡率排名第三。目前,全球43.9%的胃癌新发病例和48.6%的胃癌致死病例发生在中国[1]。和其他东亚地区(尤其是日韩)相比,我国早期胃癌的检出率较低,且以进展期为主[3]。随着进展期胃癌围术期治疗模式的不断优化和探索,免疫治疗越来越多地应用于胃癌的围术期治疗。KEYNOTE-811、CheckMate-649、ORIENT-16等研究[4-6]令人鼓舞的数据及结论,确立了免疫治疗在晚期胃癌一线治疗中的地位,而基于胃癌一线免疫治疗确切的有效率,新辅助免疫治疗亦在积极开展。为研究胃癌术前免疫治疗的疗效及安全性,本中心开展了一项回顾性研究,现将结果报告如下。
资料与方法
一、研究对象及纳入排除标准
研究对象为2019年4月至2021年11月间在北京大学肿瘤医院胃肠肿瘤中心一病区行手术治疗的胃癌病人。纳入标准:(1)年龄≥18岁;(2)经过胃镜/超声胃镜,组织学活检,腹部增强CT等检查评估,确诊为胃腺癌;(3)术前接受过免疫治疗;(4)无严重的血液系统疾病、无心肝肺肾功能异常、无免疫缺陷;(5)能够耐受全身麻醉下的手术治疗,标准为美国麻醉医师协会(ASA)分级Ⅰ~Ⅱ级;(6)术前由胃肠外科、消化内科、影像科、放疗科等多学科综合治疗团队(multi-disciplinary team,MDT)评估,认为具备手术可行性。排除标准:(1)孕妇或哺乳期女性;(2)疑似或确诊的活动性自身免疫性疾病;(3)既往异体器官移植;(4)急诊手术(出血、穿孔或梗阻);(5)合并其他可能严重影响术前治疗或手术结果的疾病,如不受控制的神经系统疾病、其他恶性肿瘤、严重心脏病等。本研究的病人皆为PACAGE研究[7]中我中心的入组病人,该研究已获得我院伦理委员会批准,批件号为2018YJZ56。
二、观察指标
1.术前治疗的安全性评价 治疗不良事件的发生率及严重不良事件的发生率。根据国家癌症研究所的不良事件通用术语标准(5.0版)[8]对病人治疗期间记录的所有不良事件进行分级。
2.手术的安全性评价 术后恢复指标,包括肛门排气时间、排便时间、流食时间、半流食时间、术后住院时间;术后并发症的发生率及严重并发症的发生率,根据Clavien-Dindo分类标准[9]对病人术后直至出院期间发生的并发症进行分级。根据《中国胃肠肿瘤外科术后并发症诊断登记规范专家共识(2018版)》[10]记录术后并发症的情况。
3.术前治疗的疗效评价 主要指标为客观缓解率(objective response rate,ORR),完全缓解(complete response,CR)及部分缓解(partial response,PR)的病例之和[11];疾病控制率(disease control rate,DCR),完全缓解、部分缓解及疾病稳定(stable disease,SD)的病例之和[4];病理完全缓解(pathological complete response,pCR);显著病理缓解(major pathological response,MPR),肿瘤退缩分级(tumor regression grade,TRG)0~1级[12](TRG 0.完全退缩,TRG 1.退缩良好,TRG 2.部分退缩,TRG 3.无退缩)。任何经过术前治疗的病人,都会由MDT根据实体肿瘤临床疗效评价指标(RECIST1.1)[13]进行疗效评估及手术可行性评估。
三、统计学方法
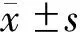
结 果
一、病人的临床特征
按照纳入及排除标准筛选,共纳入52例病人。所有病人病理活检均为腺癌。病人的基本特征、临床病理特征及围术期信息见表1。
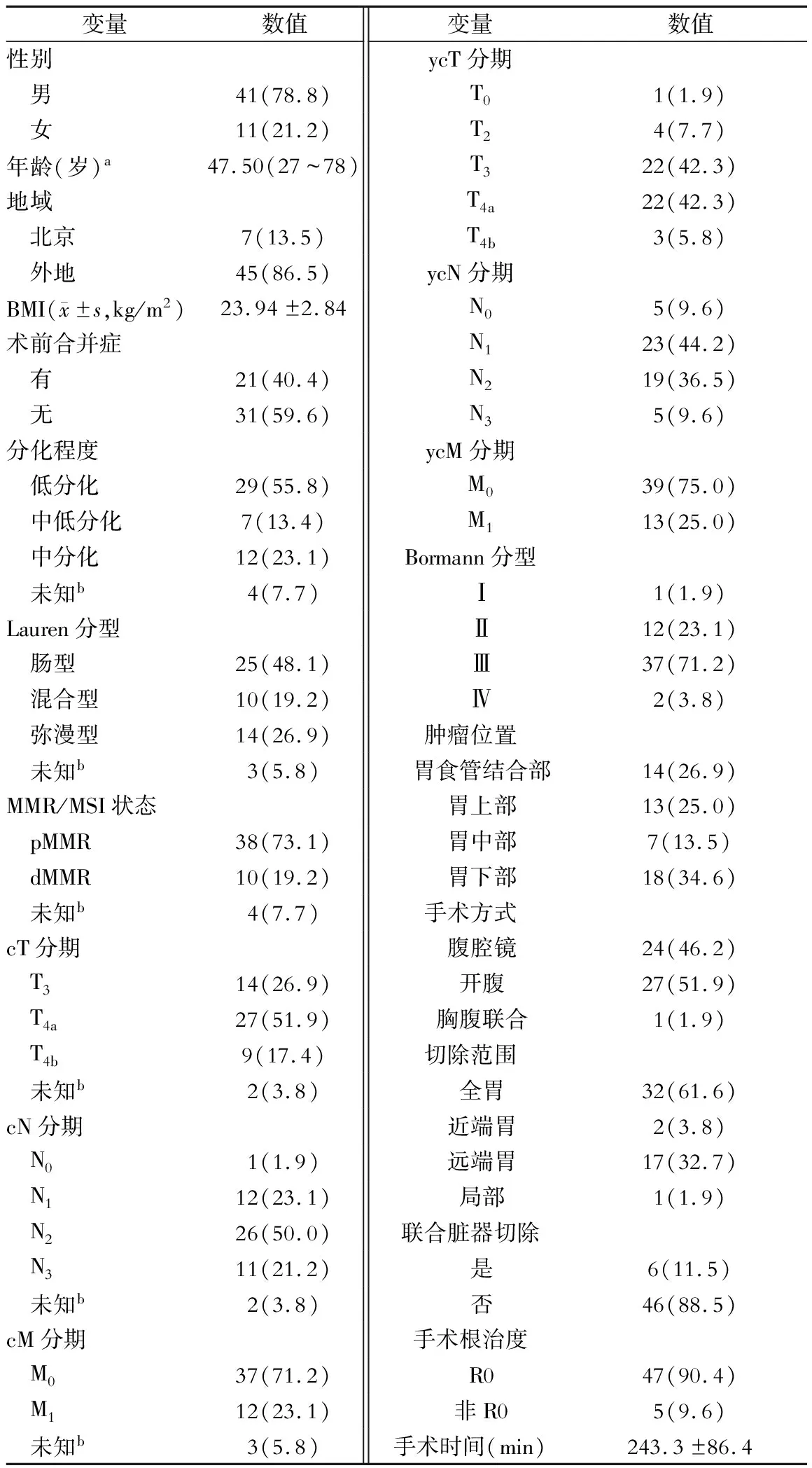
表1 52例病人的基本特征、临床病理特征及围术期信息
二、术前免疫治疗的治疗模式
52例病人的治疗模式主要分为以下四种:单纯免疫治疗(6例,11.5%),免疫治疗联合化疗(33例,63.5%),免疫治疗联合化疗及靶向治疗(10例,19.2%),免疫治疗联合放化疗(3例,5.8%)。使用的程序性死亡蛋白-1(PD-1)抑制药主要有帕博利珠单抗(15例,28.8%)和信迪利单抗(15例,28.8%)(表2)。
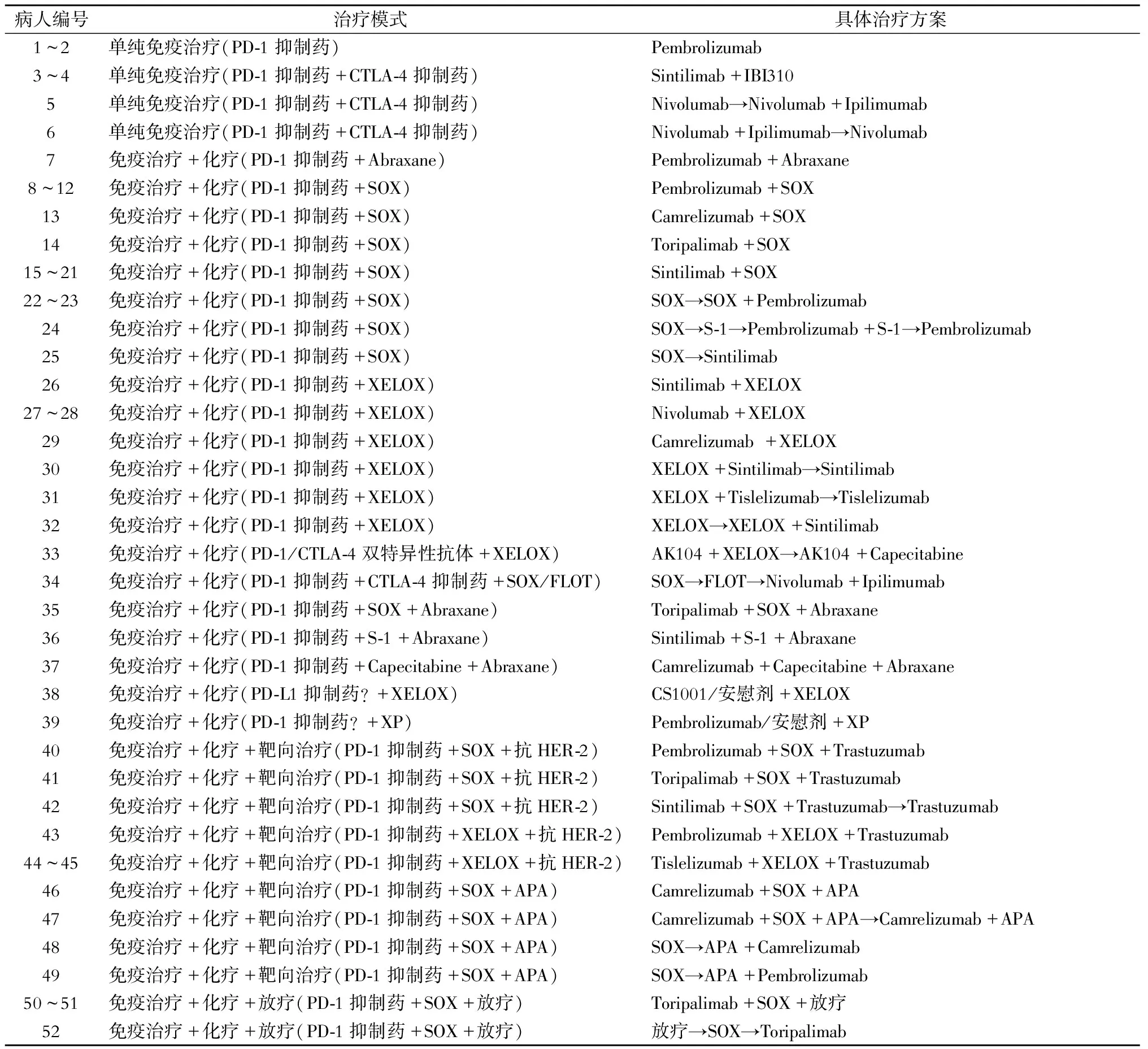
表2 术前治疗情况
三、疗效及安全性评价
1.术前治疗的安全性评价 术前治疗过程中,34例(65.4%)病人发生Ⅰ~Ⅱ级不良事件,Ⅲ级以上不良事件主要为免疫相关性皮疹(1例,1.9%),骨髓抑制(血小板减低,1例,1.9%),肝功能异常(2例,3.8%)。其中1例(1.9%)病人出现免疫相关性皮疹,Ⅲ级,激素治疗后好转;可疑免疫相关性肺炎1例(1.9%),Ⅱ级,口服激素治疗后好转;甲状腺功能障碍2例(3.8%:甲状腺功能减退1例,Ⅰ级;甲状腺功能亢进1例,Ⅰ级);1型糖尿病1例(1.9%);免疫性肌炎1例(1.9%),Ⅰ级,激素治疗后好转。所有不良事件经过积极对症处理后均减轻或消失,无治疗相关性死亡(表3)。
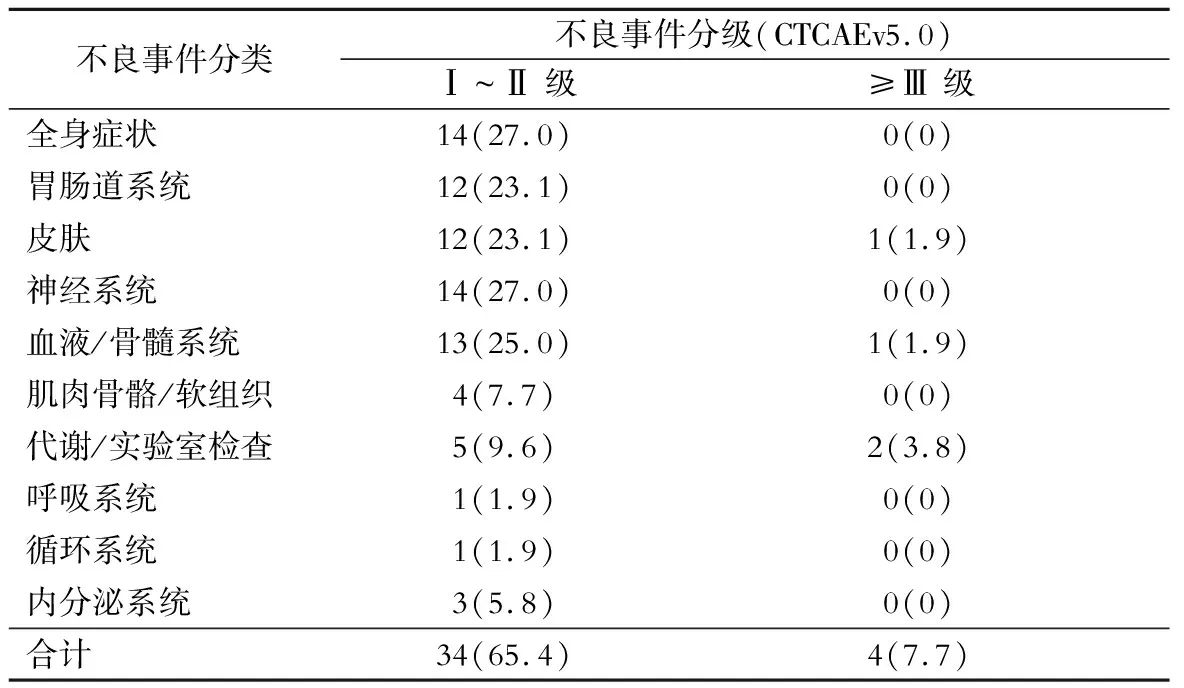
表3 治疗后不良事件情况[例(%)]
2.手术的安全性评价 52例手术病人术后中位首次肛门排气时间为3.5 d(1~8 d);中位首次排便时间为5 d(2~11 d);中位首次进流食时间为4 d(2~10 d);中位首次进半流食时间为6.5 d(5~18 d);中位术后住院时间为11 d(3~60 d)。21例(40.3%)病人发生术后并发症,发生Clavien-Dindo Ⅲ级以上并发症2例(3.8%),1例病人因肺部感染致呼吸衰竭、感染性休克,1例病人因基础心脏疾病,术后出现呼吸、心跳骤停。所有的术后并发症经过积极处理后均减轻或消失,无围术期死亡及非计划二次手术(表4)。
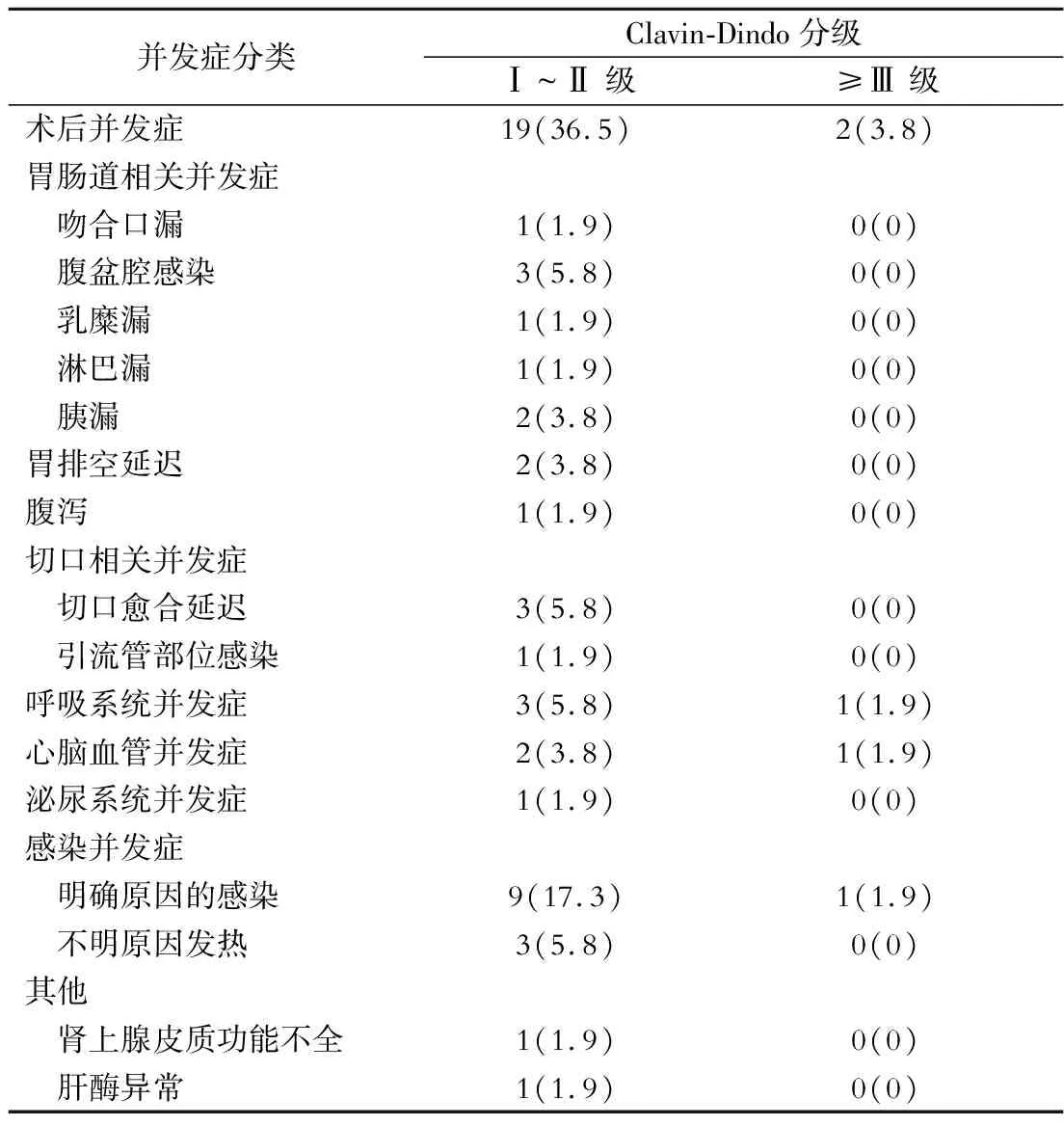
表4 术后并发症情况[例(%)]
3.术前治疗的疗效评价 52例病人的ORR为34.6%(18/52),DCR为94.2%(49/52),MPR的病人为19例(36.5%),pCR 12例(23.1%),其中错配修复缺陷(mismatch repair deficient,dMMR)或微卫星高度不稳定(microsatellite instability-high,MSI-H)的病人pCR率为30.0%(3/10),错配修复正常(mismatch repair proficient,pMMR)或微卫星稳定(microsatellite stability,MSS)的病人pCR率为23.7%(9/38)。
讨 论
随着越来越多的临床证据支持免疫治疗在晚期胃癌中的应用,胃癌围术期的治疗模式进入了新的探索阶段,免疫治疗开始从晚期向局部进展期前移。各个中心皆对免疫治疗在胃癌中的应用进行了积极的尝试与探索,通过本回顾性病例系列研究,可以明显观察到从2019年至2021年接受术前免疫治疗的病人数量在逐年增长(9例→17例→26例)。但即便同种治疗模式下,不同病人、不同医院的治疗方案纷繁复杂,涉及应用的免疫药物、联合的化疗方案、靶向药物乃至治疗周期不尽相同。如何在众多的治疗方案中进行选择,形成更为规范、标准和有效的治疗模式,有待进一步探索。
据既往的研究结果及临床观察,术前治疗的不良反应是很常见的,甚至是无法完全避免的。对于单纯免疫治疗,有研究表明[14],与常规治疗相比,PD-1/程序性死亡蛋白配体-1(PD-L1)抑制药治疗引起的治疗相关不良反应风险更小[RR=0.77, 95%CI(0.61,0.97),P<0.05],发生≥Ⅲ级的严重治疗相关不良反应的风险也更小[RR=0.44, 95%CI(0.27,0.73),P<0.01]。KEYNOTE-059研究[11]也揭示了相似的结果,帕博利珠单抗单药治疗的不良事件发生率为17.8%,≥Ⅲ级的不良事件发生率为4.6%。对于免疫联合化疗,CheckMate-649研究[5]结果显示,纳武利尤单抗联合化疗与单纯化疗组比较,≥Ⅲ级的不良事件发生率分别为59%和44%。而KEYNOTE-062研究[15]结果显示,帕博利珠单抗组、帕博利珠单抗联合化疗组、单纯化疗组≥Ⅲ级的不良事件发生率分别为17%,73%和69%。对于免疫联合化疗及靶向治疗,KEYNOTE-811研究[4]结果显示,帕博利珠单抗组(帕博利珠单抗+靶向药物+化疗)与安慰剂组(靶向药物+化疗)的不良事件发生率相似,≥Ⅲ级的不良事件发生率分别为57.1%和57.4%。而在本研究中,52例病人中发生≥Ⅲ级的不良事件发生率为7.7%,且没有出现治疗相关的死亡,提示术前接受免疫治疗的安全性尚可。较低的严重不良事件发生率可能得益于本中心对于术前治疗病人的规范化管理,住院总医师会收集病人每一化疗周期中的实验室检查,如有异常,会及时指导病人进行纠正,一定程度上避免了严重不良事件的发生。其次,回顾性分析的52例病人中部分病人初始治疗未在本中心进行,部分实验室结果及病人主观感受的记录存在缺失,某些不良事件或未能纳入分析。
作为外科医生,手术安全性始终是关注的焦点。术后并发症作为衡量手术安全性的重要指标,值得高度重视。在本研究中,免疫治疗后手术并发症的发生率为40.3%(21/52),≥Ⅲ级的严重并发症发生率为3.8%(2/52)。这一并发症发生率与我中心既往研究的结果类似[16]:术前行SOX(奥沙利铂联合替吉奥)化疗的病人术后并发症发生率为40.26%,严重并发症发生率为3.9%;而直接手术组病人的术后并发症发生率为32.3%,严重并发症发生率为4.1%,两组并发症发生率差异无统计学意义。术前接受免疫治疗未显著增加手术风险,安全性尚可。与此同时,在本研究中,免疫治疗后病人的术后恢复情况也较为理想,术后排气排便时间、进流食时间以及术后住院时间与新辅助化疗者相近,根据我中心既往研究结果提示[17-18],新辅助化疗后开腹与腹腔镜全胃切除病人术后中位首次排气时间分别为4(3~4)d,4(3~5)d;中位排便时间为5(4~7)d,6(4~7)d;中位进流食时间为6(3~7)d,6(4~8)d;中位术后住院时间为11(10~15)d;11(10~13)d。新辅助化疗后全腔镜与腹腔镜辅助胃切除病人术后中位首次排气时间分别为3(3~3)d,4(3.5~25)d;中位排便时间为5(4~5)d,5(4~6)d;中位进流食时间为4(3~5)d,6(4~6)d;中位术后住院时间为9(8~10)d;11(9~13)d。术前免疫治疗未显著延长术后恢复及住院时间,手术安全性尚可。
对于局部进展期胃癌,围手术期治疗(新辅助化疗+手术+辅助化疗)已经成为指南[19]推荐的标准治疗模式。新辅助化疗的方案也是多种多样的,对于cⅢ期非胃食管结合部癌,SOX方案已成为Ⅰ级推荐。除此之外,指南还推荐XELOX(奥沙利铂联合卡培他滨)、FOLFOX(奥沙利铂联合氟尿嘧啶)、SP(顺铂联合替吉奥)、FLOT(氟尿嘧啶、亚叶酸钙、奥沙利铂和多西他赛)方案等应用于术前化疗。尽管已有大量的研究证实新辅助化疗在肿瘤降期、提高R0切除率及改善整体生存方面有明显优势,但pCR率(4.6%~10%)[20-21]及5年生存率[22](20%~30%)仍不尽如人意。随着免疫治疗的兴起,多种方式的联合治疗也跃跃欲试,且已略见成效。对于单纯免疫治疗,KEYNOTE-059研究[11]结果提示,帕博利珠单抗单药ORR为11.6%(30/259),DCR为27.8%(72/259)。对于免疫联合化疗,ATTRACTION-4研究[23]结果提示纳武利尤单抗联合XELOX/SOX化疗的ORR为68.4%(26/38),DCR为86.8%(33/38)。对于免疫联合化疗及靶向治疗,KEYNOTE-811研究[4]结果显示,帕博利珠单抗组(帕博利珠单抗+靶向药物+化疗)的ORR为74.4%(99/133),DCR为96.2%(128/133);安慰剂组(靶向药物+化疗)的ORR为51.9%(68/131),DCR为89.3%(117/131)。根据本研究结果,术前免疫治疗的ORR为34.6%(18/52),DCR为94.2%(49/52),MPR为36.5%(19/52),pCR率为23.1%(12/52)。相对较低的ORR,可能是由于免疫治疗特殊的作用机制与目前应用的评价标准不能完全匹配所致。免疫治疗的作用机制决定了其疗效为特殊缓解模式,延迟反应、假性进展等现象的出现,对疗效评价和用药选择造成了困扰[24]。而目前我们进行疗效评价时,依然使用RESIST1.1的标准进行评价,这一标准主要以影像学上肿块大小变化为评判标准,因此临床疗效评价可能会出现偏差,正如在本病例系列里观察到的一样,部分术前疗效评价为SD甚至PD的病人,术后病理提示pCR。如何为免疫治疗时代的实体肿瘤提供一种全新的疗效评价模式,是我们接下来探索的方向。
本研究仍然存在不足之处:研究的整体样本量偏小;病人的治疗方案纷繁复杂,不同首诊单位选择免疫治疗的标准不统一,异质性较强;部分病人缺乏完整数据。随着免疫治疗的普及和推广,可以设计更为严谨的对照试验,进一步验证其优势。
综上所述,胃癌术前行免疫治疗具有较好的有效性及安全性,未显著增加手术风险,同时可获得较为理想的病理缓解率,可能是胃癌围术期安全、有效、可行的治疗模式,而更多高质量临床研究的开展,将有助于制定更为精准和个体化的治疗策略。
利益冲突所有作者均声明不存在利益冲突
