S-亚硝基海藻酸钠抗菌水凝胶的制备与表征
2022-04-22余达威涂晓亮田金环李立华
阳 星,刘 桥,余达威,涂晓亮,田金环,李立华
1. 暨南大学 材料科学与工程系/人工器官及材料教育部工程研究中心,广东 广州 511486
2. 江南大学 食品学院/江南大学食品科学与技术国家重点实验室,江苏 无锡 214122
海藻酸是一种由 α-L-古罗糖 醛酸 (G) 和 β-D-甘露糖醛酸 (M) 2种结构单元通过1,4-糖苷键连接而成的褐藻多糖。藻酸盐及其水凝胶具有良好的生物相容性,其中钙、钠、铵、钾盐被美国食品药品监督管理局认定为 GRAS (Generally recognized as safe,一般认可为安全 ),因此被广泛用于食品、抗菌及医用生物材料[1-4]。
一氧化氮 (NO) 是在生物体内履行各种重要功能的气体分子[5-7],具有维持内皮的天然功能,并可作为内源性血管扩张剂和血小板黏附激活的天然抑制剂[7-8]。此外,NO还可调节血压和血流量[9-11]、免疫反应[12-13]、骨骼代谢和中枢神经系统活动[14]。NO 在高浓度 (超过 1 μmol·L-1) 环境下,将诱导亚硝化和氧化应激,直接修饰膜蛋白,进行脂质过氧化,并破坏线粒体和细胞DNA[15]。这些过程可导致癌细胞和细菌坏死。因此,NO被认为是抗癌[16-19]和抗菌治疗[20-24]的潜在治疗剂。海藻酸能够吸收水体中的氨氮、硝氮、亚硝氮、磷酸盐等无机盐和尿素等有机物质所含的氮(N)、磷(P),并将其转化为自身的生物质成分。已有许多文献报道将其固定化用于对海水养殖废水的净化[25-28]。人体内存在大量S-亚硝基硫醇 (RSNO),如S-亚硝基白蛋白(SNO-Alb)、S-亚硝基血红蛋白 (SNO-Hb)、S-亚硝基半胱氨酸 (SNO-Cys) 及S-亚硝基谷胱甘肽(GSNO),反硝化反应将NO+官能团从RSNO转移到另一个现有的游离硫醇中,从而实现体内无限循环的NO供给。由于NO具有潜在的抗微生物和抗血栓形成功能,在过去的二十年中,释放NO新型聚合物的开发受到了关注。
本研究以我国盛产的褐藻多糖海藻酸为原料,利用半胱氨酸对其改性,引入活性巯基制备可原位成型的巯基化海藻酸钠 (SA-SH)。并进一步与NaNO2在pH 3.7下避光反应,制备S-亚硝基海藻酸钠 (SA-SNO)作为释放NO供体。最后将巯基化海藻酸钠 (SA-SH) 与S-亚硝基海藻酸钠 (SA-SNO)复合制得了SA-SH/SA-SNO复合水凝胶,并测定了该水凝胶释放、负载NO能力及抗菌性能,为进一步实现NO控释抗菌提供了依据。
1 材料与方法
1.1 材料与试剂
海藻酸钠 (SA, Mn=120~190 kD, M/G=1.56) 购于Sigma-Aldrich;L-半胱氨酸盐酸盐无水物 (LCysteine, 98%) 购于阿拉丁生化科技有限公司;1-乙基-(3-二甲基氨基丙基) 碳酰二亚胺盐酸盐(EDC.HCl, ≥99%) 购于上海笛柏生物科技有限公司;N-羟琥珀酰亚胺 (NHS, >99.5%) 购于广州硕恒生物有限公司;亚硝酸钠 (NaNO2, 99%) 购于上海迈瑞尔化学有限公司;5,5'-二硫双 (2-硝基苯甲酸)(DTNB, AR) 购于广州市云天生物技术有限公司;磷酸二氢钠(AR, 99%)、十二水合磷酸氢二钠(AR)、β-甘油磷酸钠水合物 (β-GP, 98%)、吗啉乙磺酸 (MES, 99%) 均购于麦克林生化科技有限公司;盐酸 (HCl, AR)、氢氧化钠 (NaOH, AR)、氯化钠 (NaCl, AR)、无水乙醇 (AR) 均购于广州斯佳生物科技有限公司;Griess试剂购于上海碧云天生物科技有限公司。
1.2 仪器与设备
SFG-02.400型电热恒温鼓风干燥箱 (黄石市恒丰医疗器械有限公司);ALPHA1-4/2-4/LS型冷冻干燥机 (德国Christ公司);HJ-6型磁力搅拌器 (金坛区西城新瑞仪器厂);EL104型电子天平 (翰强仪器制造有限公司);HH-W600B型数显恒温三用水箱 (常州朗越仪器制造有限公司);Equinox 55型傅立叶红外光谱仪 (德国Bruker公司);UV-2550型紫外可见分光光度计 (日本岛津);K-Alpha+型X射线光电子能谱仪 (Thermo Scientific公司)。
1.3 方法
1.3.1 S-亚硝基海藻酸钠抗菌水凝胶的合成
1) 巯基化海藻酸钠 (SA-SH) 的合成。按照质量浓度10 mg·mL-1在搅拌条件下缓慢溶解一定量SA粉末,并按浓度0.1 mol·L-1加入助溶剂吗啉乙磺酸 (MES)[29]。搅拌至溶解完全,依次往反应体系里加入一定量的EDC和NHS (EDC∶NHS∶COO-的摩尔比为1∶1∶1)。0.5 h后,按照摩尔比氨基比羧基为1∶1的量加入半胱氨酸盐酸盐无水物,半胱氨酸盐酸盐偏酸性,因此需要用氢氧化钠溶液(1 mol·L-1) 来调节pH至5~6。避光搅拌反应12 h后,将溶液装入透析袋 (φ=80 mm, 8 000~14 000 kD)中,用去离子水透析3 d,每12 h换一次去离子水。透析结束后将透析袋内溶液倒入培养皿中,于-20 ℃冰箱冷冻,然后放入冻干机冻干,即可得到SA-SH,最后于4 ℃条件下密封避光保存。
2) S-亚硝基海藻酸钠 (SA-SNO) 的合成。将2 g·L-1SA-SH水溶液置于冰浴中避光冷却至0 ℃左右,按巯基与亚硝基摩尔比为1∶2加入NaNO2搅拌。反应1.5 h后,在冰浴中使用透析袋 (φ=80 mm,5 000~8 000 kD) 避光透析12 h以除去未反应完的小分子。纯化后,先将透析袋内的SA-SNO溶液收集后放入-20 ℃冰箱冻结,再用冻干机冷冻干燥,得到SA-SNO并避光保存在0 ℃以下。
3) SA-SNO/SA-SH复合水凝胶的合成。称取0.12、0.11、0.10、0.08、0.06 g的SA-SH,分别与0、0.01、0.02、0.04、0.06 g SA-SNO 复合 (为方便表达,以下用 β-GP-1、β-GP-2、β-GP-3、β-GP-4、β-GP-5来表示这5个组分比例的水凝胶),加入3 mL去离子水,磁力搅拌下避光溶解,配成 4 g·L-1的水凝胶前驱液。滴加 58 g·L-1β-甘油磷酸钠水合物 (β-GP) 将溶液调至中性,然后倒入24孔板中,置于37 ℃恒温水浴箱中。8 h后取出,制得 β-GP-1、β-GP-2、β-GP-3、β-GP-4、β-GP-5 (图 1)。
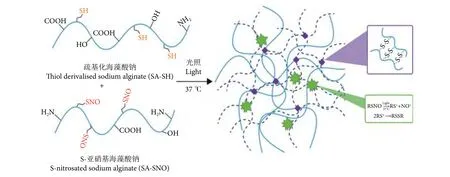
图1 疏基化海藻酸钠/S-亚硝基海藻酸钠复合水凝胶形成的示意图Fig. 1 Schematic diagram of SA-SH/SA-SNO composite hydrogel formation
1.3.2 紫外可见分光光度计表征
分别称取10 mg SA-SH和SA-SNO样品于装有10 mL PBS溶液的2支离心管中,振摇溶解后在37 ℃水浴箱中避光保温15 min以获得均匀的溶液。取出后立即用紫外可见光分光光度计在200~800 nm波长范围内进行扫描,记录波长与吸光度的关系图。
1.3.3 傅立叶红外光谱仪 (FTIR) 表征
取适量SA粉末,与KBr按照约1∶40的质量比加入研钵内研磨、混合均匀,取适量粉末用压片机压成透明的薄片,在FT-IR仪上进行透射扫描(扫描波数=4 000~500 cm-1)。分别取适量的SASH和SA-SNO冷冻干燥样品,直接进行全反射扫描 (扫描波数=4 000~500 cm-1)。
1.3.4 样品巯基含量测定
参照Ding等[30]方法,利用Ellman's试剂通过紫外可见分光光度计测定SA-SH和SA-SNO中游离巯基的含量。巯基的标准曲线绘制:精确称量适量的半胱氨酸无水物样品,并计算其巯基含量,再置于100 mL的容量瓶中,加水稀释成浓度为10 μmol·mL-1的半胱氨酸溶液。再从该溶液中精确量取2.5 mL置于25 mL容量瓶中,加入22.5 mL水配成1 μmol·mL-1的半胱氨酸溶液。接着分别精确量取 0.25、0.5、1.0、2.0、3.0 mL 的 1 μmol·mL-1的半胱氨酸溶液置于10 mL容量瓶中,并加水将其配成浓度分别为0、0.025、0.05、0.1、0.2、0.3 μmol·mL-1的半胱氨酸标准液。精确移取各浓度标准液2 mL于5 mL棕色离心管中,再各加入提前配置好的2 mL Ellman's试剂 [0.3 mg·mL-1DTNB溶液,溶质为5,5'-二硫双 (2-硝基苯甲酸),溶剂为pH=8.0的PBS溶液],室温下避光反应2 h。以不加半胱氨酸的标准液作为空白组,用紫外分光光度计测定各个浓度半胱氨酸标准液在450 nm处的吸光度。最后以浓度 (C, μmol·mL-1) 对吸光度(A) 进行线性回归,制定巯基的标准曲线。样品的巯基含量测定:分别称取冷冻干燥的SA-SH和SASNO样品10 mg (每个样品取3个平行样为一组)于15 mL离心管中,并加入2.5 mL去离子水振摇溶解,再加入 2.5 mL PBS溶液 (0.5 mol·L-1、pH=8.0) 和5 mL Ellman's 试剂,然后在室温下避光反应2 h,同时,用同样方法以不加样品的离心管为空白对照,在450 nm条件下,测定各离心管溶液的吸光度。最后根据绘得的标准曲线计算各样品游离巯基含量,最终结果以每1 g SA-SH和SASNO中巯基的量 (μmol)表示 (μmol·g-1)。
1.3.5 X 射线光电子能谱技术 (XPS) 表征
随机从SA-SH和SA-SNO样品膜上剪取3块5 mm×5 mm大小的样品,用X射线光电子能谱仪(XPS) 获得膜的XPS光谱。使用Avantage软件 (VG Science) 进行光谱分析。将饱和碳氢化合物的N1s峰设置为402 eV进行电荷校正,再将C1s、O1s和N1s峰的半峰值全宽分别固定在1.6、1.8和1.7 eV,并将高斯/洛伦兹比设置为50%对峰进行拟合分析。
1.3.6 水凝胶中NO实时释放速率与负载总量
水凝胶中NO释放速率测定[31]:将水凝胶样品 (200 μL) 浸入15 mL PBS的离心管中,密封后置于37 ℃的恒温水浴箱中,在设定的时间间隔对离心管进行采样50 μL,并在空气中暴露15 min,以产生亚硝酸盐。首先利用标准液制定出格里斯试剂的标准曲线:从4 ℃冰箱取出NO试剂盒,待恢复至室温后,按照说明书将标准样用PBS稀释为不同浓度待用。在96孔板中每孔加入50 μL标准样品再向其中分别加入50 μL Griess I和II,避光反应30 min,使用微孔板多功能检测仪测定其在540 nm 处的吸光度。收集并处理数据,得到 NO释放标准曲线。从水凝胶溶液中吸取50 μL上清液到96孔板中,每孔依次加入50 μL Griess I和50 μL Griess II,避光反应30 min,变色后用多功能酶标仪在540 nm处测定吸光度。根据Griess试剂标准曲线计算水凝胶中NO的释放量及释放速率。
水凝胶中NO负载总量测定:将水凝胶样品(200 μL) 浸入15 mL 37 ℃的PBS溶液中,再加热至90 ℃ 保温反应2 h。冷却至室温后,用PBS将水凝胶溶液稀释20倍,从稀释后的溶液中吸取50 μL上清液添加到96孔板中,然后依次加入50 μL Griess I和50 μL Griess II,避光反应30 min,变色后用多功能酶标仪在540 nm处测定吸光度。根据Griess试剂标准曲线计算水凝胶中NO的负载总量。
1.3.7 水凝胶抑菌性测试
利用细菌在琼脂板上扩散的方法来初步评价水凝胶对大肠杆菌 (Escherichia coli ATCC25922) 和金黄色葡萄球菌 (Staphylococcus aureus ATCC25923)的抑制效果。将细菌复苏培养至菌液在600 nm处吸光度达0.5,此时菌落数约为108CFU·mL-1。然后将菌液稀释100倍,取50 μL均匀涂布在琼脂板表面,将水凝胶放在琼脂板正中心。转移到37 ℃5%的二氧化碳 (CO2) 培养箱中培养24 h,观察抑菌圈的大小。
为进一步了解SA-SNO的杀菌过程,将β-GP-5水凝胶放入15 mL离心管中,每个离心管加入10 mL肉汤作为细菌营养液,以及50 μL细菌悬浮液和多个小玻片,用于扫描电镜观察。将细菌与水凝胶在37 ℃下培养2、6、12、24 h后将玻片取出,玻片表面用PBS洗涤2次以洗去肉汤等杂质,将表面附着细菌的玻片在20 ℃下用甲醛固定、乙醇梯度脱水后,通过扫描电子显微镜进行观察。
2 结果与分析
2.1 巯基化海藻酸钠的制备
海藻酸钠的重复结构单元糖环上含有特征官能团羟基和羧基。羧基可以在活化剂碳二亚胺偶联剂(EDC/NHS) 的作用下被活化,活化后可与L-半胱氨酸中的氨基发生缩合反应形成酰胺键继而形成巯基,具体合成路线见图2。
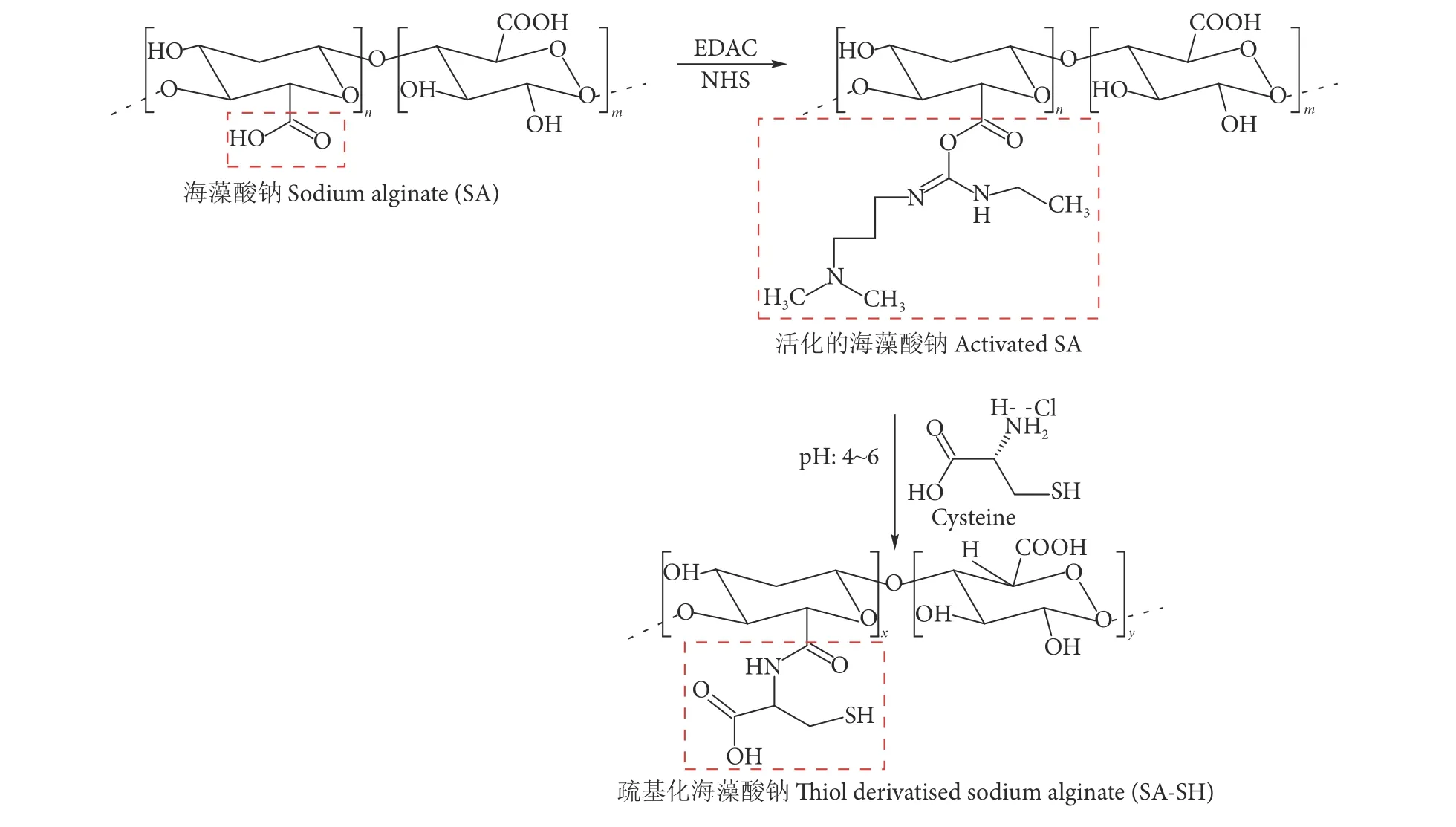
图2 疏基化海藻酸钠合成线路图Fig. 2 SA-SH synthetic circuit diagram
2.2 S-亚硝基海藻酸钠的制备
SA-SH (图3-b1) 与酸化的NaNO2在0 ℃下接触会立即生成SA-SNO[32],巯基和亚硝酸反应生成S-亚硝基,反应原理见图3-a。溶液由无色变为浅红色 (图3-b2),至深红色 (图3-b3)。
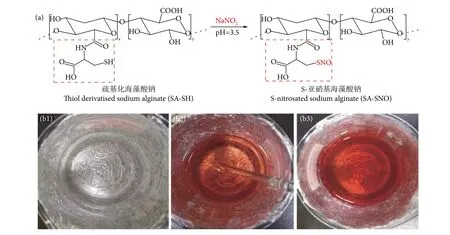
图3 S-亚硝基海藻酸钠的合成路线图 (a) 和巯基化海藻酸钠与亚硝酸钠反应实图 (b)Fig. 3 SA-SNO synthetic circuit diagram (a) and actual picture of reaction of thiolated sodium alginate and sodium nitrite (b)
2.3 紫外可见光谱分析
-SNO官能团具有特征性的UV-Vis光谱[33]。SA-SNO的紫外光谱在340和540 nm左右会有明显的特征峰,图4中343 nm处的峰表明S-NO键的n0→p*电子跃迁,545 nm处的峰表示N-π*电子跃迁。没有该官能团的巯基化海藻酸钠上则没有这些峰。这2个峰能表明S-亚硝基海藻酸钠主链上存在-SNO基团,即反应合成成功。
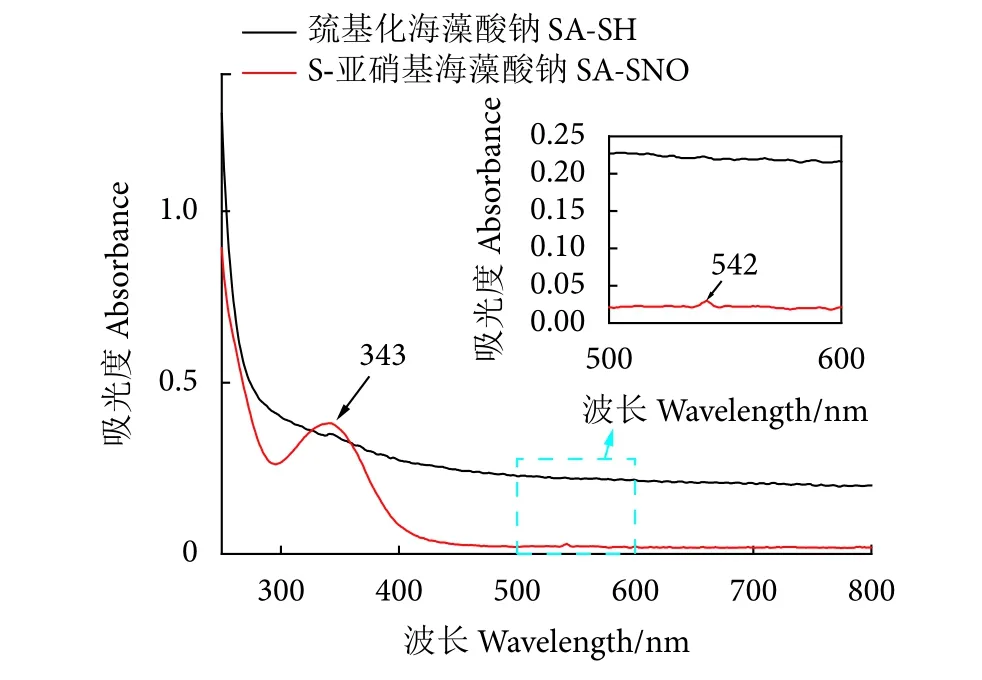
图4 巯基化海藻酸钠与S-亚硝基海藻酸钠紫外扫描图Fig. 4 UV-Vis diagrams of thiolated sodium alginate and S-nitrosated sodium alginate
2.4 FT-IR结果分析
对反应物SA和2种产物进行红外光谱分析,从FI-IR图5中可以看出,SA在1 595 cm-1出现的峰为海藻酸钠中羧基官能团的不对称伸缩振动峰,在1 409 cm-1处的吸收峰为海藻酸钠中羧基官能团的对称伸缩振动峰。当海藻酸钠经过改性成为巯基化海藻酸钠时,SA-SH则会在2 370 cm-1出现一个微弱的峰,这是巯基特有的特征。在1 698 cm-1处形成新峰,这是酯基的-C=O的伸缩振动造成的。同时,在1 602 cm-1和1 409 cm-1处的峰分别是酰胺I带的C=O伸缩振动峰和酰胺II带-NH面内弯曲振动峰,两者最大的差别就是经过巯基化改性,SA-SH在1 242 cm-1处形成了一个明显的新峰,该峰是酰胺III带-CN伸缩振动峰。通过对两者红外图谱的比较,SA-SH相比SA,无论是羧基的对称和不对称伸缩振动峰还是羟基的伸缩峰,峰的强度都发生了明显减弱,原因是SA进行巯基化改性时加入了活化剂,海藻酸钠的羧基被碳二亚胺偶联剂活化,被活化的羧基与L-半胱氨酸盐酸盐的氨基结合形成酰胺键,小部分羧基与海藻酸钠分子链上活化的羟基发生自交联形成酯键。而SA-SNO的红外谱图相比另外2个,所有峰的强度均出现了明显减弱,原因是巯基与亚硝酸钠反应,形成了亚硝基,图中1 396 cm-1-SN的伸缩振动峰很好地证明了这一点。

图5 巯基化海藻酸钠与S-亚硝基海藻酸钠红外谱图Fig. 5 Infrared spectra of thiolated sodium alginate and S-nitrosated sodium alginate
2.5 巯基含量测定结果分析
经过多次实验,通过数据处理得到L-半胱氨酸盐酸盐的游离巯基标准溶液曲线公式为:A=3.737 1×C-0.028 6,R2=0.999 9 (450 nm, 0.025≤C≤0.3 μmol·mL-1)。为了提高巯基含量,选用较优方法及配比,SA/L-cysteine (w/w) 配比为1∶1,海藻酸钠选用中黏度分子量样品。通过计算可得,所制备的SA-SH游离巯基质量摩尔浓度为 (348.06±4.25) μmol·g-1。而 SA-SNO 是由 SA-SH中的游离巯基改性得到的,所以游离巯基质量摩尔浓度大大降低,为 (158.96±0.56) μmol·g-1。
2.6 XPS结果分析
在SA-SH的XPS谱图中观察到了N1s峰 (402 eV),N元素百分比含量为3.33%,这是SA与半胱氨酸反应后形成的酰胺基的N元素量 (图6)。SASH反应生成SA-SNO后,分子上的半胱氨酸残基上又引入了-SNO基团,含氮量增加。在XPS图上我们也可以看到更强的N1s峰,N元素百分比含量提高至8.91%。
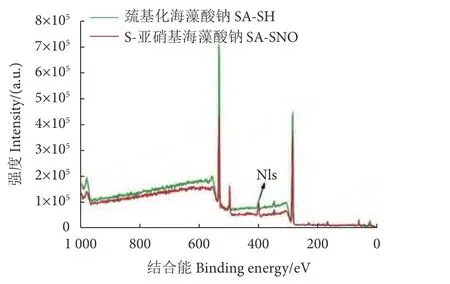
图6 巯基化海藻酸钠与S-亚硝基海藻酸钠XPS光谱图Fig. 6 XPS spectra of thiolated sodium alginate and S-nitrosoalginate sodium
2.7 水凝胶中NO实时释放速率与负载总量
NO的释放量可通过Griess测定法[34]确定。不含SA-SNO成分的水凝胶也不产生NO,随着SASNO在水凝胶中比例的增加,产物NO的量也随之增多 (表1)。Hasan等[35]报道的 NO总释放量为(0.23±0.006) μmol·mg-1,本实验中最好样品 (水凝胶5号样) 释放的 NO 总量为其116%,NO负载量增加较多。
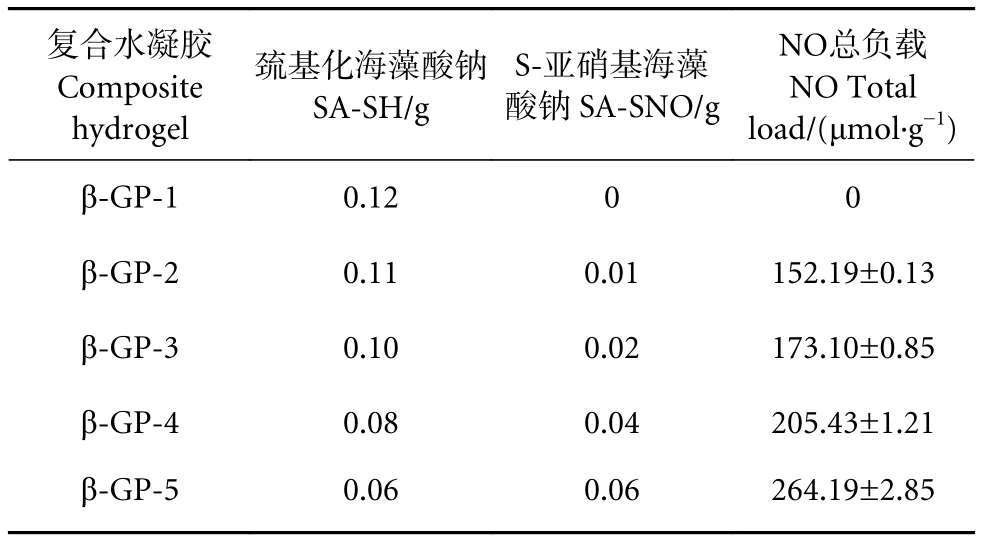
表1 水凝胶中一氧化氮的总负载量Table 1 Total loading of NO in hydrogel
在120 h内,含不同-SNO量的水凝胶均迅速释放NO,10 h后达到顶峰,之后逐渐衰减,4 d后趋于平缓,释放速率为 10~20 μmol·(g·h)-1(图 7)。其中高含量的SA-SNO水凝胶在120 h后依然有较高速率的 NO 释放,为 30.12~44.32 μmol·(g·h)-1。因此,SA-SNO的初始浓度是决定水凝胶NO释放速率的一个重要因素。SA-SH/SA-SNO水凝胶降解SNO生成NO的反应性随初始-SNO含量的增加而增大。这种现象与Maragos等[36]的研究结果一致,后者观察到-SNO中NO的释放速率与其初始浓度成正比。在热激发 (37 ℃) 或光的作用下,GelSNO分解生成噻吩基和NO [(反应 (1)]。新产生的噻吩基与GelSNO反应形成二硫键和NO [反应 (2)]。同时,噻吩基与氧反应生成过氧自由基[反应 (3)]。这些过氧自由基与GelSNO连续相互作用,生成NO和GSSG [反应 (4)]。总体而言,初始浓度较高的GelSNO会产生大量的硫代自由基,从而增加了NO的产生。
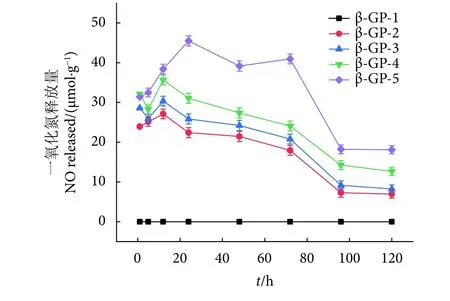
图7 水凝胶120 h内一氧化氮实时释放曲线Fig. 7 Real-time release curve of NO from hydrogels in 120 h

2.8 水凝胶抑菌性分析
水凝胶能被用作伤口敷料,主要原因是其具有杀灭或抑制细菌的能力,从而避免外界细菌感染并促进伤口愈合[3]。利用抑菌圈实验研究了水凝胶对大肠杆菌和金黄色葡萄球菌的抑制效果 (图8)。随着S-亚硝基浓度的增加,抑菌圈直径逐渐增大,表明抑菌效果不断增强。此外,扫描电镜图可进一步观察到水凝胶的杀菌过程。首先,与水凝胶共培养1 h后,大肠杆菌呈棒状 (图9-a),金黄色葡萄球菌呈圆形 (图9-e),均显示出光滑的细胞膜。随着共培养时间的延长,水凝胶开始持续释放NO,细菌受到抑制,其形态发生了变化。在培养6 h后的细菌扫描图中,大肠杆菌开始收缩 (图9-b),金黄色葡萄球菌个体变小,表面出现破损 (图9-f)。培养12 h后的细菌扫描图 (图9-c、图9-g) 显示,两种细菌的细胞膜发生破裂、变形,细菌开始干瘪、爆裂分解。培养24 h后 (图9-d、图9-h),只有细菌破裂的残骸。这些变化表明,大肠杆菌和金黄色葡萄球菌的膜被破坏,导致细胞死亡,最后细菌被灭杀破裂。相对而言,水凝胶对阳性的金黄色葡萄球菌显示出了更好的抑菌效果,这可能与NO抗菌作用机理相关。有研究表明NO破坏了细菌生物膜,导致大量基质外泄,造成细菌死亡[37],也有研究认为NO能通过抑制细胞呼吸、减少细胞外膜蛋白的合成或抑制细胞壁的形成等机制杀菌[38],目前尚未有定论。
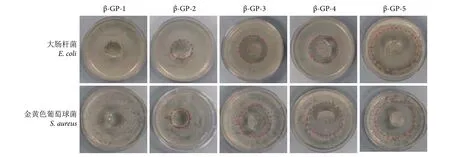
图8 水凝胶的抑菌圈测试Fig. 8 Inhibition zone test of hydrogels
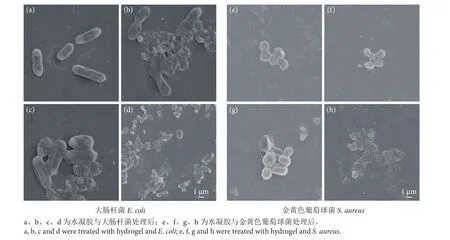
图9 与水凝胶共培养1、6、12、24 h的细菌形貌Fig. 9 Morphology of bacteria co-cultured with hydrogel for 1, 6, 12, 24 h
3 结论
本研究以生物相容性良好的海藻多糖原料——海藻酸钠为基体,制备了可原位成型的巯基化海藻酸水凝胶以利于无规则创面的使用,设计了一个简便高效的方法合成NO供体——SA-SNO。通过将2种改性胶复合成功地开发出可释放NO的SA-SH/SASNO抗菌水凝胶。水凝胶NO释放实验显示水凝胶供体在生理条件下具有优良的NO释放性能,控制反应条件和反应物SA-SNO的量,可以在10×nmol到μmol范围内调节水凝胶NO的释放,对革兰氏阳性和阴性细菌均表现出显著的杀菌效果。本研究还存在一些问题,如未确定材料的具体杀菌机制,作为抗菌促修复伤口敷料,其生物相容性还需进一步探讨。但总的来说,由于该水凝胶可持续释放较高含量的NO且具有显著的杀菌效果,有望作为抗菌敷料,在伤口感染治疗和组织修复方面具有较好的应用前景。
