鳕鱼皮源医用复合止血敷料的制备及性能研究
2022-04-22李昭璇李八方
宋 雪,刘 晗,李昭璇,李八方,侯 虎,
1. 中国海洋大学 食品科学与工程学院,山东 青岛 266003
2. 青岛海洋科学与技术试点国家实验室,山东 青岛 266237
止血敷料常用于伤口的基础治疗,以达到快速止血的目的。然而传统的止血敷料存在很多问题,例如材料来源单一、止血时间较长、易粘连伤口、体内降解性较差、力学性能较差等,已不能满足伤者们的紧急医疗需求[1]。因此,针对传统医用敷料的局限性,开发一种具有良好机械性能、保水性能和止血性能的新型可吸收医用敷料,成为目前生物医学材料领域研究的热点和难点之一[2]。目前,常用的止血材料包含以下几种:1) 沸石类敷料,具有多孔结构,能够迅速吸收血液中的水分促进凝血,但容易引发炎症反应;2) 氧化纤维素类敷料,通过羧基与血红蛋白中的铁离子形成凝胶状物质进行止血,但在过程中产生的酸性环境会引起神经损伤;3) 明胶、胶原和多糖类敷料,生物相容性较高,具有较高的止血活性,是目前研究的热点,但单独使用时存在机械性能较差、易脱落等缺点。因此,本研究考虑将不同的天然高分子材料进行共混交联,改善单一材料的局限性,并发挥其在止血性能中的复配协同作用[3]。
明胶作为一种可吸收的天然生物材料,因具有生物相容性、生物降解性、低免疫原性而受到广泛关注[4]。明胶具有良好的止血活性,能够吸收大量血液,并能激活血小板的附着和凝血因子释放,封闭创面伤口实现快速止血[5]。目前,牛或猪来源的明胶止血海绵已应用于外科手术之中[6]。太平洋鳕(Gadus macrocephalus) 是世界上重要的经济鱼类,从鳕鱼皮副产物中提取明胶可以避免陆地源疾病和宗教的影响,避免资源浪费和环境污染。但纯明胶海绵存在机械性能较差、易破损、难止住大伤口出血等缺点,所以要获得高性能的明胶止血产品,需将其与其他类型的止血材料复配进行改性[7-9]。褐藻来源的海藻酸钠是一种由β-1,4-d-甘露糖醛酸和α-1,4-d-古洛糖醛酸构成的天然线性共聚物[10],具有生物降解性好、生物相容性高和易于进行化学改性的优点,且具有止血活性以及易于形成凝胶的性质,可以作为明胶复配的良好选择[11]。已研究开发出明胶海藻酸钠水凝胶支架用于骨组织缺损修复[12]和细胞迁移[13],但对其复合材料的止血效果尚未探究。
本研究将鳕鱼皮源明胶与海藻酸钠进行共混并交联,制备出一种具有良好机械性能和止血活性的可吸收型复合止血敷料。通过测定该复合止血敷料的力学性能、结构特征等指标从而确定其制备的最佳工艺条件,并评价了该敷料的止血性能、生物相容性,初步探究了其止血机制,为新型止血医用材料的开发提供重要参考及理论依据。
1 材料与方法
1.1 材料
太平洋鳕冷冻鱼皮由青岛浩源有限公司提供;戊二醛和十二烷基硫酸钠 (SDS) 购自Sigma有限公司;其他试剂均为分析纯,购自国药化学试剂有限公司。
市售鳕鱼皮明胶购自青岛东易科技有限公司;市售明胶海绵购自江西祥恩医疗科技发展有限公司;活化部分凝血酶时间 (Activated partial thromboplastin time, APTT)、凝血酶原时间 (Prothrombin time, PT) 和凝血酶时间 (Thrombin time, TT) 检测试剂盒,血栓烷素B2(TXB2)、血小板第四因子(PF4) 和P-选择素检测试剂盒购自南京建成生物工程研究所;Wistar大鼠 (210±10) g购自山东鲁抗医学质量检验中心实验动物中心。
1.2 鳕鱼皮明胶的制备
太平洋鳕鱼皮明胶的制备参考Hou等[14]的方法。解冻清洗后的小块鳕鱼皮经0.1 mol·L-1的氢氧化钠 (NaOH) 溶液 (质量体积比1∶25) 和0.1 mol·L-1的盐酸 (HCl) 溶液 (质量体积比 1∶25)浸泡处理后,冲洗至中性。将充分溶胀的鱼皮放入锥形瓶中,在55 ℃的条件下水浴摇床振荡提取4 h。提取液经过滤、旋转蒸发后冻干得到鳕鱼皮明胶。
1.3 聚丙烯酰胺凝胶电泳 (SDS-PAGE)
采用Laemmli[15]的方法配置7.5%分离胶和5%浓缩胶,电泳采用直流恒压电源,电压100 V,跑至距离胶边缘约1 cm处。将胶置于考马斯亮蓝R-250中染色10~15 min,随后用脱色液脱色过夜。
1.4 医用复合止血海绵的制备
将 1、5、10、15、20 mg·mL-1的明胶溶液按体积比15∶8与海藻酸钠溶液混合,在混合溶液中加入戊二醛溶液作为交联剂,于4 ℃静置24 h进行交联。真空脱气15~30 min后,溶液倒入不锈钢平板中,于-40 ℃下预冻12 h,冷冻干燥后得到鳕鱼皮明胶复合止血敷料。
1.5 理化特征
1.5.1 吸水性
将敷料剪成1.0 cm3的立方块,准确称量记为w0。室温条件下,浸没于蒸馏水中充分吸水,随后用镊子将其轻轻提出水面,放置在滤网中除去表面多余的水,再次精确称量记为w1。3次测量,取平均值。吸水倍数的计算公式为[16]:
式中:w0为海绵干质量 (g);w1为海绵湿质量 (g)。
1.5.2 持水力
在测定吸水率的基础上,将膨胀状态下的海绵进行离心。离心后海绵的质量为w2。持水力计算公式为[17]:
式中:w0为海绵的干质量(g);w1为海绵的湿质量(g);w2为排水后海绵的质量 (g)。
1.5.3 交联度
取敷料3~5 mg加入1 mL 碳酸氢钠 (NaHCO3)溶液和1 mL 三硝基苯磺酸 (TNBS) 溶液 (5 mg·mL-1),40 ℃ 反应 2 h。随后加入 3 mL 6 mol·L-1的HCl溶液,60 ℃反应90 min。溶液经去离子水稀释至5 mL,测定其在345 nm处的吸光值。吸光值与游离氨基数存在以下关系[18]:
式中:[NH2]为赖氨酸侧链ε-氨基含量;A为吸光度;V为溶液体积(mL);ε=14.600;l为路径长度(cm);m为样品的质量 (mg)。
根据以下公式计算交联度 (%):
式中:[NH2]为游离氨基质量摩尔浓度 (mol·g-1),下标m和n分别表示交联和无交联样品。
1.5.4 机械试验
将制备好的敷料剪成适当大小,两端固定在拉力机上,初始距离为15 mm,测试速度为60 mm·s-1,力度为300 N[19]。每组样品平行测试9次。
抗张强度 (MPa)的计算公式为:
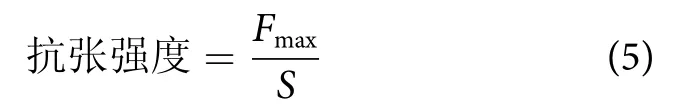
式中:Fmax为样品断裂瞬间的最大张力 (N);S为样品的横截面积 (mm2)。
断裂伸长率的计算公式为:
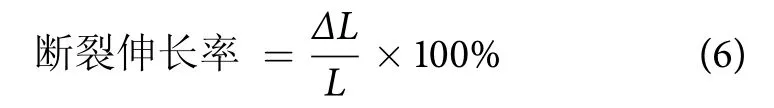
式中:ΔL为样品断裂时延伸的位移 (mm);L为标距 (mm)。
1.6 体内止血评价
1.6.1 股动脉模型
大鼠麻醉后,暴露其右侧股动脉并于相同位置处切开,然后迅速将复合止血敷料覆盖在出血部位,施加连续压力,每15 s观察1次。以无菌纱布和市售明胶海绵作为对照,分别记录止血时间。
1.6.2 肝损伤模型
麻醉大鼠后,打开腹腔,暴露出肝脏中叶,从肝脏尖端1 cm处进行切割,制备肝脏出血模型。其余操作同上,分别记录止血时间。
1.6.3 尾部模型
大鼠的尾部用75%乙醇消毒,在尾部的1/3处拉直并切割。其余操作同上,分别记录止血时间。
1.7 APTT、PT、TT 分析和 TXB2、PF4、P-选择素检测
APTT、PT、TT分析分别按照相应检测试剂盒的说明书测定。血小板活化因子检测按照TXB2、PF4和P-选择素检测试剂盒的说明书测定。
1.8 生物相容性评价
参考GB/T 16886.11—2011《医疗器械生物学评价第11部分:全身毒性试验》进行全身急性毒性试验;参考GB/T 16886.10—2017《医疗器械生物学评价第10部分:刺激与皮肤致敏试验》进行刺激性试验;参考GB/T 16886.4—2016《医疗器械生物学评价第4部分:与血液相互作用试验选择》进行溶血试验。
1.9 统计分析
数据采用单因素方差分析 (One-way ANOVA)进行处理,并采用独立样本t检验进行分析。数值数据用“平均值±标准差()”表示,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 SDS-PAGE图谱分析
采用SDS-PAGE对自提鳕鱼皮明胶样品和市售明胶的亚基成分进行了分析。自提鳕鱼皮明胶由3条α链 (α1,α2和α3) 和1条β链构成,与斑点叉尾鮰 (Ictalurus punctatus) 和胡鲶 (Clarias gariepinus)皮中提取的明胶结构类似[20-21],具有典型的Ⅰ型胶原蛋白电泳条带特征 (图1) 。α链分子量在100~135 kD,由于α1和α3分子量十分接近,所以在SDS-PAGE凝胶上形成一个难以区分的条带。自提鳕鱼皮明胶β链的分子量约为245 kD,但在市售明胶的电泳图谱中没有观察到清晰的条带。根据SDSPAGE结果推断出鳕鱼皮明胶是由Ⅰ型胶原蛋白变性得到的,与市售明胶对比,自提鳕鱼皮明胶样品条带清晰,几乎没有降解,可以作为医用止血敷料的主要材料。
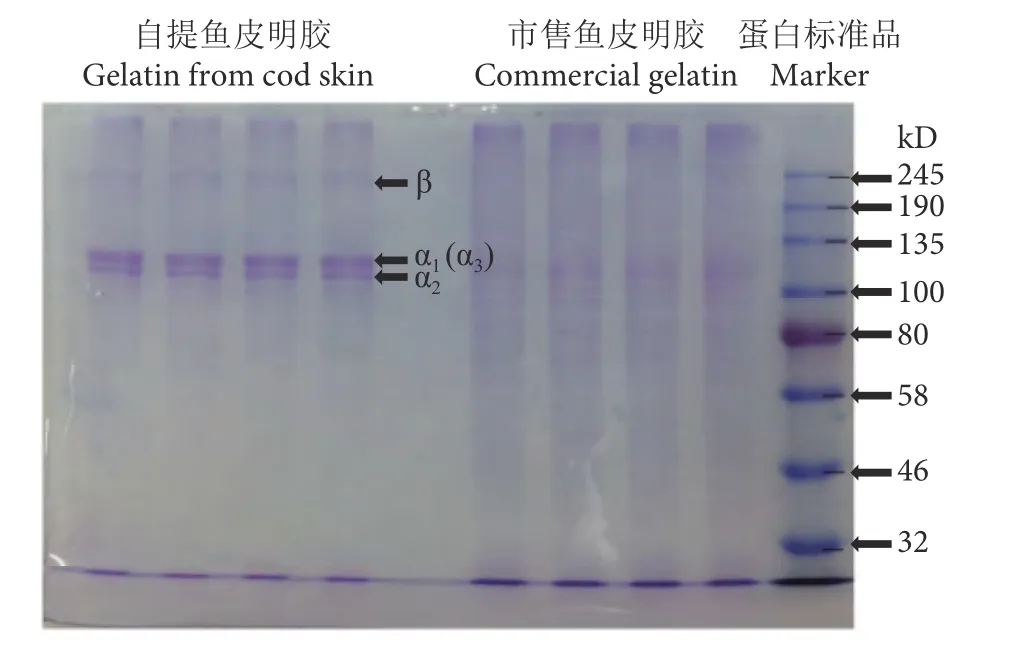
图1 鳕鱼皮明胶的SDS-PAGE电泳图Fig. 1 SDS-PAGE patterns of Pacific cod skin gelatin
2.2 不同明胶浓度对止血敷料理化表征的影响
不同明胶浓度对复合止血敷料理化性能的影响见表1。随着明胶浓度的增加,复合敷料的抗张强度从 (0.010 0±0.003 7) MPa提高至 (0.085 9±0.003 6) MPa,断裂伸长率从 (7.54±0.37)%下降到(1.36±0.30)%。明胶质量浓度超过10 mg·mL-1时,其抗张强度间无明显差异 (P>0.05),而断裂伸长率则随着明胶浓度的增大而逐渐减小,说明随着明胶浓度的增大,复合止血敷料的脆性和硬度增加,导致延伸性受到较大影响。如果敷料的机械强度较差则不能抗击血液冲击,容易造成二次出血,因此机械强度是衡量敷料质量的一个重要指标。
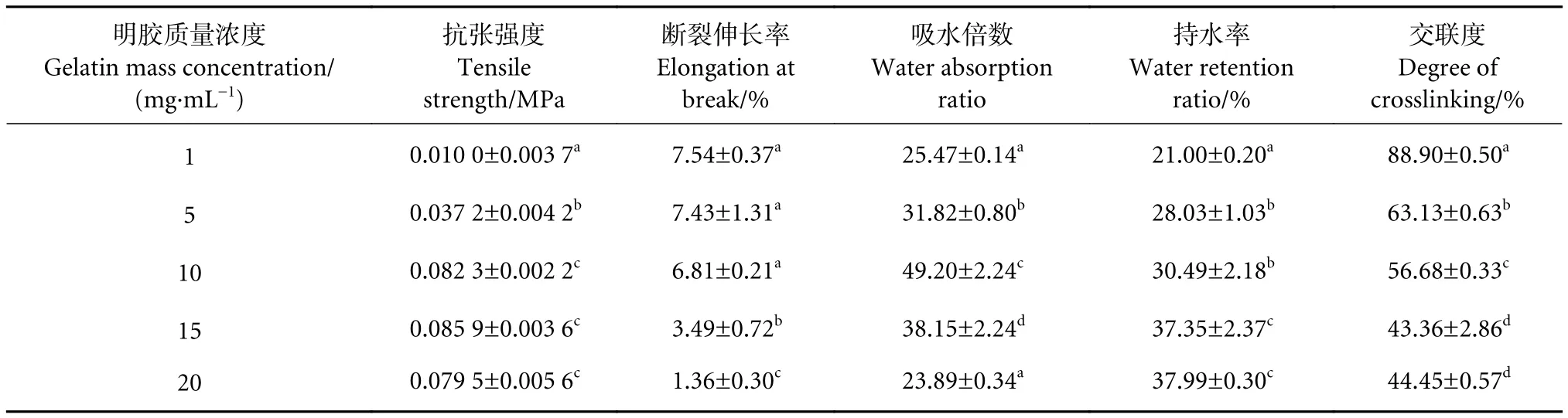
表1 不同明胶浓度对复合止血敷料理化性能的影响Table 1 Physical and chemical properties of composite hemostatic sponge with different gelatin concentration
因为敷料需要吸收大量的伤口渗出物,防止细菌入侵伤口,因此吸水性和持水性是其理化性质的重要指标。吸水性的变化趋势与抗张强度相同,明胶质量浓度为10 mg·mL-1时,取得最大倍数(49.20±2.24),高于王运智[22]通过冷冻干燥法和自组装法得到的鱼皮胶原止血海绵的吸水倍数(33.6和11.9)。明胶海绵的高吸水性使其在应用时可吸附大量血液,从而对渗血表面造成局部压迫,达到止血目的。持水性则随着明胶浓度的增加从(21.00±0.20)% 升至 (37.99±0.30)%。当明胶质量浓度低于10 mg·mL-1时,敷料微观结构比较松散,吸水后无法保持较为完整的形状。当明胶质量浓度为20 mg·mL-1时,敷料结构过于紧密,孔隙较小,导致吸水性能下降但持水率较高。
戊二醛可以与明胶中赖氨酸和羟基赖氨酸残基的自由氨基反应形成席夫碱型化合物,还可以与海藻酸钠阴离子结构表面的羟基发生交联反应。交联度随着明胶浓度的增大而减小,明胶质量浓度超过10 mg·mL-1时变化不大 (P>0.05)。这说明在明胶浓度较低时,暴露出的交联位点能够完全被戊二醛利用,随着明胶浓度的增加,所能交联的位点是有限的,所以交联度逐渐趋于稳定。
综上所述,明胶质量浓度为10 mg·mL-1时,医用复合止血敷料具有良好的物理性能,有利于快速吸收渗出物和血浆,加速凝血过程。
2.3 大鼠股动脉模型、肝损伤模型及尾部模型的止血效果
断尾止血实验过程见图2-a。与自然止血组的(485±11) s相比,实验组和市售明胶海绵组均能明显缩短断尾止血所用时间(P<0.01),且实验组止血时间要短于市售明胶海绵组(P<0.05)。肝创面模型的实验过程见图2-b,止血指标的结果表明(图2-d),实验组止血时间为 (108±4) s,短于罗非鱼 (Oreochromis mossambicus) 鱼皮胶原海绵 (131 s)[22]。股动脉模型的实验过程见图2-c,切开动脉,立刻有大量血液涌出且压力较大,对止血敷料的要求较高,自然止血组无法在一定时间完成止血。实验组的止血时间为 (64±9) s,明显优于市售明胶海绵组的 (87±9) s (P<0.01),说明实验组对出血量大、压力强的动脉出血有一定的控制作用。
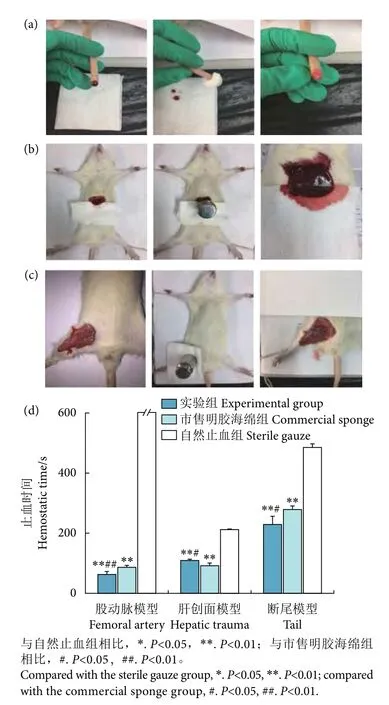
图2 复合止血敷料的止血性能评价Fig. 2 Hemostatic evaluation in vivo with different model
结果表明,明胶复合止血敷料的吸水性和多孔结构有利于血液的吸收,同时明胶与海藻酸钠起到了复配协同止血效果[23]。Wang等[24]制备了含海藻酸钙多孔微球的壳聚糖复合海绵,与纯壳聚糖和凝胶海绵相比,可以缩短止血时间、减少失血量。因此,将海藻酸钠共混到明胶中,可促进血小板黏附和各种凝血因子的活化[25]。复合止血敷料在吸收组织渗出液后转变为凝胶形态,可以持续为伤口提供潮湿环境,促进伤口愈合。
2.4 APTT、PT、TT分析和血小板活性因子检测
APTT是内源凝血系统较为敏感和最为常用的筛选指标,PT测定是外源性凝血系统的筛选实验,TT是指在血浆中加入标准化的凝血酶后血液凝固的时间。因此,试验采用APTT、PT和TT分析方法探讨明胶复合止血敷料诱导的凝血途径。与阴性对照组相比,实验组在第5、第15、第30和第60 分钟4个不同浸提时间点的APTT均有极显著降低(P<0.01,图3-a),说明内源性凝血系统是明胶复合止血敷料的主要凝血途径。据报道,海藻酸钠的凝胶网络结构可以为血细胞提供支持,吸收大量的血液,激活伤口附近的凝血因子,诱导凝血的内部通路[25]。复合止血敷料和市售明胶海绵对PT无显著影响 (图3-b),表明它不刺激外源性的凝血途径。明胶复合止血敷料和市售明胶海绵在第5、第15和第60分钟时TT显著降低(P<0.01,图3-c),通过缩短凝血接触活化时间实现快速止血。Li等[26]证实,明胶微球能有效诱导红细胞聚集,改善凝血时间。Zhang等[27]发现壳聚糖/硅藻-生物硅复合海绵通过激活内源性凝血途径加速了凝血。因此,明胶复合止血敷料可激活内源性凝血途径和共同凝血途径,缩短血液凝固接触活化时间,活化Ⅷ、Ⅻ、Ⅺ等凝血因子,达到快速止血的目的。
对血小板活性因子TXB2、PF4和P-选择素的含量进行测定,可以判定明胶复合止血敷料对血小板黏附、聚集和活化等生理功能的作用,结果见图3-d—3-f。与对照组相比,其他各组均能显著增加血小板活性因子的释放量 (P<0.05),从而快速有效激活血小板。此外,浸提时间的长短并不影响血小板活性因子的释放。
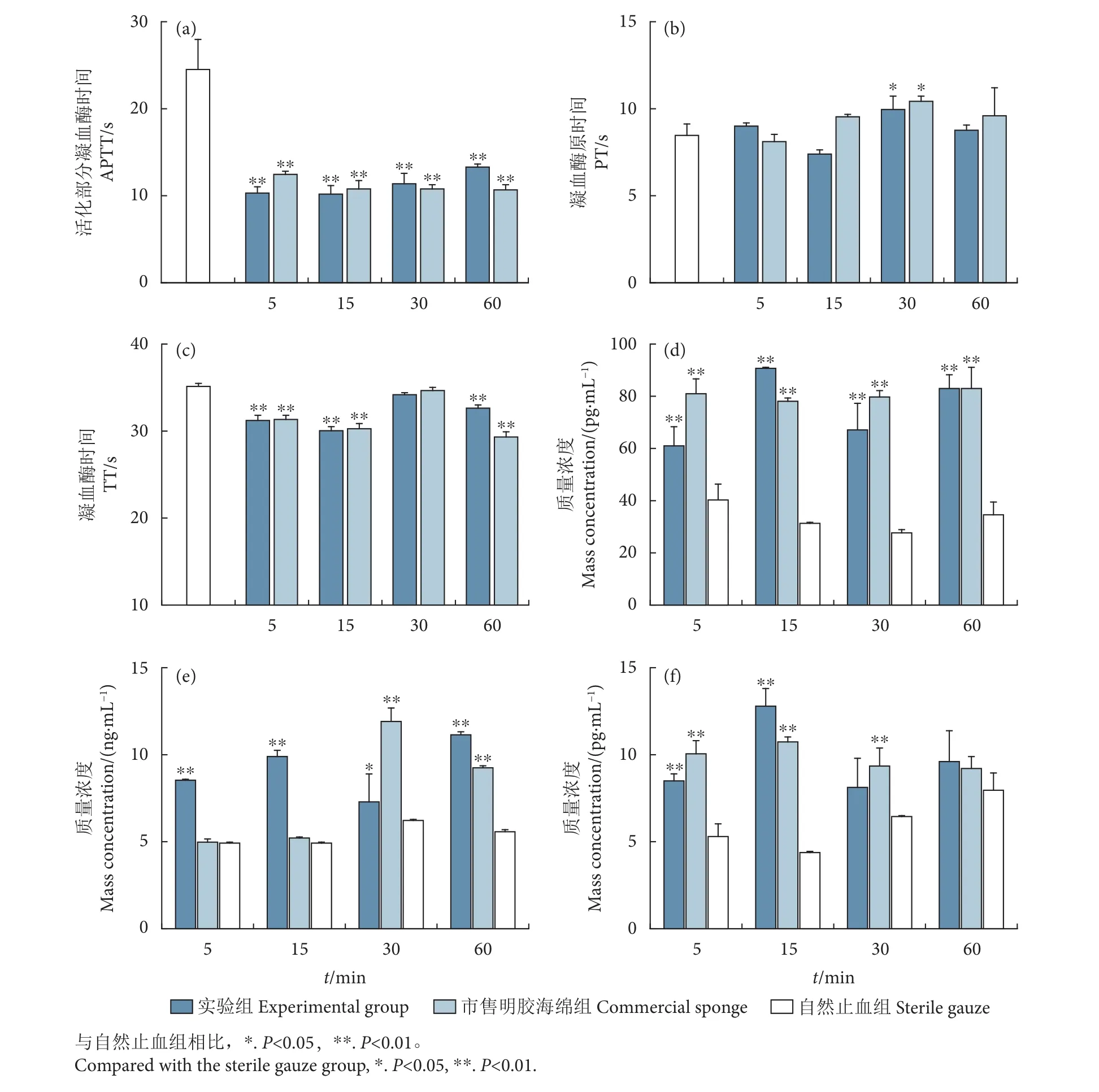
图3 不同样品对活化部分凝血酶时间、凝血酶原时间和凝血酶时间血小板活性释放因子血栓烷素B2、血小板第四因子和P-选择素的影响Fig. 3 Effect of different samples on APTT, PT, TT and release of platelet active factors (TXB2, PF4 and P-selection)
综上所述,复合止血敷料在两方面表现出有效的止血能力:1) 复合止血敷料具有适当尺寸和分布均匀的三维网络多孔结构,使其具有快速的液体吸收性和良好的机械性能;2) 明胶海藻酸钠复合敷料能够激发内源性凝血途径和共同凝血途径,加速各种凝血因子的释放从而加速凝血[28]。
2.5 生物相容性评价
急性全身毒性试验是生物安全评价的一个重要指标,通常用于评价生物医学材料或其浸出液对人体的影响[29]。对大鼠注射后的日常活动、存活状况和中毒情况进行观察,发现实验组及阴性对照组的大鼠在观察期72 h内,无任何中毒症状发生,而阳性对照组则在注射后随即出现明显的震颤和惊厥反应,活动量和爬行速度明显下降。注射后72 h内各组大鼠的平均体质量见表2,实验组和阴性对照组的大鼠体质量变化均呈稳步增长趋势,说明制备的鳕鱼皮明胶复合止血敷料无急性毒性,符合医用材料全身急性毒性的评价标准。
采用皮肤刺激试验和皮内刺激试验评价明胶医用敷料的刺激效果。相较于b处阳性对照组出现严重的皮肤变红以及组织肿胀等刺激现象,a、d处的实验组浸提液并未引起任何的皮肤刺激问题,注射后72 h内皮肤状态均表现良好,与c处的阴性对照组结果一致,说明鳕鱼皮明胶复合止血敷料对皮肤无潜在刺激作用 (图4)。受损皮肤刺激实验的结果见表2,实验组部分大鼠出现轻微红斑,但24 h后消失。复合止血敷料的原发性刺激指数(PII) 为0.22,小于0.5,属于极轻微刺激性,制备的明胶复合止血敷料符合生物材料单次接触皮肤试验标准。
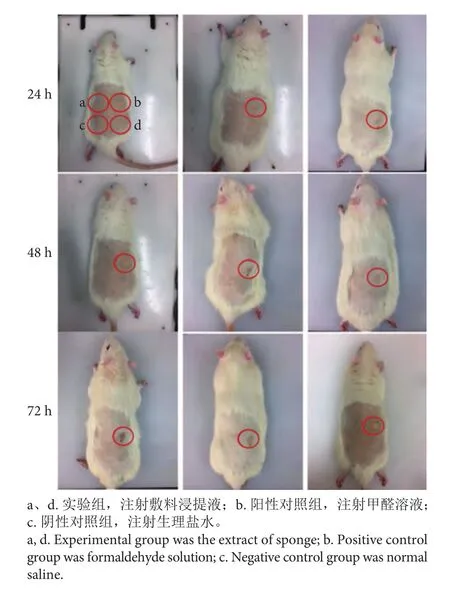
图4 注射24 h、48 h和72 h后的皮内刺激情况Fig. 4 Intradermal stimulation at 24th, 48th and 72nd hour after injection
溶血率是血液与材料相互作用的体外评价标准[30]。GB/T 16886指出材料与血液接触时红细胞的破裂率不宜过高,即溶血率低于5%的材料才具备良好的血液相容性。本实验测定的鳕鱼皮明胶复合止血敷料的溶血率为1.51%,低于5% (表2),符合国家生物材料评价规定的安全范围。

表2 急性全身毒性试验、皮肤刺激试验和溶血试验结果Table 2 Results of acute systemic toxicity assay, dermal irritation test and hemolysis ratio
生物材料进入临床的必要评价是生物安全性评价,综上所述,鳕鱼皮明胶复合止血敷料符合国家医疗器械相关标准,为其临床应用提供了安全性理论依据。
3 结论
本文以鳕鱼皮为原料提取明胶,并通过SDSPAGE对其亚基结构进行研究。在交联剂作用下将鳕鱼皮明胶与海藻酸钠进行复配,冷冻干燥得到复合止血敷料。该复合敷料具有良好的机械性能、吸水性、持水性和均一的多孔网络结构,符合伤口海绵的要求。明胶复合止血敷料可以明显缩短APTT和TT,激活内源性凝血途径和共同凝血途径,还可以明显增加TXB2、PF4和P-选择素的释放量,通过激活血小板来加速凝血过程。此外,一系列的生物相容性实验表明,复合止血敷料无全身急性毒性,不会引起红斑、水肿等皮肤刺激现象,溶血率为1.51%,符合国家医疗器械标准 (<5%)。因此,鳕鱼皮源明胶复合止血敷料可作为一种新型可吸收医用敷料应用于组织工程之中。
