枯草芽胞杆菌HMB19198在番茄叶片上定殖能力的分子检测
2022-04-22刘晓萌苏振贺宣立峰王培培董丽红郭庆港
刘晓萌,苏振贺,宣立峰,王培培,董丽红,郭庆港*,马 平
(1. 河北省农林科学院植物保护研究所/河北省农业有害生物综合防治工程技术研究中心/农业部华北北部作物有害生物综合治理重点实验室,保定 071000;2. 河北省农林科学院石家庄果树研究所,石家庄 050061)
由灰葡萄孢菌Botrytis cinerea引起的番茄灰霉病在设施栽培环境下发生普遍、危害严重,成为制约设施番茄健康发展的主要障碍[1,2]。由于缺乏抗病品种,目前化学杀菌剂依然是防治番茄灰霉病的主要措施[3],但长期大量的施用化学杀菌剂容易引起病原菌产生抗药性[4]。目前已有报道表明,灰葡萄孢菌对嘧霉胺表现高抗,对腐霉利、咯菌腈的抗性也在逐年提高[5]。抗药性菌株的出现降低了化学杀菌剂的防治效果,因此,农民不得不频繁、大量地施用化学杀菌剂,由此所带来的农药残留和环境污染问题日益严重。国内外研究证明,微生物杀菌剂是防治作物病害行之有效和环境友好的措施之一[6]。针对番茄灰霉病,目前国内外已获得一些具有开发前景的生防菌株。地衣芽胞杆菌Bacillus licheniformisW10菌株和多粘类芽胞杆菌Bacillus polymyxaW3菌株不仅对灰霉菌具有较强的抑菌活性,同时能有效防治番茄灰霉病[7]。Lee等[8]以地衣芽胞杆菌B. licheniformisN1为活性成分,研制了不同的微生物制剂,发现可湿性粉剂能更好的发挥防治番茄灰霉病的效果。生防菌防治作物气传病害的机制包括产生抑菌活性物质直接杀死或抑制病原菌生长;通过占据叶面的气孔或营养位点,与病原菌竞争空间和营养;诱导植物产生系统抗病性等[9]。张玉勋等[10]研究发现枯草芽胞杆菌M9在番茄叶片上的定殖能力较强,对灰霉病的防效较高,而定殖能力较差的M11和M15菌株则防效较差。由此可见,生防菌在植物组织上的定殖能力成为其防治灰霉病的重要机制之一[11],因此有必要对生防菌在叶面的定殖数量进行检测。以往主要通过抗生素驯化结合菌落计数法对靶标微生物进行定量检测,但该方法所需时间长,并且容易出现假阳性[12]。近年来,随着分子生物学技术,尤其是实时定量PCR技术(Real-time PCR)的出现,使得定量检测不同环境中的微生物数量成为可能,目前荧光定量PCR技术被广泛应用于细菌的分子检测[13]。荧光定量PCR技术分为荧光染料法(SYBR)和TaqMan探针法,而后者的灵敏度和特异性更高。杨健等[14]根据芽胞杆菌gyrB基因序列设计特异性引物,利用荧光定量PCR技术开展了牛乳中蜡样芽胞杆菌Bacillus cereus的定量检测。Scortichini等[15]根据16S rDNA序列设计了针对榛黄假单胞菌Pseudomonas avellanae的特异性引物和探针,建立了榛黄假单胞菌P avellanae的定量检测体系,开展了该病原细菌在榛子树上的定殖检测。目前的研究多针对某个属或者种的微生物进行定量检测,但针对某个特定菌株开展定量检测的报道较少,主要原因是缺乏针对特定菌株的特异性引物或探针。随着全基因组测序技术的快速发展,越来越多的微生物公布了全基因组序列。通过对靶标微生物全基因组序列进行比对分析,可获得靶标微生物的特异性基因序列,据此可获得针对靶标微生物的特异性引物或探针[8]。
枯草芽胞杆菌B. subtilisHMB19198菌株能有效防治番茄灰霉病,目前已获得HMB19198菌株全基因组序列(结果未发表),以该菌株为活性的微生物杀菌剂正处于新农药登记阶段。本研究通过对HMB19198菌株全基因组序列进行比对分析,获得 HMB19198菌株的特异性基因序列,基于此序列,设计出针对HMB19198菌株的特异性引物和探针,建立了HMB19198的荧光定量PCR定量检测技术,利用该技术对HMB19198菌株在番茄叶片上的定殖动态进行了检测。
1 材料与方法
1.1 供试菌株
枯草芽胞杆菌 HMB19198菌株(国家发明专利:ZL201610879296.8)在含有 30%甘油的 LB(Luria Bertani)培养基中于-80 ℃长期保存,使用前在LB固体培养基上37 ℃活化。
1.2 菌株HMB19198特异性引物和TaqMan探针的设计
目前已获得 HMB19198菌株的全基因组序列及全部的开放阅读框序列。将所有开放阅读框序列在NCBI(National Center for Biotechnology Information)进行批量比对,筛选该菌株独有基因。利用Primer Premier 5.0软件在该基因内部设计特异性检测菌株HMB19198的上下游引物和探针,引物由金唯智公司合成,探针由赛默飞公司合成,探针的5′端标记FAM,3′端标记MGB。
1.3 引物和探针的特异性验证
利用细菌基因组DNA提取试剂盒(天根生化科技(北京)有限公司)提取32株枯草芽胞杆菌及其近缘种菌株DNA;利用新型植物基因组DNA提取试剂盒(天根生化科技(北京)有限公司)提取番茄叶片DNA,细菌和番茄叶片DNA均用无菌水稀释为10 ng/μL。利用菌株HMB19198特异性引物和探针进行荧光定量PCR分析,以菌株HMB19198基因组DNA为阳性对照,以番茄叶片DNA为阴性对照,无菌水为空白对照,每个处理3次重复。荧光定量PCR扩增条件为Probe qPCR Mix 10 μL,特异性引物(10 μmol/L)各 0.4 μL,TaqMan 探针(5 μmol/L)0.4 μL,模板 DNA 2 μL,用无菌 ddH2O 补足至 20 μL。扩增的反应程序为:94 ℃ 5 min,94 ℃ 30 S,58 ℃ 45 S,40个循环。
1.4 引物和探针的灵敏性检测
利用HMB19198菌株特异性引物对HMB19198基因组DNA进行PCR扩增,扩增片段插入到pMD19-T载体,经PstI限制性内切酶线性化后进行系列梯度稀释,获得101~107拷贝/μL的DNA稀释液。以系列稀释液为模板进行荧光定量PCR扩增,扩增条件同1.3部分。以质粒拷贝数的对数值为横坐标,以荧光定量PCR循环阈值(cycle threshold,Ct)为纵坐标,建立标准曲线。
1.5 番茄叶片DNA对扩增效率和检测灵敏性的影响
为检测番茄叶片DNA对荧光定量PCR扩增效率的影响,本研究利用1 ng/μL的番茄叶片DNA稀释液对1.4部分中的线性化质粒进行10倍系列稀释,获得101~107拷贝/μL的靶标DNA稀释液。以含有不同拷贝数DNA的稀释液为模板进行荧光定量PCR扩增,以质粒拷贝数的对数值为横坐标,以荧光定量PCR循环阈值(cycle threshold,Ct)为纵坐标,建立扩增曲线。通过与标准曲线进行比较分析,明确番茄叶片DNA对扩增效率和检测灵敏性的影响。
1.6 菌株HMB19198在叶片定殖能力检测
1.6.1 菌落计数法分析菌株HMB19198在番茄叶片上的定殖动态 将HMB19198菌株在LB液体培养基中37 ℃振荡培养24 h,离心收集菌体并用无菌水调整菌体浓度为108cfu/mL。用小型喷雾器将HMB19198菌体悬浮液均匀地喷洒在4片真叶期的番茄(品种为合作918)叶片上,分别于0(叶片干燥后立即取样)、2、4、6和8 d采集叶片。称取0.5 g叶片,在灭菌研钵中充分研磨,加入10 mL无菌水充分混匀,双层灭菌纱布过滤,过滤液10倍梯度稀释,取100 μL稀释液涂布于LB培养基上,37 ℃过夜培养,次日根据HMB19198菌株的形态特征,统计HMB19198菌落数,计算单位质量叶片上含有的HMB19198菌体数量(cfu/g叶片)。
1.6.2 荧光定量PCR技术分析HMB19198菌株在番茄叶片上的定殖动态 将108cfu/mL菌株HMB19198悬浮液均匀的喷施在4片真叶期的番茄叶片上,分别于0、2、4、6 d和8 d采集叶片。称取0.5 g叶片,利用新型植物基因组DNA提取试剂盒(天根生化科技(北京)有限公司)提取番茄叶片DNA,具体操纵步骤参照试剂盒说明书进行。将DNA稀释为10 ng/μL,取2 μL进行荧光定量PCR分析,根据方法1.5中构建的扩增曲线,计算单位质量番茄叶片上HMB19198的浓度(拷贝/g叶片)。
1.7 菌株HMB19198防治番茄灰霉病的持效期
将108cfu/mL的HMB19198菌体悬浮液均匀地喷洒在4片真叶期的番茄叶片上,分别于0、2、4、6和8 d采集大小和叶龄一致的健康叶片,用脱脂棉包裹住叶柄,放入铺有滤纸的玻璃皿中,滤纸和脱脂棉都滴加适量无菌水保持湿润,番茄叶片中央接种直径5 cm的灰霉菌饼,以不喷洒HMB19198接种灰霉菌饼的番茄叶片作为对照。培养皿置于25 ℃光照培养箱中培养3 d,之后采用十字交叉法测定病斑大小,计算病斑面积(长×宽)。不同处理对番茄灰霉病的防治效果(%)=(对照病斑面积-处理病斑面积)/对照病斑面积×100。
1.8 数据统计与分析
本试验数据采用Microsoft Excel 2010进行整理,IBM SPSS Statistics Version 20进行单因素方差分析,并且使用Duncan法进行显著性检验(P<0.05),采用Origin Pro 8.6进行绘图。
2 结果与分析
2.1 序列比对结果
将菌株HMB19198全基因组序列在NCBI数据库中进行序列比对,发现该菌株存在一段独有基因片段,该基因功能未知,全长102 bp(Genbank序列号:OK086768),BLAST分析没有发现同源序列。其上游开放式阅读框(HMB19198-608)和下游开放式阅读框(HMB19198-608)均为功能未知蛋白(图1)。根据HMB19198菌株特异性基因片段设计特异性引物19198F(5'-ATGTGTATAATAAGAAAAGTCGAATTG GAA-3')/19198R(5'-TCATTTGATGTTGAAGTCAAGAAGT-3')和TaqMan探针(5'-AACATTC GAAAAACATTCGAAAAACATTC-3'),引物和探针位点见图1。

图1 枯草芽胞杆菌HMB19198特异性引物和探针的位点及序列Fig. 1 Schematic diagram ofB.subtilisHMB19198 specific gene cluster and the sequences of specific primers andTaqMan probe
2.2 引物和探针的特异性验证
利用菌株HMB19198的特异性引物和探针,对32株芽胞杆菌基因组DNA进行荧光定量PCR扩增。结果表明,以菌株HMB19198基因组DNA为模板可以获得较强的扩增信号(Ct值=21.66),而以其他31株芽胞杆菌基因组DNA为模板不能获得扩增信号。以番茄叶片基因组DNA为模板也不能获得扩增信号,而番茄叶片基因组DNA中加入相同浓度的菌株HMB19198基因组DNA后可以获得较强的扩增信号(Ct值=24.30)。以上结果证明,本研究所设计的引物和探针针对菌株HMB19198具有较高的特异性。
2.3 标准曲线的建立
将含有菌株HMB19198特异性片段的线性化质粒系列稀释,以101~107拷贝/μL的质粒稀释液为模板,进行荧光定量PCR扩增,绘制标准曲线。标准曲线的线性方程为y=-3.4552x+41.188,扩增效率为94.7%,相关系数为R2=0.9902,检测阈值为101拷贝/μL(图2a)。为验证番茄叶片DNA是否抑制HMB19198菌株特异性片段的检测,本研究利用番茄叶片DNA稀释液对线性化质粒进行稀释,利用稀释液进行荧光定量PCR扩增,获得扩增曲线。扩增曲线的线性方程为y=-3.1881x+41.634,扩增效率为105.9%,相关系数R2=0.9879,检测阈值为102拷贝/μL。同以线性化质粒为模板构建的标准曲线相比,加入番茄叶片DNA后体系的扩增效率没有降低,但检测灵敏度降低了10倍(图2b)。
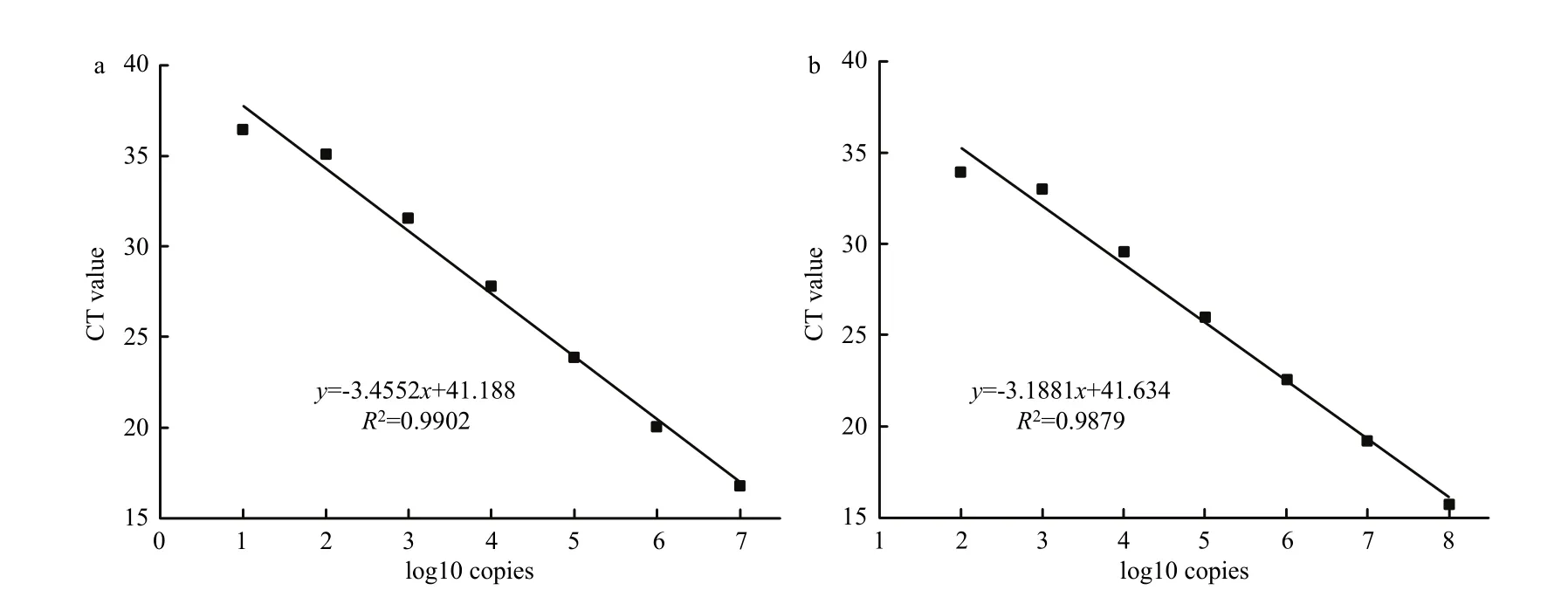
图2 无菌水(a)和番茄DNA(b)10倍梯度稀释重组载体建立的标准曲线Fig. 2 Standard curve of 10-fold diluted recombinant plasmids with sterile water (a) and DNA extracted from tomato leaves
2.4 菌株HMB19198在番茄叶片上定殖能力检测
依据建立的荧光定量PCR体系,对不同时期提取的番茄叶片总DNA中菌株HMB19198的浓度进行定量检测,同时利用传统的菌落计数法分析菌株HMB19198在叶面的定殖数量,分析两种方法的相关性。荧光定量PCR的结果显示,菌株HMB19198在叶片上的定殖数量随时间的延长呈现缓慢下降的趋势。接菌初期(0 d),菌株HMB19198的定殖浓度为1.7×108拷贝/g叶片,接菌2、4、6和8 d后菌体浓度分别为1.2×108拷贝/g叶片、4.7×107拷贝/g叶片、9.8×106拷贝/g叶片和1.0×107拷贝/g叶片。平板计数的检测结果显示,接菌初期(0 d)菌体数量为8.9×107cfu/g叶片,接菌2、4、6和8 d后菌体数量分别为6.3×107、2.8×107、3.0×107、和1.2×107cfu/g叶片,两种方法的检测结果具有较高的相关性(相关性系数R2=0.87)(图3)。

图3 Real-time PCR和平板计数方法对HMB19198菌株进行定量检测Fig. 3 Detection ofB.subtilisstrain HMB19198 by real-time PCR and plate count methods
2.5 菌株HMB19198防治番茄灰霉病的持效期
分别于喷施HMB19198菌株0、2、4、6和8 d后分析菌株HMB19198对番茄灰霉病的防治效果(图4)。结果表明,喷施HMB19198菌株2 d内对番茄灰霉病的防治效果在80%以上,4 d后防治效果为63.4%,8 d后防治效果降至37.9%。

图4 番茄喷施菌株HMB19198不同时期对番茄灰霉病的防治效果Fig. 4 Biocontrol efficiency for tomato gray mold after inoculation ofBacillus subtilisHMB19198 at different times

表1 枯草芽胞杆菌HMB19198探针的特异性检测Table 1 Probe specific detection forB.subtilisHMB19198
3 讨论
基于TaqMan探针的荧光定量 PCR技术是近年发展起来的可快速检测环境中靶标生物的一种分子技术。该技术具有特异性强、灵敏度高、周期短的优点,被广泛应用于环境中微生物的定量检测[18]。获得靶标微生物特异性探针是开发荧光定量PCR检测技术的关键,目前报道较多的是基于真菌的ITS序列和细菌的16S rDNA序列,对某种微生物进行定量检测[19],而针对特定菌株开展定量检测的报道较少,主要原因是难以获得菌株特异性的引物或探针。通过随机扩增多态性DNA(random amplied polymorphic DNA,RAPD)和扩增片段长度多态性(amplied fragment length polymorphism,AFLP)等技术对不同菌株进行多态性分析,获得菌株的特异性片段,进而根据特异性片段序列设计针对菌株的特异性引物或探针,该技术曾广泛应用于开发菌株特异性引物,但这两项技术要求提供不同菌株 DNA,在一定程度上限制了引物的特异性验证范围[20]。近年来,随着基因组测序技术的普及及生物信息学技术的广泛应用,通过菌株全基因组序列比对,获得菌株的特异性碱基,据此设计针对菌株的特异性引物或探针已成为可能。目前仅 NCBI数据库中提交的枯草芽胞杆菌类细菌的全基因组序列达到350条,方便了枯草芽胞杆菌类细菌全基因组序列比对。枯草芽胞杆菌HMB19198是一株能有效防治番茄灰霉病的生防细菌,目前已获得该菌株的全基因组序列。本研究基于全基因组序列比对技术,得到HMB19198菌株中的特异性片段19198-609,将此序列在NCBI数据库中进行序列比对,未发现存在同源性较高的序列。基于此序列设计出针对HMB19198菌株的特异性引物和探针,首先利用32株芽胞杆菌进行特异性验证,证明该引物和探针对HMB19198菌株具有较高的特异性,另外,以番茄叶片DNA为模板进行检测,也未发现存在检测信号,因此,该特异性引物和探针可用于开展HMB19198菌株在番茄叶片上的定量检测。
利用荧光定量PCR检测靶标微生物的灵敏性时受提取DNA的质量以及DNA中腐殖酸和有机酸等物质的影响[21]。菌株 HMB19198为叶面喷施,因此,重点检测菌株在叶片上的定殖能力。考虑到番茄叶片DNA可能影响HMB19198菌株的检测,本研究分别用HMB19198基因组DNA和混入番茄叶片DNA的HMB19198基因组DNA构建了标准曲线,比较了两种情况下的检测灵敏度,结果发现没有番茄叶片DNA干扰的条件下,对HMB19198菌株的检测极限为10拷贝/μL,混入番茄叶片DNA后,体系检测效率没有明显的改变,但检测极限降低为 102拷贝/μL。前期研究发现,喷施 HMB19198菌株后,番茄叶片上菌株的浓度在105cfu/g叶片以上,因此,即使存在番茄叶片的干扰,本研究建立的检测体系依然可用于叶片上菌株HMB19198的定量检测。
菌株HMB19198田间应用间隔期为5~8 d,在施药间隔期间进行菌株HMB19198在叶片上的数量动态检测有助于指导田间施药和研究生防菌的作用机制。本研究利用所建立的荧光定量PCR技术结合菌落计数法,对喷施菌株HMB19198 0~8 d后叶片上菌体数量进行了动态检测发现,在接种前期(0、2和4 d)荧光定量PCR检测结果略高于菌落计数法检测结果,但接种后期(6和8 d)荧光定量PCR检测结果略低于菌落计数法检测结果,推测随着番茄的生长,叶片中的有机酸等物质含量增多,对荧光定量PCR的扩增效率有影响,从而降低了检测结果。荧光定量PCR检测和平板菌落计数检测结果相近,菌体数量随着时间的延长呈现逐渐降低的趋势,结果与刘锦霞[22]等检测生防菌株SW11在番茄叶片上的定殖数量变化趋势一致。本研究结果显示,用药2 d后菌株HMB19198在叶面的数量为6.3×107cfu/g叶片,对灰霉病的防效在80%以上,而用药8 d后在叶面的定殖数量为1.2×107cfu/g叶片,但此时的防效仅为37.9%。对于防治叶部病害的生防细菌,其叶面的定殖能力和产生的抑菌物质均影响其生防效果[23]。由于HMB19198菌株是以菌体形态喷洒在番茄叶面上,其在转变为休眠体芽胞的过程中将分泌微量的抑菌活性物质,会在一定程度上抑制了病原菌的侵染,因此在施药初期对灰霉病的防治效果较好。但随着时间的延长,菌株HMB19198转化为芽胞或菌体死亡,对病害的防效降低,另外,其所分泌的抑菌物质在温室高湿环境下也会有所流失。
