燕麦内生细菌YN-J3的分离鉴定及防病促生作用研究
2022-04-22王海霞郑成忠东保柱孟焕文周洪友孙瑞锋郑红丽
王海霞,郑成忠,东保柱,孟焕文,周洪友*,孙瑞锋,郑红丽*
(1. 内蒙古农业大学园艺与植物保护学院/生物农药创制与资源利用自治区高等学校重点实验室(培育),呼和浩特 010019;2. 乌兰察布市农牧业科学研究院,集宁 012000;3. 鄂尔多斯市万通农牧业科技有限公司,鄂尔多斯 017000)
燕麦Avena sativa在我国种植历史悠久,属禾本科Gramineae燕麦属Avena植物,是一种粮饲兼用作物,同时也是一种功能性保健食品[1]。燕麦多生长在高寒、贫瘠和干旱的极端环境中,已经成为生态脆弱区不可替代的特色粮饲作物[2]。因为燕麦营养价值高及适应性好等优点,种植面积逐年扩大,现已成为北方地区着力发展的特色产业。但燕麦生产也存在产量低、田间病虫害发生频繁等问题[3]。燕麦田常见病害有炭疽病、德式霉叶斑病、红叶病、黑穗病等[4];影响燕麦的产量和品质。鉴于国家当前的农业结构调整、发展草牧业、生态环境建设等一系列政策措施的支持,燕麦作为一种优良的粮饲兼用作物,其集约化的种植面积将会逐年增加,势必会引起病害的普遍发生和严重危害。因此,燕麦生产中有害生物的绿色防控成为燕麦产业绿色可持续发展的必由之路[4]。
植物内生菌是非常重要的微生物资源,现已成为植物学、微生物学、植物保护学及作物育种学等多种学科研究的热点[5-7]。植物内生菌对于植物有促生、诱导植物抗病性、提高农产品品质、生物固氮、降解有害物质等作用[8-10],是重要的生防资源。研究表明,短叶红杉Taxus revifolia的韧皮部分离出的一株能产生紫杉醇的内生真菌——安德烈紫杉菌Taxomyces andreanae,能够提高短叶红衫的抗病性[11];内生菌通过影响宿主植物体内的物质代谢促进宿主植物的生长[12]。Mal1nowski等[13]发现感染了内生真菌的酥油草其根系具有更强的吸收P的能力, 同时根系内Ca、Mg含量也较高, 其机制可能是增加根系长度和向土壤中分泌酸类。史应武等[14]发现从甜菜根部分离的1株内生菌能显著增加甜菜鲜重、叶绿素含量及含糖率,有明显的促生、增糖作用。内生菌还可以通过分泌植物生长素(Indole acetic acid)、赤霉素(Gibberellin A4)和细胞分裂素(Cytokinin)等植物激素直接促进植物生长。如沈德龙等[15]从水稻中分离到的内生成团泛菌YS19可以分泌生长素、细胞脱落酸、赤霉素和细胞分裂素4种植物激素。目前,很多研究人员开始致力于植物体内的细菌研究,至今在植物保护方面积累了大量的植物内生细菌研究信息[16,17]。但是,针对燕麦的内生菌的研究却鲜有报道。
本研究通过对田间长势良好的燕麦植株的内生菌进行分离、鉴定和生物测定;以期获得对燕麦有促生、防病作用的内生菌;为燕麦病害的绿色防控积累重要生物资源,并为进一步深入了解燕麦内生菌促生及防病机制及应用于燕麦生产奠定基础。
1 材料与方法
1.1 试验材料
供试样品:分离燕麦植株来自内蒙古自治区乌兰察布市、河北省张家口市、云南省会泽等地,具体信息如表1。
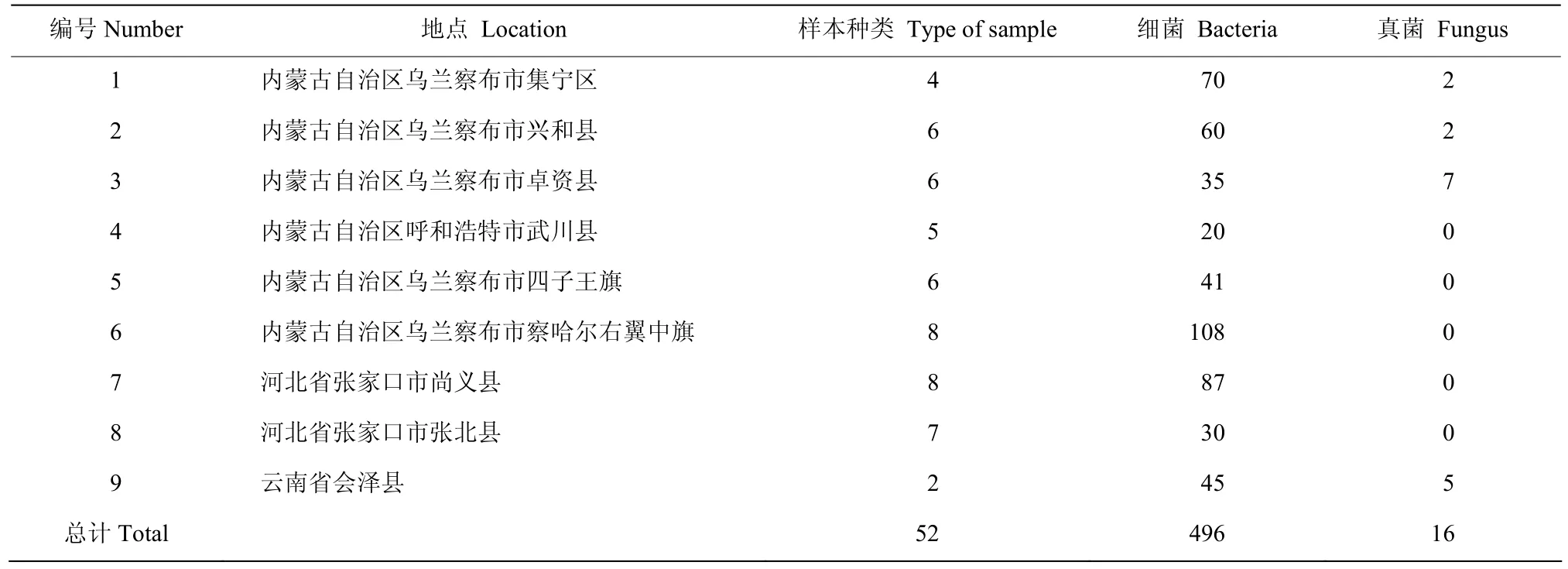
表1 燕麦样本来源及分离数量Table 1 Oat sample source and separation results
供试病原:燕麦叶斑病菌Drechslera avenae、燕麦炭疽病菌Colletotrichum graminicola、马铃薯黄萎病菌Verticillium dahliae、马铃薯枯萎病菌Fusarium oxysporum、马铃薯黑痣病菌Rhizoctonia solani、油菜菌核病菌Sclerotinia sclerotiorum均由内蒙古农业大学植物病理研究室分离、保存。
供试培养基:PDA培养基:去皮马铃薯200 g,切块煮沸30 min,滤液中加葡萄糖20 g,琼脂18 g,蒸馏水定容至1000 mL,pH自然。LB培养基:酵母膏5~10 g,氯化钠5 g,蛋白胨10 g,琼脂20 g,蒸馏水定容至1000 mL,pH 7.0~7.2。LB液体培养基:酵母膏5~10 g,氯化钠5 g,蛋白胨10 g,蒸馏水定容至1000 mL,pH 7.0~7.2。PKO无机磷培养基:葡萄糖10 g,(NH4)2SO40.5 g,NaCl 0.2 g,KCl 0.2 g,Ca3(PO4)25.0 g,MgSO4·7H2O 0.03 g,MnSO40.03 g,FeSO40.003 g,酵母膏0.5 g,琼脂20 g,蒸馏水1 L,pH 6.8~7.0,121 ℃灭菌30 min。钾长石培养基:葡萄糖10 g,钾长石2.5 g,Na2HPO40.2 g,MgSO4·7H2O 0.2 g,NaCl 0.2 g,CaCO35.0 g,CaSO4·7H2O 0.1 g,琼脂 20 g,pH 7.0。king B 培养基:蛋白胨 20 g,磷酸氢二钾1.5 g,七水合硫酸镁1.5 g,蒸馏水定容至1000 mL,pH 7.0~7.2。DF培养基KH2PO44 g,Na2HPO46 g,MgSO4·7H2O 0.2 g,葡萄糖2 g,葡萄糖酸钠2 g,柠檬酸2 g,(NH4)2SO42 g,组分一(H3BO310 mg,MnSO4·H2O 11.19 mg,ZnSO4·7H2O 124.6 mg,CuSO4·5H2O 78.22 mg,MoO310 mg,溶于 100 mL 灭菌蒸馏水中,4 ℃保存),组分二(FeSO4·7H2O 100 mg溶于10 mL灭菌蒸馏水中,4 ℃保存)溶液各0.1 mL,蒸馏水定容至1000 mL,pH 7.2。ADF培养基:ACC(1-氨基环丙烷-1-羧酸)溶于超纯水后抽滤灭菌,加到不含(NH4)2SO4且预先灭菌的DF培养基中,ACC终浓度为3 mmol/L。Salkowski比色液:称取硫酸铁12 g溶于蒸馏水中,之后缓慢加入429.7 mL浓硫酸,待溶液冷却后定用蒸馏水容至1 L。测定范围为0.3~20 mg/mL。细菌基因组DNA提取试剂盒(天根生化科技有限公司,天津,中国)16S rDNA扩增引物:27F(5'-AGAGTTTGATCCTGGCTCAG-3')、1492R(5'-TACGGTTACCTTGTTACGACTT-3')gyrA 基因扩增引物:gyrA-F(5'-CAGTCAGGAAATGCGTACGTCCTT-3')、gyrA-R(5'-CAAGGTAATGCTCCAGGC ATTGCT-3'),增试剂:2×mixTaq酶、琼脂粉、核酸染料。
1.2 燕麦内生菌的分离
健康的燕麦植株冲洗干净,然后依次用75%乙醇浸泡30 s,5%次氯酸钠浸泡2 min,无菌水冲洗3次。样品经表面消毒后,将根、茎、叶用无菌剪刀剪成小段,放入研钵中研磨至匀浆。将梯度稀释后的匀浆均匀涂布于固体 LB,同时取最后一次无菌水冲洗液,涂布至空白平板上,培养观察。如无菌落长出,说明植物组织的表面消毒彻底,分离出来的即为植物内生菌。培养皿置于28 ℃培养48 h后,挑取不同形态的菌落用30%甘油在-80 ℃冰箱保存。
1.3 燕麦拮抗内生菌的筛选
利用平板对峙培养法筛选病原菌的拮抗内生菌[18]。首先在PDA培养基中心接种直径0.5 cm的病原菌菌饼,然后在病原菌菌饼等距离(2.5 cm)处点接分离得到的细菌菌株,以仅在中心接种病原菌的平板作为对照。28 ℃培养3~6 d后,观察结果。以抑菌圈的大小和形状判断拮抗程度。抑菌率(%)=(对照菌落半径-处理菌落半径)/(对照菌落半径-0.25 cm)×100。
1.4 内生菌株YN-J3的生物测定
1.4.1 防病效果测定 燕麦离体叶片置于铺有2 层湿润滤纸的培养皿中,将1×107cfu/mL菌悬液均匀喷雾于叶片表面。在叶片上接种10 mL孢子浓度为1×107cfu/mL 的炭疽菌孢子悬浮液。最后,将培养皿置于16 h光照/8 h黑暗、25 ℃条件下培养4 d。测量病斑长度,并计算防治效果。防治效果(%)=(对照病斑直径-处理病斑直径)/对照病斑直径×100。
1.4.2 促生作用测定 种植燕麦的土壤进行高温灭菌,按照土壤、蛭石、营养土体积比 2:2:1进行混合,装盆待用。将燕麦种子冲洗干净,然后依次用5%次氯酸钠浸泡3 min,无菌水冲洗4次。之后将燕麦种子放入待测菌株菌悬液中,在28 ℃、180 r/min振荡培养2 h,以在液体LB中摇培2 h的燕麦种子设为对照。将处理好的燕麦种子均匀地撒在花盆中,每盆20粒,重复3次,表面覆土,于培养室内(25 ℃)培养,隔天浇水。待生长3 周后测量植株出苗率、株高、鲜重等,分析不同内生细菌对燕麦生长的影响。
1.5 内生菌株YN-J3的田间生测
田间试验地块设置在内蒙古自治区乌兰察布市集宁区乌兰察布市农牧业科学研究院和内蒙古自治区呼和浩特市武川县小西摊村两处。试验于2021年5月至9月进行,两个地点处理相同,每个地点设置内生菌处理和空白对照,重复4次。燕麦种子的品种为白燕二号,首先用内生菌菌悬液(1×107cfu/mL)对燕麦种子进行拌种,待晾干后播种。之后每隔20 d左右对燕麦植株进行内生菌菌悬液喷雾,共进行3次。其中菌悬液(1×107cfu/mL)需稀释10 倍后施用,对照只喷雾清水,田间常规管理。
待对照发病后开始调查,每个小区随机调查燕麦植株炭疽病发病情况,燕麦炭疽病分级标准:按病斑所占叶片表面积进行分级,1级:无病斑;2级:1%~10%;3级:11%~25%;4级:26%~50%;5级:51%以上。病情指数=100×∑(各级病叶数×该病级代表相数值)/(调查总叶数×最高级代表值),防治效果(%)=100×(对照病情指数-处理病情指数)/对照病情指数。并调查了燕麦植株的株高,与对照相比,计算处理对燕麦植株的促生作用。
1.6 内生菌YN-J3的促生功能测定方法
1.6.1 解磷能力测定 将内生菌接种于PKO无机磷培养基平板上,3次重复,30 ℃下培养3 d,观察菌落周围是否有解磷圈的形成及其直径大小,以此来判断该菌株有无解磷能力,并测量解磷圈直径及菌落直径,解磷能力的大小用解磷圈直径/菌落直径(D/d)表示,其比值越大,解磷效果越好,以此来初步确定菌株的解磷能力[19]。
1.6.2 解钾能力测定 将菌株接种于钾长石培养基平板上,3次重复,28 ℃培养3 d,观察菌落周围是否有解钾圈的形成及其直径大小,以此来判断该菌株有无解钾能力,并测量解钾圈直径及菌落直径,解钾能力的大小用解钾圈直径/菌落直径(D/d)表示,其比值越大,解钾效果越好,以此来初步确定菌株的解钾能力[20]。
1.6.3 产吲哚乙酸IAA能力测定 选用经典的 Salkowski试剂比色法[21]。挑取待筛选菌株单菌落接入液体LB培养基中,培养至OD600=1。将菌悬液以1%的接种量接至不含色氨酸的King B培养基中,以无菌水做对照。将上述三角瓶置于28 ℃、160 r/min振荡培养7 d。取菌悬液1 mL滴加于试管中,加入等量的Salkowski比色液,将试管置于室温显色15 min,观察颜色变化,将比色结果与IAA以及加无菌水的不含色氨酸的king B培养基做对照,溶液颜色越红,表明IAA生产能力越强,不变色则为阴性,不产IAA。
1.6.4 产ACC脱氨酶能力测定 挑取产IAA阳性菌株少许于10 mL的LB液体培养基中,将三角瓶置于28 ℃、180 r/min的振荡培养箱中培养24 h,制成菌悬液。吸取200 μL上述菌悬液加入到提前配置好的10 mL的DF培养基中,在相同条件下继续培养24 h后,吸取200 μL加入到10 mL的ADF培养基中,在相同条件下继续培养24~48 h,将菌株再在ADF培养基转接培养一次。以ADF(不含ACC)培养基作为阴性对照,不接菌的ADF和不含ACC的ADF培养基调零,在分光光度计下测量其在600 nm波长下的光度值,菌液浓度OD600大于0.1,表明菌株能够利用 1-氨基环丙烷羧酸(ACC)作为唯一氮源生长,初步认为是ACC脱氨酶阳性菌株。
1.7 解淀粉芽胞杆菌YN-J3的鉴定
1.7.1 形态学、生理生化鉴定 对待鉴定菌株YN-J3利用革兰氏染色进行初步鉴定[22],参照方中达《植物病理研究方法》[23]进行生理生化鉴定。
1.7.2 分子生物学鉴定 挑取单菌落于1.5 mL离心管中,12000 r/min离心1 min,收集菌体。细菌DNA由购自天根生化科技有限公司的细菌基因组DNA提取试剂盒提取,详细步骤请参阅产品手册。
用通用引物 27F(5'-AGAGTTTGATCCTGGCTCAG-3')、1492R(5'-TACGGTTACCTTGTTACGAC TT-3')扩增 16S rDNA,并利用引物gyrA-F(5'-CAGTCAGGAAATGCGTACGTCCTT-3')、gyrA-R(5'-CAA GGTAATGCTCCAGGCATTGCT-3')扩增看家基因。PCR扩增反应体系为25 µL,其中DNA模板为3 µL,27F/1492R引物各1 µL,2×mixTaq酶12.5 µL,ddH2O 7.5 µL。PCR扩增反应程序:94 ℃预变性3 min,94 ℃变性30 s、55 ℃退火1 min、72 ℃延伸1.5 min、30个循环,最后72 ℃再延伸10 min,4 ℃保存。PCR产物经1%琼脂糖凝胶电泳检测后送到北京擎科生物技术有限公司测序。将测序的结果通过NCBI数据库的Blast程序进行相似性比对分析。用MEGA 7.0构建目标菌株16S rDNA与gyrA基因的系统发育树。
1.8 数据统计与分析
本试验数据在Excel软件上进行统计,计算结果在SPSS统计分析软件上完成,检验处理间的差异显著性。
2 结果与分析
2.1 内生菌的分离及筛选
通过对来自内蒙古自治区、河北省及云南省等地点的健康燕麦植株样本进行内生菌分离(表1),共分离到512株内生菌。其中,对于燕麦德式霉菌有抑制作用的共122株,有9株内生细菌的抑制率达到60%以上,分别为JN-Y2、XH-J8、JN-G7、JN-J12、YN-J3、ZZ-J4、ZZ-G2、ZZ-G5、ZZ-J3(表2)。其中菌株YN-J3抑制效果最好,抑菌率为79.03%(图1)。筛选出的9 株内生细菌对燕麦炭疽病菌均有不同程度的抑菌作用,菌株YN-J3的抑菌率为89.60%(表2)。以上试验结果表明,筛选得到的9株燕麦内生菌对于燕麦2种病原菌均有广谱的抑菌效果,菌株YN-J3的抑菌效果最显著。

表2 内生菌对燕麦病菌的抑制作用Table 2 Inhibitory effects of endophytes on oat disease bacteria

图1 内生菌对燕麦叶斑病菌的拮抗作用Fig. 1 The antagonistic effect of endophytes on oat leaf spotpathogen
将分离得到的9株燕麦内生菌与马铃薯常见病原菌做平板对峙试验,结果表明:9株燕麦内生菌均能抑制马铃薯黑痣病菌、菌核病菌、镰刀菌病菌、大丽轮枝菌的生长。因此,9株燕麦内生细菌对于马铃薯、燕麦常见病原菌具有广谱抑制作用,菌株YN-J3对4种马铃薯病原菌均有很好的抑制作用,抑制率分别为80.66%、65.06%、68.98%和89.28%(表3)。

表3 内生菌对其他病原真菌的抑制作用Table 3 Inhibition of endophytes on other pathogenic fungi
2.2 内生菌株YN-J3的生物测定
利用离体接种的方法,测定菌株YN-J3对燕麦炭疽病的室内防治效果。结果如图2所示,YN-J3处理后炭疽病斑长度为(0.23±0.03)cm,对照的病斑长度为(0.93±0.03)cm。离体条件下,YN-J3的防治效果为75.27%。此外,接种4 d后,对照叶片已退绿,经菌株YN-J3处理后的叶片仍为绿色。结果表明,菌株YN-J3离体条件下能够有效控制炭疽病的侵染和扩展。

图2 菌株YN-J3对燕麦炭疽病菌的离体叶片试验Fig. 2 Test of detached leaves of strain YN-J3 against the pathogen of oat anthracnose
试验结果如图3 所示,与对照组相比,菌株YN-J3处理与对照的鲜重分别为(5.36±0.57)和(3.63±0.49)g,YN-J3处理比对照增加了47.66%;干重分别为(0.72±0.04)和(0.31±0.03)g,YN-J3处理比对照增加了83.87%;株高分别为(35.27±0.77)和(28.25±1.88)cm,YN-J3处理比对照增加了24.84%。结果表明,菌株YN-J3对燕麦有很好的促生作用。

图3 内生菌对燕麦生长的影响Fig. 3 Effect of bacterial strain on the growth of oat
2.3 内生菌株YN-J3的田间生测
通过两个地点进行燕麦株高分析,与对照相比,集宁和武川两个地点经菌株YN-J3处理的燕麦株高均显著高于对照。如图4所示,集宁地点的菌株YN-J3处理与对照的株高分别为(120.88±6.98)和(99.01±4.67)cm,YN-J3处理比对照增加了22.09%;武川地点的菌株YN-J3处理与对照的株高分别为(59.39±1.39)和(48.03±1.49)cm,YN-J3处理比对照增加了23.65%。

图4 内生菌YN-J3对燕麦株高的影响(田间)Fig. 4 Effects of endophytes on oat plant height (Field)
通过两个地点进行田间防效分析,与对照相比,经菌株YN-J3处理的燕麦炭疽病发病率明显低于对照。如表4所示,集宁地点的菌株处理与对照的发病率分别为(8.31±0.26)%、(19.08±1.03)%,其防治效果为74.53%;武川地点的菌株YN-J3处理与对照的发病率分别为(26.28±3.14)%、(47.30±3.62)%,其防治效果为63.57%。结果表明,菌株YN-J3在田间条件下具有较强抑菌活性。

表4 菌株YN-J3对燕麦炭疽病的田间防效作用Fig. 4 Field control effect of strain YN-J3 on oat anthracnose
2.4 内生菌YN-J3的促生功能研究结果
为了研究菌株YN-J3的促生机制,对菌株YN-J3解磷、解钾、产IAA和产ACC脱氨酶能力进行测定。解磷能力测定结果如图5所示:菌株YN-J3有非常明显的解磷圈,无机磷培养基上解磷圈直径/菌落直径(D/d)为(1.80±0.04),表明其具有解磷作用(表5);将内生菌接种于钾长石培养基上,观察其解钾圈的直径大小,结果表明菌株 YN-J3周围有明显的解钾圈(图5),其解钾圈直径/菌落直径(D/d)为(2.28±0.05),试验表明菌株YN-J3具有解钾作用(表5)。产 IAA试验结果如图6所示,菌株YN-J3红色最深,并进行了IAA的定量测定,结果表明菌株YN-J3分泌IAA量最多,为(24.20±0.01)μg/mL,表明其产IAA能力最强。对菌株YN-J3进行产ACC脱氨酶OD值为0.18,大于 0.1,表明菌株 YN-J3有一定程度的产 ACC脱氨酶能力(表5)。
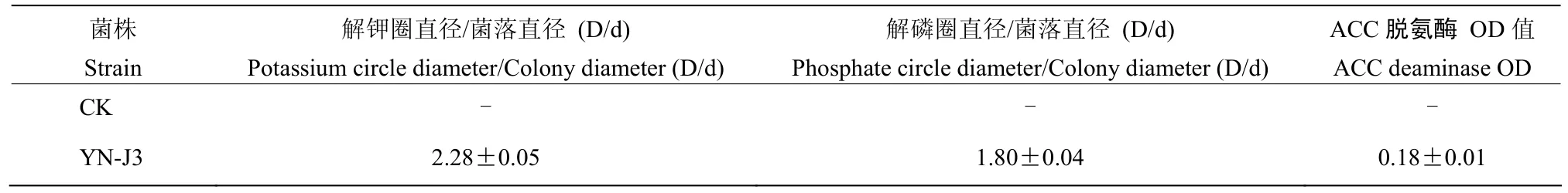
表5 内生菌YN-J3 解磷、解钾及产ACC脱氨酶能力Table 5 Endophyte YN-J3 dissolves phosphorus, potassium and ACC deaminase
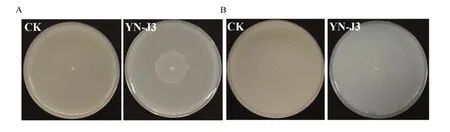
图5 内生菌YN-J3的解磷及解钾测试结果Fig. 5 Endophyte YN-J3s test results of dissolving phosphorus and potassium

图6 内生菌株 YN-J3 产IAA显色结果Fig. 6 Endophytic strain YN-J3 produced IAA color development results
2.5 内生菌YN-J3的鉴定
2.5.1 形态学及生理生化鉴定 对筛选出拮抗效果较好的菌株YN-J3进行形态学及生理生化鉴定,结果表明,菌株YN-J3白色,菌落不透明,表面粗糙有隆起,边缘不规则(图7)。经鉴定,其革兰氏染色结果为阳性(图8),甲基红试验、丙二酸盐试验、淀粉水解试验、接触酶试验均为阳性反应,V-P试验、柠檬酸盐试验为阴性反应(表6)。菌体(0.70~0.90)μm×(1.80~3.00)μm;YN-J3在LB培养基上培养2~3 d产生芽胞,芽胞中生,产生芽胞后菌体膨大(图8)。

表6 促生菌株生理生化鉴定Table 6 physiological and biochemical identification results of growth promoting

图7 内生菌株YN-J3菌落形态Fig. 7 Colony morphology of endophytic strain YN-J3

图8 内生菌株YN-J3革兰氏染色结果Fig. 8 Endophytic strain YN-J3 gram staining results
2.5.2 分子生物学鉴定 利用27F/1492R引物对扩增16S rDNA,PCR扩增产物进行凝胶电泳分析,在1500 bp左右得到清晰明亮的特异性条带(图9)。对特异性条带测序,将获得的序列在NCBI中Blast同源性比对,菌株YN-J3与解淀粉芽胞杆菌B. amyloliquefaciens相似度为99.93%,且菌株YN-J3的gyrA基因序列与解淀粉芽胞杆菌相似度为99.86%,下载同源序列并构建系统发育进化树,结果如图10所示:菌株YN-J3与解淀粉芽胞杆菌MW559233.1聚为一类。结果表明,菌株YN-J3为解淀粉芽胞杆菌,16S rDNA基因序列登录号为OL872222。

图9 菌株YN-J3的16S rDNA及gyrA基因PCR扩增电泳图Fig. 9 PCR amplification electrophoresis of 16S rDNA andgyrA gene of strain YN-J3

图10 菌株YN-J3基于多基因序列构建系统发育树Fig. 10 Phylogenetic tree based on the multigene sequences of strain YN-J3
3 讨论
内生菌物种丰富,主要包括真菌、细菌和放线菌三大类,为生物农药、肥料开发提供了巨大的资源库[24]。植物内生菌种类多样性取决于自身和寄主种类多样性,以及寄主不同部位分布的可选性[25]。目前世界报道的原料研究对象中,植物内生细菌多为Bacillus、Pseudomonas等,存在于至少129种大田作物及工业原料作物中[26]。本研究通过对燕麦内生菌进行分离,得到了512株内生细菌,细菌形态多样;通过16S rDNA扩增序列分析结果表明,512株细菌中涉及到了芽胞杆菌等多个属内的6个种。512株细菌中有9株对于燕麦叶斑病、炭疽病菌有很强的抑菌效果。以上研究结果表明:燕麦的内生菌种类丰富,是重要的生防资源。
枯草芽胞杆菌和解淀粉芽胞杆菌具有良好的定殖能力,能保护植物免受病原真菌的侵害[27],还有促生长的作用[28]。研究表明:抗生作用是芽胞杆菌主要的生防机制之一[29,30]。如解淀粉芽胞杆菌NCPSJ7对9株植物病原真菌均具有良好的拮抗效果[31];枯草芽胞杆菌B. subtilisRSS-55对油菜菌核病菌S. sclerotiorum有极强的抑制效果,抑制率高达 93.33%[32]。此外,芽胞杆菌还可以分泌出磷酸脂酶和嗜铁素,从而吸收利用土壤中的难溶性磷和固态铁[33,34];也有一些芽胞杆菌能够分泌植物生长类激素,促进植物生长。本研究中,分离自燕麦的B. amyloliquefaciensYN-J3能够产生抗菌物质,显著抑制燕麦病原菌的生长;并且通过解磷、解钾、产生植物生长激素等方式,促进燕麦生长。以上结果表明:燕麦内生芽胞杆菌资源在防控植物病害、促进植物生长等方面发挥重要作用,是值得开发利用的生防资源。
在内蒙古地区,马铃薯常年连作,会导致土壤养分利用严重失衡,土传病害日益加重[35]。燕麦-马铃薯轮作是合理利用土壤肥力,减轻马铃薯土传病害的重要农业措施;这种轮作的方式也是内蒙古寒旱区主要的种植模式[36]。本研究发现,分离得到的多株燕麦内生菌,具有广谱抗菌活性,对于马铃薯土传病原菌有拮抗作用。燕麦内生菌有望用于防治马铃薯土传病害,其防治效果需要进一步研究确定。
