烟草黑胫病拮抗菌的筛选、鉴定及发酵条件优化
2022-04-22何明川王志江谢永辉詹莜国柯昌磊李微杰吴国星
何明川,王志江,谢永辉,詹莜国,柯昌磊,李微杰,张 忠,吴国星*
(1. 云南农业大学植物保护学院,昆明 650201;2. 云南省烟草公司昆明市公司,昆明 650051;3. 山东第一医科大学生命科学学院,泰安 271016)
烟草黑胫病是烟草种植业危害最严重的毁灭性土传病害[1,2],多发生于烟草成株期,主要危害烟株的根茎部,由病原菌烟草寄生疫霉Phytophthora parasiticavar. nicotianae侵染烟株的根茎基部,以根茎部发病为主,向烟株的茎髓部蔓延扩展,病株的茎节变黑且坏死,烟叶自下而上的依次变黄溃烂,烟株染病严重时整株枯死[3,4]。烟草黑胫病易传染,难控制,病害一旦出现,迅速大面积扩展,给烟草种植带来巨大经济损失[5]。目前在烟草种植上对于黑胫病的防治,主要依赖化学药剂甲霜灵、代森锰锌等杀菌剂,但由于长期且不规范使用化学农药,造成农药残留、环境污染、病原菌的抗药性不断增强及对非靶标生物的毒害作用等问题[6,7]。因此,利用环境友好型高效生防菌剂进行生物防治,对烟叶的绿色生产具有重大意义。
目前,已报道防治黑胫病的生防菌主要是从烟株根际得到的真菌、细菌,根际细菌主要是芽胞杆菌属,其主要通过竞争、抑制以及寄生、诱导植物产生抗性等方式来抑制病原菌[8,9]。马冠华等[10]从健康烟株筛选得到内生菌Itb57,其在温室内对黑胫病防治效果为69.28%,田间防治效果为72.49%。王进等[11]筛选得到枯草芽胞杆菌Bacillus subtilis21b对烟草黑胫病菌丝生长的抑制率达78.33%。有关防治烟草黑胫病的生防菌多来源于植株与根际土壤,从昆虫肠道分离的生防菌相对较少[12]。而昆虫尤其是食腐昆虫肠道存在着丰富的微生物多样性[13]。因此,这类昆虫是潜在的拮抗菌库,具有较广的应用前景。
为发掘可用于防治烟草黑胫病的生防菌,本研究以食腐昆虫美洲大蠊肠道为样本,从中分离纯化得到对烟草黑胫病具有较好拮抗作用的菌株,利用16S rRNA基因序列分析及生理生化特征、形态特征确定其种类,同时明确了其最优发酵条件及室内防效。研究结果可为特基拉芽胞杆菌 D5-8生防菌剂的开发及其对烟草黑胫病的防治应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌种 拮抗菌株编号为 D5-8,烟草黑胫病病原菌烟草寄生疫霉Phytophthora parasiticavar.nicotiana现保存于本实验室。
1.1.2 供试培养基 营养琼脂培养基NA:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,琼脂15 g,蒸馏水1 L,121 ℃灭菌20 min。蛋白胨酵母培养基LB:蛋白胨10 g,酵母浸粉5 g,氯化钠10 g,琼脂15 g,蒸馏水1 L,121 ℃灭菌20 min。细菌基础培养基CM:葡萄糖5 g,(NH4)2SO42 g,柠檬酸钠1 g,MgSO4·7H2O 0.2 g,K2HPO44 g,KH2PO46 g,琼脂15 g,蒸馏水1 L,121 ℃灭菌20 min。牛肉膏酵母葡萄糖培养基NYBD:牛肉浸膏8 g,酵母浸粉5 g,葡萄糖10 g,琼脂15 g,蒸馏水1 L,115 ℃灭菌30 min。蛋白胨酵母蔗糖培养基YSP:蛋白胨10 g,酵母浸粉5 g,蔗糖20 g,琼脂15 g,蒸馏水1 L,115 ℃灭菌30 min。燕麦培养基OA:燕麦30 g,琼脂18 g,蒸馏水1 L,115 ℃灭菌30 min。
1.1.3 主要试剂和仪器 蛋白胨、牛肉膏、葡萄糖、酵母浸粉、NaCl等分析纯试剂,广东环凯微生物科技有限公司;58%甲霜·锰锌可湿性粉剂(metalaxyl mancozeb),江苏宝灵化工股份有限公司;Biospin Bacteria Genomic DNA Extraction Kit,杭州博日科技有限公司。PCR仪,Biometra公司;微生物培养箱,上海一恒科学仪器有限公司;恒温摇床,上海知楚仪器有限公司;紫外可见分光光度计,岛津仪器(苏州)有限公司[12]。
1.2 拮抗菌的鉴定
1.2.1 拮抗菌的分离 美洲大蠊成虫体表以75%酒精漂洗3次,每次2 min,用无菌水漂洗3次后解剖,获得完整的美洲大蠊消化道。将美洲大蠊消化道放入灭菌离心管中,加入1 mL无菌水,用研磨棒充分研磨后进行梯度稀释。取10-4、10-5、10-6和10-7稀释度的菌悬液100 μL分别涂布于NA平板上,再将其倒置,于28 ℃培养2~3 d,每个梯度做3次重复。在无菌条件下用灭菌接种环将NA培养基上长出的单菌落挑取于LB培养基上划线培养;纯化3~4次可得纯化后的单菌落,将纯化好的菌株使用50%甘油保存于-80 ℃冰箱[14-17]。
1.2.2 拮抗菌抑菌效果测定 采用平板对峙法[18]筛选对烟草寄生疫霉具有抑制作用的细菌菌株。使用无菌6 mm打孔器在已活化的烟草寄生疫霉平板上进行打孔,再用无菌镊子将菌饼接入新的OA培养基中央,在距菌饼2 cm十字线对称处用灭菌牙签接种待测细菌,每组重复3次,于28 ℃培养5 d后观察并记录抑菌圈的大小,并计算抑菌率,抑菌率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100,其中处理菌落直径为对称拮抗菌的两点间距离减去两点拮抗菌的抑菌圈半径。
1.2.3 菌落菌体特征观察及生理生化特征 在LB培养基上接种纯化后的单菌落,28 ℃培养3 d,待长出单菌落观察其形态。根据《微生物学实验》[19]对菌株的生理生化特性进行测定。
1.2.4 系统发育树构建 采用细菌基因组DNA提取试剂盒提取菌株基因组DNA。采用细菌通用引物27F(5′-AGAGTTTGATCCTGGCTCA-3′)和 1492R(5′-GGTTACCTTGTTACGACTT-3′)进行 PCR 扩增(引物由上海生工生物工程技术有限公司合成)。反应总体系为50 µL,扩增条件为:94.8 ℃预变性2.5 min;98 ℃变性10 s,55 ℃退火10 s,72 ℃延伸20 s,30个循环;72 ℃补充延伸2 min。采用1.0%琼脂糖电泳检测PCR产物,送昆明擎科生物公司测序。测序结果在 NCBI上进行Blast比对,并选择同源性较高的序列用Neighbor-Joining法构建系统发育树[2]。
1.3 拮抗菌的发酵条件优化
1.3.1 种子液的制备 挑取菌株D5-8单菌落于50 mL LB液体培养基中,28 ℃、180 r/min振荡培养24 h[12]。
1.3.2 最适培养基的筛选 分别接种100 μL 菌株D5-8种子液于100 mL的YSP、NYBD、NA、LB和CM液体培养基中,在28 ℃、180 r/min摇床振荡培养24 h后,采用分光光度法[20]和平板对峙法[18]测定不同培养基中菌株OD600值和抑制率,每组设3个重复,下同。
1.3.3 最适碳源的筛选 以上述筛选出来的最适培养基为基础培养基,分别加入麦芽糖、乳糖、葡萄糖、蔗糖、淀粉作为碳源,其他组分不变,28 ℃、180 r/min摇床培养24 h后,测定菌株的OD600值和抑制率,筛选出最适的碳源[12]。
1.3.4 最适氮源的筛选 以上述筛选出来的最适培养基为基础培养基,分别加入氯化铵、酵母、硝酸铵、甘氨酸、蛋白胨作为氮源,其他组分不变,28 ℃、180 r/min摇床培养24 h后测定菌株OD600值和抑制率,筛选出最适的氮源[12]。
1.3.5 最适pH值的筛选 以上述筛选出来的最适培养基为基础培养基,调节pH分别为4、5、6、7、8、9和10,将100 μL菌株D5-8种子液分别接入不同pH培养基中,28 ℃、180 r/min摇床培养24 h后测定菌株OD600值和抑制率,筛选出最适的pH[21]。
1.3.6 最适温度的筛选 以上述筛选出来的最适培养基为基础培养基,分别接种100 μL菌株D5-8种子液,设不同温度20 ℃、24 ℃、28 ℃、32 ℃、36 ℃和40 ℃,转速为180 r/min的摇床中培养24 h,测定各温度下的OD600值和抑制率,筛选出最适生长温度[21]。
1.3.7 最适转速筛选 采用上述筛选出来的最适培养基和培养条件,分别设定摇床转速为120、150、180、210和240 r/min,测定不同转速下菌株的OD600值和抑制率[21]。
1.3.8 最适光照时间筛选 采用上述筛选出来的最适培养基和培养条件,设定光照时间分别为 0、4、8、12、16、20和24 h,测定不同光照下菌株的OD600值和抑制率[20]。
1.3.9 最适装液量的筛选 采用上述筛选出来的最适培养基和培养条件,在250 mL的三角瓶中分别配置最适发酵培养基30、60、90、120和150 mL,在分别接种100 μL菌株D5-8种子液,在180 r/min的摇床培养24 h,测定不同装液量下菌株的OD600值和抑制率,确定最佳的装液量[21]。
1.3.10 最适初始接菌量优化 采用上述筛选出来的最适培养基和培养条件,分别接种含量为 2%、4%、6%、8%和10%的种子液,测定在不同接菌量条件下菌株OD600值和抑制率,确定最佳接菌量[21]。
1.3.11 最适发酵时间的优化 采用上述筛选出来的最适培养基和培养条件,分别发酵培养0、2、4、6、8、10、12、24、36、48、60、72、96和108 h,测定不同发酵时间下菌株的OD600值和抑制率,确定最佳发酵时间[21]。
1.3.12 发酵条件正交试验 根据单因素试验结果,选择对菌株菌体生长量影响较大的因素(发酵时间、温度、转速)进行正交试验(表2),从而确定最佳发酵条件。
1.4 烟草黑胫病室内防效测定
采用拮抗菌菌液灌根处理烟苗测定其防效,刮取培养21 d烟草寄生疫霉菌丝,加入0.1% KNO3溶液浸泡,加无菌水搅碎,4 ℃放置30 min,取出配置孢子浓度为1×104cfu/mL,并加入1%葡萄糖后备用;将原始发酵液与优化发酵液培养48 h,稀释调节浓度为1×108cfu/mL。保护试验:试验设4个处理,分别为菌株D5-8原始发酵菌液、D5-8优化发酵菌液、阳性对照58%甲霜·锰锌可湿性粉剂500倍液和无菌水(CK),用量10 mL,分别在各处里的每株6叶期烟苗根际周围施用,2 d后接浓度为1×104cfu/mL的烟草疫霉游动孢子悬浮液10 mL;治疗试验:先每株接浓度为1×104cfu/mL的烟草疫霉游动孢子悬浮液10 mL,2 d后在每株6叶期烟苗根际周围分别施用菌株D5-8原始发酵菌液、D5-8优化发酵菌液、阳性对照58%甲霜·锰锌可湿性粉剂500倍液和无菌水(CK)各10 mL。每个处理15株,3次重复。14 d后调查烟草植株发病情况,统计发病率和病情指数,计算相对防治效果[3]。病害分级标准:0级,全株无病;1级,茎部病斑不超过茎围的 1/3,或1/3 以下叶片凋萎;3级,茎部病斑环绕茎围1/3~1/2,或1/3~1/2 叶片轻度凋萎,或下部少数叶片出现病斑;5级,茎部病斑超过茎围的1/2,但未全部环绕茎围,或1/2~2/3 叶片凋萎;7级,茎部病斑全部环绕茎围,或2/3以上叶片凋萎;9级,病株基本枯死。相关计算公式[12]:病情指数=Σ(病级数×该病级植株数)/(最大病级数×植株总株数)×100,防治效果(%)=(对照组病情指数-处理组病情指数)/对照病情指数×100。
1.5 数据统计与分析
采用Excel 2010、GraphPad、DPS处理数据及图表的制作,Duncan’s新复极差法进行方差分析。
2 结果与分析
2.1 拮抗菌株的分离与筛选
自食腐昆虫美洲大蠊肠道共分离得到200株形态不同菌株,以烟草寄生疫霉菌为指示菌,筛选得出6株具有拮抗作用的菌株,其中菌株D5-8的拮抗效果最好,对烟草寄生疫霉的抑菌圈半径平均为10.00 mm,抑菌率为66.80%(图1)。
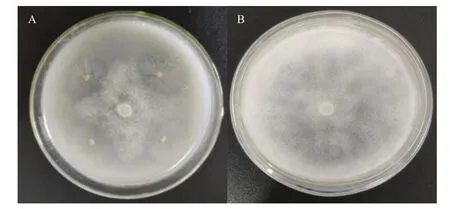
图1 拮抗菌株D5-8对烟草寄生疫霉的抑菌作用Fig. 1 Antibacterial effect of antagonistic strain D5-8 onP.nicotianaevar.nicotianae
2.2 菌株的形态特征及生理生化
菌落直径1.55~2.39 mm,椭圆,乳白色,表面干燥且完整,有褶皱且中心褶皱拱起。菌体杆状,产椭圆形芽胞(图2)。从表1可以看出,菌株革兰氏染色试验、淀粉水解试验、明胶液化试验、柠檬酸试验结果为阳性;油脂水解试验、葡萄糖发酵试验、甲基红试验等结果为阴性。根据形态观察及生理生化结果,初步确定菌株D5-8为芽胞杆菌属。

图2 菌株D5-8菌落形态及革兰氏染色Fig. 2 Colony morphology and gram staining of strain D5-8
2.3 16S rRNA鉴定
在数据库中进行BLAST比对,菌株D5-8与特基拉芽胞杆菌的16S rRNA序列同源性高达99.97%;系统发育树分析表明,菌株D5-8与特基拉芽胞杆菌(NR 104919.1)处于同一分支,结合形态特征及生理生化鉴定菌株D5-8为特基拉芽胞杆菌(图3)。

表1 菌株D5-8生理生化特征Table 1 Physiological and biochemical characteristics of strain D5-8
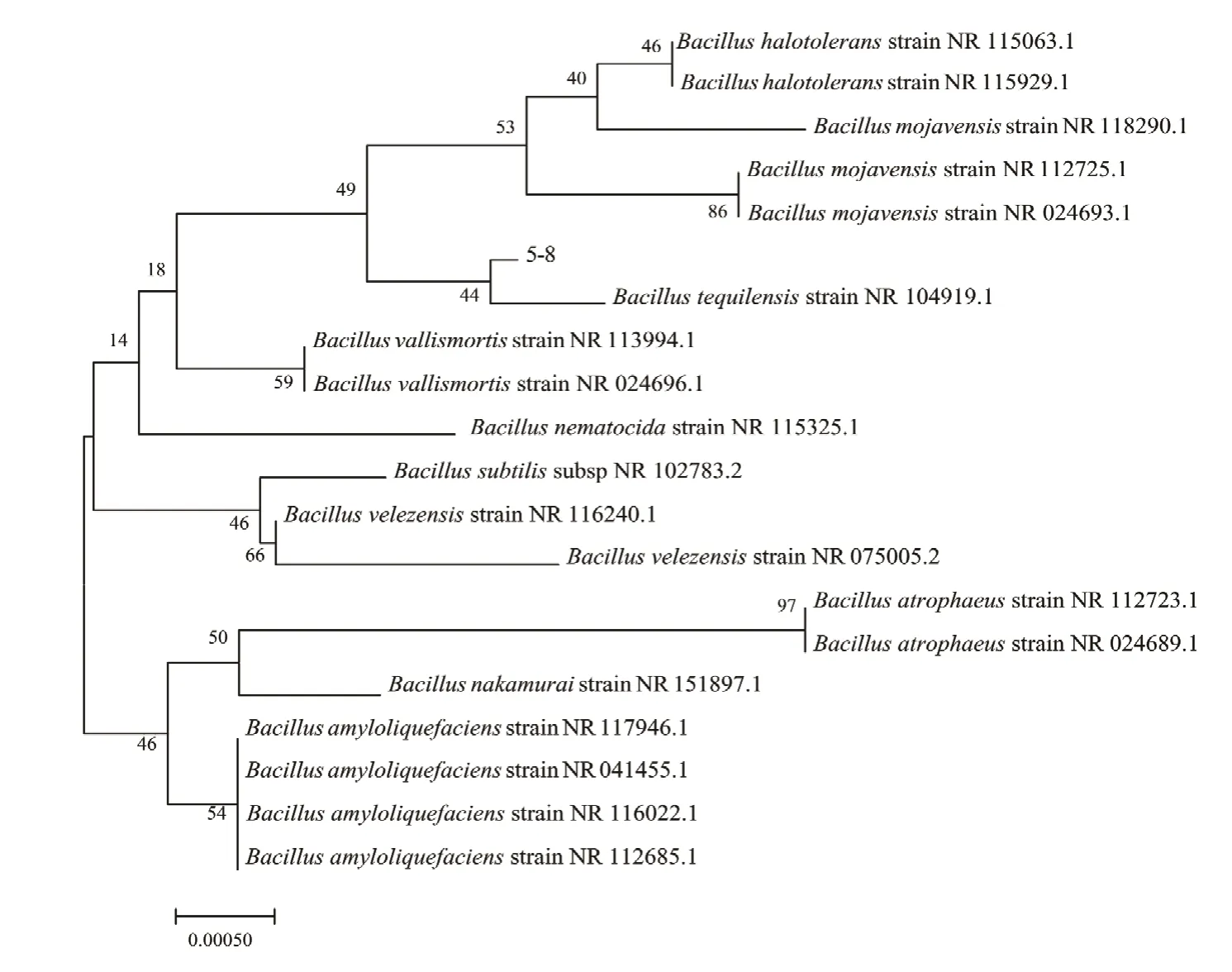
图3 菌株D5-8进化树Fig. 3 Evolutionary tree of strain D5-8
2.4 发酵条件优化结果
2.4.1 最适培养基的筛选 不同培养基对菌株 D5-8的 OD600值(F=3.834,P=0.0386)和抑制率(F=86.720,P=0.0001)均有显著的影响(图4),以NYBD为培养基时菌株的OD600值最大(2.15),对烟草寄生疫霉抑制率最高(66.67%);其次为YSP、LB、NA;在CM培养基上菌株生长最慢(OD600=1.57),对烟草寄生疫霉抑制率也最低(41.00%)。整体来看,菌株D5-8的最适基础培养基为NYBD培养基。

图4 培养基对菌株D5-8生长速度的影响Fig. 4 Effect of medium on the growth rate of strain D5-8
2.4.2 最适碳源筛选 以2.4.1中筛选的培养基NYBD为基础培养基筛选碳源,如图5所示,菌株D5-8在麦芽糖、乳糖、葡萄糖、蔗糖和淀粉上均能生长,且 OD600值(F=4.202,P=0.0299)和抑制率(F=35.033,P=0.0001)差异显著,其中以麦芽糖为碳源时D5-8的OD600值最大(2.22),对烟草寄生疫霉抑制率也最高(62.67%);以淀粉为碳源时菌株的 OD600值与对烟草寄生疫霉抑制率最低,分别为 0.99和41.00%。因此,选用麦芽糖为发酵培养基的最适碳源。

图5 碳源对菌株D5-8生长速度的影响Fig. 5 Effects of carbon source on the growth rate of strain D5-8
2.4.3 最适氮源筛选 以麦芽糖为碳源的NYBD基础培养基筛选氮源,菌株D5-8在不同氮源中生长的OD600值(F=10.321,P=0.0014)和对烟草寄生疫霉的抑制率(F=30.726,P=0.0001)有显著差异(图6),酵母浸粉做氮源时,发酵液中的OD600值和抑制率均最大,分别为2.27和63.67%;当以硝酸铵和甘氨酸为氮源时菌株的OD600值相当,但硝酸铵的抑制率显著高于甘氨酸。因此,选用酵母浸粉为发酵培养基的最适氮源。

图6 氮源对菌株D5-8生长速度的影响Fig. 6 Effect of nitrogen source on the growth rate of strain D5-8
2.4.4 最适pH的优化 菌株D5-8在上述筛选所得的最适培养基中,在不同pH下生长的OD600值(F=8.257,P=0.0006)和对烟草寄生疫霉的抑制率(F=195.494,P=0.0001)有显著差异,菌株在 pH 5和pH 6时生长最好,OD600值均为2.65,但pH 6时抑制率最高为63.66%,在pH 4时菌株的生长受抑制,pH高于6时菌株的OD600值和抑制率则明显降低,差异显著(图7)。综合分析认为,菌株D5-8最适pH为6。

图7 pH对菌株D5-8生长速度的影响Fig. 7 Effect of pH on the growth rate of strain D5-8
2.4.5 最适温度的优化 菌株D5-8在上述筛选的最适培养条件中,不同温度下的OD600值(F=45.686,P=0.0001)和抑制率(F=24.528,P=0.0001)有显著差异,20 ℃菌株D5-8的OD600值和抑制率显著低于24 ℃时;在24 ℃~40 ℃时OD600值没有显著差异,但菌株的抑制率差异显著,28 ℃时对烟草寄生疫霉抑制率最高(61.67%)(图8)。因此,菌株D5-8的最适温度为28 ℃。

图8 温度对菌株D5-8生长速度的影响Fig. 8 The influence of temperature on the growth rate of strain D5-8
2.4.6 最适转速的优化 菌株D5-8在上述筛选所得的最适培养条件中,不同转速下的OD600值(F=16.977,P=0.0002)和对烟草寄生疫霉抑制率(F=10.300,P=0.0014)有显著差异(图9),在转速120~180 r/min时,菌株的OD600值和抑制率随转速的升高不断增加,180 r/min时菌株OD600值与抑制率最高分别为2.38和62.33%。因此,菌株D5-8的最适转速为180 r/min。

图9 转速对菌株D5-8生长速度的影响Fig. 9 The influence ofrotating speed on the growth of the strain D5-8
2.4.7 最适光照时间的优化 菌株D5-8在上述筛选的最适培养条件中,不同光照时间下的OD600值(F=16.272,P=0.0001)和对烟草寄生疫霉抑制率(F=14.570,P=0.0001)差异显著(图10),当光照时间为4 h时,菌株的OD600值最大(1.91),抑制率最高(58.67%);光照时间为0时,OD600值最小(1.28),光照时间为20 h时,抑制率最低(47.33%)。因此,菌株D5-8的最适光照时间为4 h。
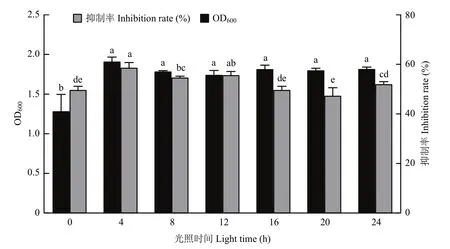
图10 光照时间对菌株D5-8生长速度的影响Fig. 10 The influence of lighting time on the growth of the strain D5-8
2.4.8 最适装液量的优化 菌株D5-8在上述筛选的最适培养条件中,不同装液量下的菌体量(F=669.199,P=0.0001)和对烟草寄生疫霉抑制率(F=6.374,P=0.0081)差异显著(图11),当菌株的装液量为30 mL时,菌株OD600值最大(2.70),菌株的抑制率最高(66.33%);随装液量的不断增加,菌株的OD600值和抑制率不断下降。因此,菌株D5-8的最适装液量为30 mL。

图11 装液量对菌株D5-8生长速度的影响Fig. 11 The influence of liquid loading amoun on the growth of the strain D5-8
2.4.9 最适接菌量的优化 菌株D5-8在上述筛选所得的最适培养条件中,不同初始接种量下的菌体量(F=0.666,P=0.6299)和抑制率(F=2.867,P=0.0805)差异不明显(图12);接种2%和接种8%的OD600值最高(2.40),接种2%的抑制率最高(61.67%)。因此,菌株D5-8的最适接种量为2%。

图12 初始接菌量对菌株D5-8生长速度的影响Fig. 12 The influence of initial inoculation quantity on the growth of the strain D5-8
2.4.10 最适发酵时间的优化 菌株D5-8在上述筛选的最适培养条件中,发酵10 h,菌株的OD600值及抑制率基本无变化,此时处于细菌的迟缓期;发酵10~48 h,菌株的OD600值与抑制率随时间的增加而增加,此阶段是菌株的对数生长期;48~72 h属于细菌的平稳期;在60 h 时,OD600值与抑制率达到最大值,分别为2.61和63%;72 h之后菌体量与抑制率随时间的增加缓慢下降,此时细菌处于衰亡期(图13)。因此,选择60 h为最适发酵时间。
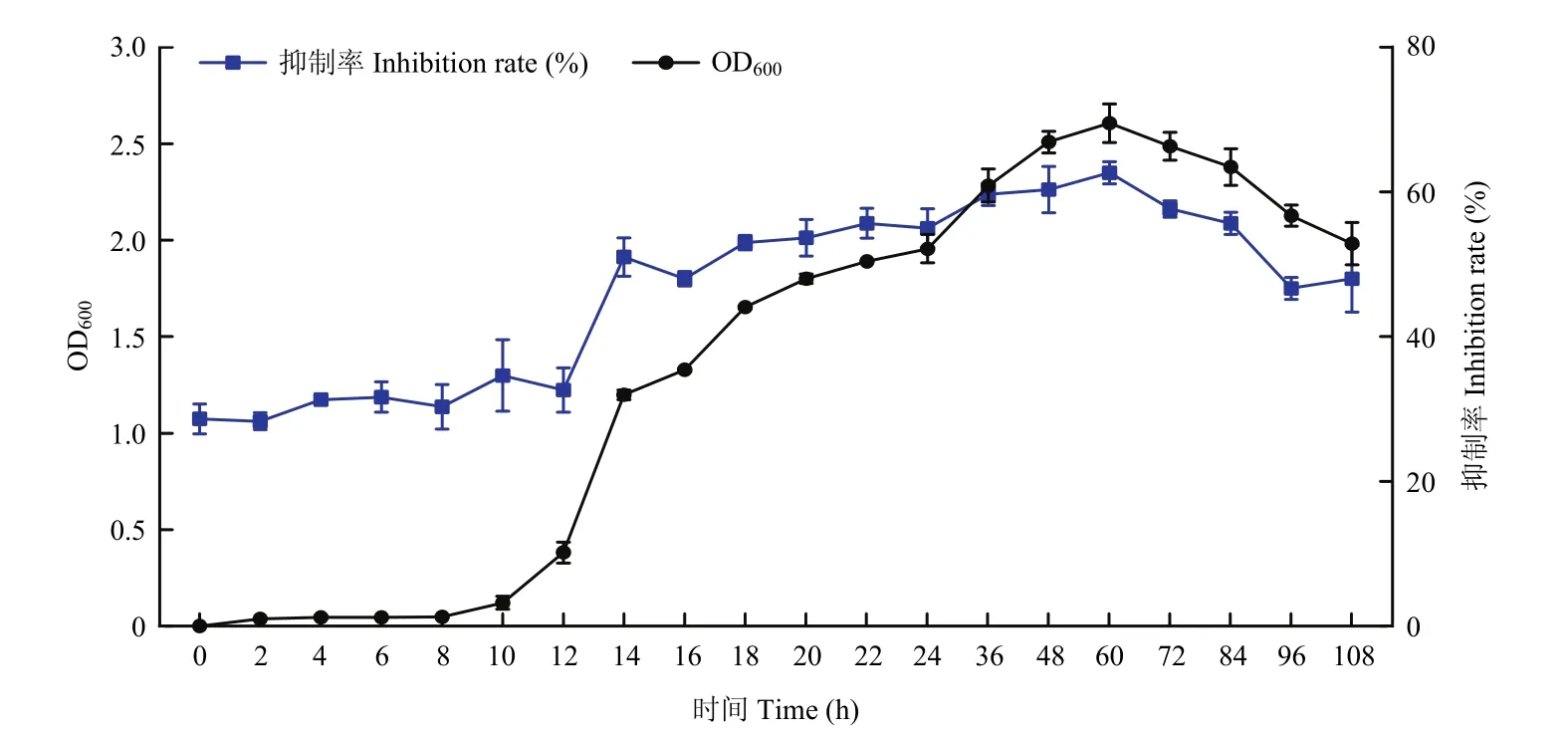
图13 菌株D5-8的生长曲线图Fig. 13 The growth curve of strain D5-8
2.4.11 发酵条件优化正交试验 根据上述单因素试验结果,各因素对D5-8菌体量都有影响,但影响较为显著的因素有发酵时间(A)、培养温度(B)和转速(C)。采用L9(33)正交表,设计3因素3水平的正交试验,进一步确定影响菌株D5-8菌体最佳发酵条件组合(表2),由极差R值可知,3 种因素对D5-8菌株菌体量影响力的强弱顺序为B(温度)>C(转速)>A(培养时间)。结合K值,最优发酵条件组合为A2B2C3,即温度28 ℃、转速210 r/min、培养时间60 h。

表2 菌株D5-8培养条件正交试验结果Table 2 Results of the orthogonal experiment about fermentation conditions of D5-8
2.5 拮抗菌株对烟草黑胫病盆栽试验防治效果
盆栽试验结果表明,发酵条件优化前、后的菌株D5-8发酵液对烟草黑胫病的保护防效分别为61.84%和66.89%,治疗防效分别为51.83%和53.72%,对烟草黑胫病均能够起到较好的防治效果,可以发现D5-8菌株优化后发酵液的防效高于优化前发酵液,但差异不显著(表3)。

表3 菌株D5-8对烟草黑胫病的防治效果Table 3 Control effect of strain D5-8 on tobacco black shank
3 讨论
细菌在自然界中种类多、数量大、生理特性丰富多样,分布极其广泛。现阶段研究发现芽胞杆菌属生防细菌对烟草寄生疫霉具有较好的防治效果[22]。生防类芽胞杆菌的主要作用机制为竞争、溶菌、诱导抗性、拮抗作用等[23-25]。同时对病原菌能产生多种抑菌物质,如酚类物质、抗菌蛋白、多肽类物质、表面活性物质等[26-28]。周瑚等[29]从水稻感病品种分离获得特基拉芽胞杆菌JN-369,并发现其挥发性物质(VOCs)、蛋白质类粗提物、脂肽类粗提物对稻瘟病具有抑制作用。杨艺炜[30]研究发现,生防菌株XF10能够产生具有抑菌活性的物质纤维素酶和蛋白酶。在目前已有的研究中,具有生防作用的有益细菌多来源于植株与根际土壤,其他来源特别是从昆虫肠道分离的相关报道较少[12]。本研究通过平板对峙法从美洲大蠊肠道分离筛选出一株对烟草疫霉具有较好抑菌作用的拮抗菌D5-8,通过形态观察,生理生化特征及16S rRNA基因序列分析初步鉴定为特基拉芽胞杆菌。通过对比发现,本研究的 D5-8菌株所产生的抑菌活性物质可能是抗菌蛋白、胞外酶等,具体的抑菌活性物质种类、机理等需后续进行深入的研究。
拮抗菌的生长繁殖和抗菌物质的产量不仅与菌株本身的特性息息相关,还和发酵条件(发酵培养基组分、培养条件)密不可分[21]。本研究将D5-8的菌体量与抑菌率作为试验指标,结果表明菌株D5-8的最优培养基为NYBD培养基,最优的碳源10.0 g/L麦芽糖,氮源为5.0 g/L的酵母浸粉;采用单因素试验及正交设计对发酵条件进行优化,结果表明最优的培养条件为温度28 ℃、pH值为6、转速210 r/min、装液量30 mL、接种量2%、时间60 h、光照4 h。不同的拮抗菌株,最适的生长条件不同,将影响其菌体量及对病原菌的抑制效果[2]。将菌株 D5-8的最优发酵条件与兰明先等[31]从泽兰实蝇幼虫消化道分离得到的特基拉芽胞杆菌ZLSY5和孙露等[32]使用实验室保存的特基拉芽胞杆菌WRN032的最优发酵条件相比,三者在最佳装液量的选择上相似,均在30%~40%;pH均为6,呈弱酸性;菌株D5-8的最佳接菌量高于菌株ZLSY5的1%和菌株WRN032的2%;D5-8与ZLSY5的最适培养温度均为28 ℃;三者的最佳培养时间也各不相同[31,32]。通过对比发现,3株菌均为特基拉芽胞杆菌,但其最佳发酵条件均不相同,可能菌株的来源与生存环境的差异,致使菌株对营养物质的吸收利用能力及最适发酵条件和生理特性各不相同。
特基拉芽胞杆菌不仅能够产生多种不同的抗菌物质,抑制植物病原菌的生长,而且能够促进植物生长和诱导植物产生抗性[33]。本研究筛选的拮抗菌株特基拉芽胞杆菌D5-8对烟草寄生疫霉具有较好的抑菌活性,温室盆栽试验中菌株发酵液对烟草寄生疫霉的保护防效达60%以上,治疗防效达50%以上。防治效果与程睿君[21]筛选的拮抗菌相当。李辉[23]研究表明,特基拉芽胞杆菌对稻瘟病的预防效果优于治疗效果。而且,不同来源的特基拉芽胞杆菌对其他作物病害也有较好的防治作用,但防治效果存在差异[29,34]。
综上所述,本研究初步明确了 D5-8菌株的分类地位,筛选并优化了该菌株的发酵条件,证明了该菌株对烟草寄生疫霉具有较好的抑菌效果,为其菌剂开发及对烟草黑胫病的防治应用提供了理论依据。在下一步的研究中,应加强对该菌的抑菌物质、生防机理以及对防治其他植物病害的筛选等方面的探究。
