有关基本概念和理论的计算问题
2022-04-21苗义法
苗义法
(山东省枣庄市第十六中学)
纵观近几年的高考化学试题,有关基本概念和理论的计算问题一直是稳中有变.稳定的是每年考查的知识点都以反应热、平衡转化率、平衡常数、电离常数、溶液的pH、溶度积等为主,变的是试题的情境和呈现方式,既体现了化学学科的本位,又体现了化学与其他学科的融合.学生在复习此部分知识时,要在掌握基本公式的基础上,依据一定的解题步骤,加强解题训练,总结归纳适合自己的解题方法,进而提高解答有关基本概念和理论计算题的能力.
1 有关平衡转化率和平衡常数的计算问题
平衡转化率和平衡常数是可逆反应进行程度的表征,是研究可逆反应的重要方式,在每年的高考中都有所体现,有些题是已知物质的初始浓度(或压强)和平衡浓度(或压强)求平衡常数和平衡转化率,有些题是已知平衡转化率和物质的初始浓度(或压强)求平衡常数,还有些题是已知平衡常数和物质的初始浓度(或压强)求平衡浓度及转化率.学生要加深对平衡转化率和平衡常数有关概念及两者关系的理解,此类试题的常见解答方法是“三段式”法.
例1废气中H2S热分解产生H2:2H2S(g)⇌S2(g)+2H2(g).现将0.20 molH2S(g)通入某恒压(压强p=aMPa)密闭容器中,不同温度下测得H2S分解反应的平衡转化率如图1所示.温度升高时,混合气体的平均摩尔质量_________(填“增大”或“减小”“不变”).温度为T4℃时,该反应的平衡常数Kp=________(用平衡分压来表示).

图1
解析
本题是已知平衡转化率和初始浓度计算平衡常数类试题,解题的关键是准确解读题给图示,从图示中找出解题所要的数据和信息.由图可知,随着温度的升高,H2S 的转化率逐渐增大,说明2H2S(g)⇌S2(g)+2H2(g)的正反应是体积增大的吸热反应,升高温度时平衡向正反应方向移动,混合气体的总物质的量逐渐增大,但气体总质量不变,所以混合气体的平均摩尔质量逐渐减小.由图可知,T4℃时H2S的平衡转化率是40%,即转化的物质的量为0.20mol×40%=0.08mol,由此列出“三段式”:

解答此类试题时学生需要注意:一是依据图示中曲线的变化趋势判断出所给可逆反应的正反应是吸热反应,抓住质量守恒定律推断出混合气体的平均摩尔质量的变化趋势;二是依据初始浓度和平衡转化率求出平衡时转化的H2S的物质的量,然后利用“三段式”法计算出平衡时3种物质的物质的量并推测出3种物质的平衡分压,最后求出平衡常数Kp.
2 有关电离常数和溶液pH 的计算问题
电离平衡主要存在于弱电解质的电离平衡中,在高考中常以选择题的形式出现,结合其他电离知识进行综合考查,正确计算电离常数的关键是准确分析出涉及的离子,再结合离子的化学计量数代入公式计算.有关溶液pH 的计算问题是相对难度较大的试题,在解答时要以pH=-lgc(H+)为基本依据,根据实际情境进行溶液中c(H+)的推理和计算,溶液类型不同,计算方法不同,主要分为单一型溶液、稀释型溶液和混合型溶液.
例225℃时,向100mL0.09mol·L-1BaCl2溶液中加入100mL0.1mol·L-1硫酸,生成BaSO4沉淀.已知溶液温度和体积的变化都忽略不计,则生成沉淀后体系中的pH 为_________.
解析
本题属于混合型溶液中pH 的计算问题,首先要判断是否有物质过量,然后计算反应后所得混合溶液中的c(H+),最后根据公式计算pH.BaCl2溶液和硫酸反应生成BaSO4沉淀和HCl溶液,其中硫酸过量,混合后溶液显酸性,溶液中的H+主要来自硫酸且一直存在于溶液中,物质的量不变,因此

生成沉淀后溶液体积为0.2L,则

答案1.
在计算溶液的pH 时要先初步判断最终溶液的酸碱性,若是酸性溶液,则先求最终溶液中的n(H+),再求c(H+),最后根据公式计算pH;若是碱性溶液,则先求最终溶液中的n(OH-),再根据Kw求出c(H+),最后根据公式计算pH.
3 有关溶度积的计算问题
高考中有关溶度积的计算问题是常见题型,且常结合其他元素知识进行综合考查,是每年高考中的重点题型.纵观近几年的高考化学试题,主要从溶度积和溶解度的换算、溶度积和平衡常数的换算、有关溶度积图像的计算等几种角度进行考查,沉淀溶解平衡图像题是近几年的考查热点.
例3已知:pCu =-lgc(Cu+),pX =-lgc(X-).298 K 时,Ksp(CuCl)=a×10-6,Ksp(CuBr)=b×10-9,Ksp(CuI)=c×10-12.在CuCl、CuBr、CuI的饱和溶液中,阳离子和阴离子的浓度关系如图2所示.下列说法正确的是().

图2
A.298 K 时,在CuCl的饱和溶液中加入少量NaCl,c(Cu+)和c(Cl-)都减小
B.图中x表示CuI饱和溶液中阳离子和阴离子的浓度关系曲线,且P点c(Cu+)=c(I-)
C.298K 时,增大M点的阴离子浓度,则y上的点向N点移动
D.298 K 时,CuBr(s)+I-(aq)⇌CuI(s)+Br-(aq)的平衡常数K的数量级为103
解析
根据图像可知,P点pCu=-lgc(Cu+)=3,c(Cu+)=10-3mol · L-1,pX =-lgc(X-)=3,c(X-)=10-3mol· L-1,则Ksp(CuX)=10-6,因此P点对应的是CuCl饱和溶液,即曲线x表示CuCl饱和溶液中阳离子和阴离子的浓度关系,则y、z分别表示CuBr、CuI饱和溶液中阳离子和阴离子的浓度关系.298K时,在CuCl饱和溶液中加入少量NaCl,c(Cl-)增大,温度不变,Ksp(CuCl)不变,则c(Cu+)减小,选项A、B错误.298K时,增大M点的阴离子浓度,温度不变,Ksp(CuBr)不变,则c(Cu+)减小,pCu=-lgc(Cu+)增大,即y上的点向M点的斜下方移动,选项C 错误.298 K 时,CuBr(s)+I-(aq)⇌CuI(s)+Br-(aq)的平衡常数
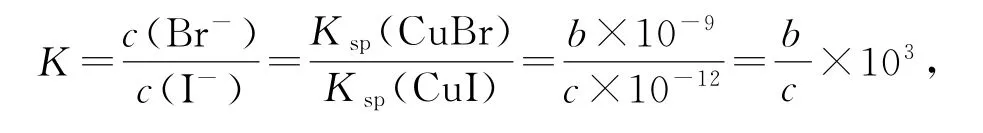
K的数量级为103,选项D 正确.答案为D.
在解答有关沉淀溶解平衡的图像题时看懂图像、联系规律、推理判断是关键,解答时要注意:曲线上的点表示饱和溶液,曲线上方的点表示过饱和溶液,曲线下方的点表示不饱和溶液;溶度积只与温度有关,与溶液中的离子浓度无关,温度不变时,无论改变哪种离子的浓度,另一种离子的浓度都在同一曲线上;涉及Qc的计算时,所代入的离子浓度一定是混合溶液中的离子浓度,因此计算离子浓度时,所代入的溶液体积也必须是混合溶液的体积.
综上,在解答此类试题时,首先要认真审题,掌握准确的试题信息,经过仔细推敲挖掘出试题中隐含的信息,找出解答试题的突破口,然后联系所学知识,依据基本公式确定解题思路,最后利用合适的方法得到正确的答案.
(完)
