多孔-亲水性H2TiO3离子筛微球的制备及其对Li+的吸附性能
2022-04-21秦冬玲孙朋飞王亚杰刘旻霞
仵 档,秦冬玲,孙朋飞,王亚杰,刘旻霞,杨 刚
(南京工业大学 材料化学工程国家重点实验室,江苏 南京 211800)
锂是原子半径最小的碱金属,也是密度最小的金属,具有独特物理化学性质的锂及其化合物在日常生活和科技发展中有着广泛应用,如电池、合金、陶瓷、核工业、医药、润滑油等行业[1-5]。中国的锂资源79%以上存在于盐湖卤水中,矿石锂储量相对较少,综合开采盐湖中储藏的锂资源已成为锂行业的热点。但我国盐湖卤水中Mg2+含量过高,镁锂比甚至高达500以上,使得Li+难以提取[6-7]。传统的共沉淀法只适用于镁锂比较低的体系,溶剂萃取法则需要使用大量的有机溶剂,存在污染环境、腐蚀设备等问题[8-9]。偏钛酸型锂离子筛因吸附容量大、稳定性高等优点受到人们广泛的关注。
1988年,日本科学家Onodera等[10]研究发现Li2TiO3经酸洗后对Li+有很好的选择性。之后,Chitraka等[11]、Lawagon等[12-13]、闫树旺等[14]、钟辉等[15]、李骁龙等[16]、张丽芬等[17]分别对钛系离子筛进行了研究,并取得了显著的成果。钛系离子筛虽然具有很多优势,但其呈粉末状,在循环操作过程中粉体流失较为严重,回收成本高,难以在实际生产中应用。为了解决这一问题,研究人员采用成膜[18-19]、造粒[20-22]、发泡[18,23]等方法对离子筛成型进行了研究,其中造粒法的研究最为广泛。肖国萍等[21]采用不同量的聚氯乙烯(PVC)作为黏结剂对LiMn2O4进行造粒研究,其对Li+的静态吸附量为2.50 mmol/g,吸附速率常数为1.03×10-5s-1,吸附速率较慢,受颗粒扩散控制。刘文涛等[22]以PVC为骨架对Li1.5Ti1.625O4离子筛进行造粒,PVC质量分数为15%时,对油田卤水中Li+吸附量为11.54 mg/g,吸附量较小。Lin等[24]将合成的离子筛微球应用于地热水中Li+的提取,在328.5 K时,12 h平衡吸附量为12.84 mg/g。李超等[25]将亲水性琼脂糖溶于去离子水中,加入离子筛混合后,加热搅拌,然后滴入液体石蜡中进行造粒,结果表明:琼脂糖质量分数为5%、加热90 ℃时效果最佳,造粒得到的离子筛微粒对Li+的吸附量是离子筛粉末对Li+吸附量的75.6%,吸附速率常数为1.77×10-5s-1,但琼脂糖易生物降解,力学强度差。闫树旺等[14]用三聚氰胺-甲醛作为TiO2离子筛的造粒原料,TiO2离子筛对Li+的饱和交换容量为29.4 mg/g,并具有良好的选择性。Sagara等[26]将MnO2溶于大孔纤维素溶胶微球中制得离子筛微球,其负载量为0.71 g/g,对Li+的吸附量为2.8 mmol/g。PVC具有较好的强度和耐酸碱性,但PVC亲水性差,造粒后易出现吸附量减小、吸附速率变慢等问题[22,25]。据文献[27]报道,聚乙二醇(PEG)是一种常用的造孔剂,具有较好的溶胀性,造孔性能优异;醋酸纤维素(CA)亲水性强,且与PVC具有较好的共混相容性,可使PVC的亲水性得到很大程度的提高[28-29]。
因此,在课题组前期合成Li2TiO3的基础上,笔者以PVC为原料,以N-甲基吡咯烷酮(NMP)为溶剂,以PEG为造孔剂,用CA作为亲水性物质对离子筛前驱体微球进行亲水改性,优化后的离子筛前驱体微球经酸洗脱锂活化,以期合成多孔-亲水性H2TiO3离子筛微球PEG/CA-PVC-HTO。采用扫描电子显微镜(SEM)对离子筛前驱体微球进行形貌分析,并对PEG/CA-PVC-HTO吸附Li+数据做动力学模型拟合,考察PEG/CA-PVC-HTO对Li+的选择性和循环吸附性能。
1 实验部分
1.1 主要原料及仪器
聚氯乙烯(PVC,K-value 68-65)、氯化铵(PT,NH4Cl),上海麦克林生化科技有限公司;醋酸纤维素(CA,乙酰基质量分数为39.8%,羟基质量分数为3.5%)、N-甲基吡咯烷酮(NMP,无水级,99.5%),阿拉丁试剂(上海)有限公司;聚乙二醇6 000(PEG-6 000),国药集团化学试剂有限公司;盐酸, 上海凌峰化学试剂有限公司:无水氯化锂(LiCl,质量分数为97%),西陇科学股份有限公司;氨水(质量分数为25%~28%),上海迈瑞尔化学技术有限公司;锂离子筛前驱体Li2TiO3,自制,测得其XRD图谱(图1)与Li2TiO3(JCPDS No. 033-0831)标准图谱相符合。
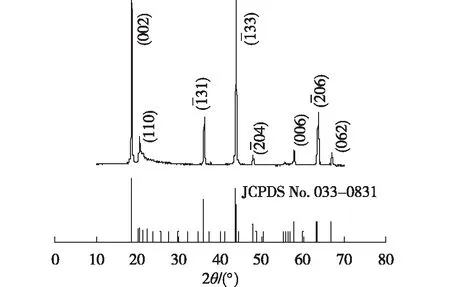
图1 锂离子筛前驱体Li2TiO3的XRD图谱Fig.1 XRD patterns of lithium ion sieve precursor Li2TiO3
冷场发射扫描电子显微镜(SEM,S4800型),日本日立公司;X线衍射仪(XRD,Miniflex600型),日本理学公司,Cu靶,管电压40 kV,管电流15 mA,衍射角(2θ)扫描区间10°~70°,扫描步长为0.02°,扫描速率为10 (°)/min;电感耦合等离子光谱仪(ICP),美国铂金埃尔默公司。
1.2 离子筛微球的制备方法
将6.6 mL NMP置于50 mL烧杯中,在磁力搅拌下,缓慢加入0.550 g PVC。待PVC完全溶解后,分别按表1的配比加入一定质量(m)的PEG和CA,搅拌使其溶解。随后缓慢加入1.600 g离子筛前驱体Li2TiO3,搅拌30 min得到浆液。用10 mL注射器吸取浆液,以每秒1滴的速度加到含有350 mL去离子水的500 mL烧杯中,得到微球颗粒。滴加完全后,静置60 min,用去离子水对微球颗粒进行多次冲洗, 过滤后放入50 ℃烘箱干燥24 h,得到离子筛前驱体微球。
按液固比120 mL/g在0.15 mol/L盐酸中加入离子筛前驱体微球,进行酸洗脱锂活化,65 ℃下搅拌4 h,过滤,洗涤至中性,50 ℃烘箱干燥24 h得到多孔-亲水性H2TiO3离子筛微球。将离子筛前驱体Li2TiO3直接经过相同的酸洗活化处理,得到的离子筛粉体标记为HTO;离子筛前驱体微球样品1经酸洗活化后得到的离子筛微球标记为PVC-HTO;离子筛前驱体微球样品6经酸洗活化后得到的离子筛微球标记为PEG/CA-PVC-HTO。
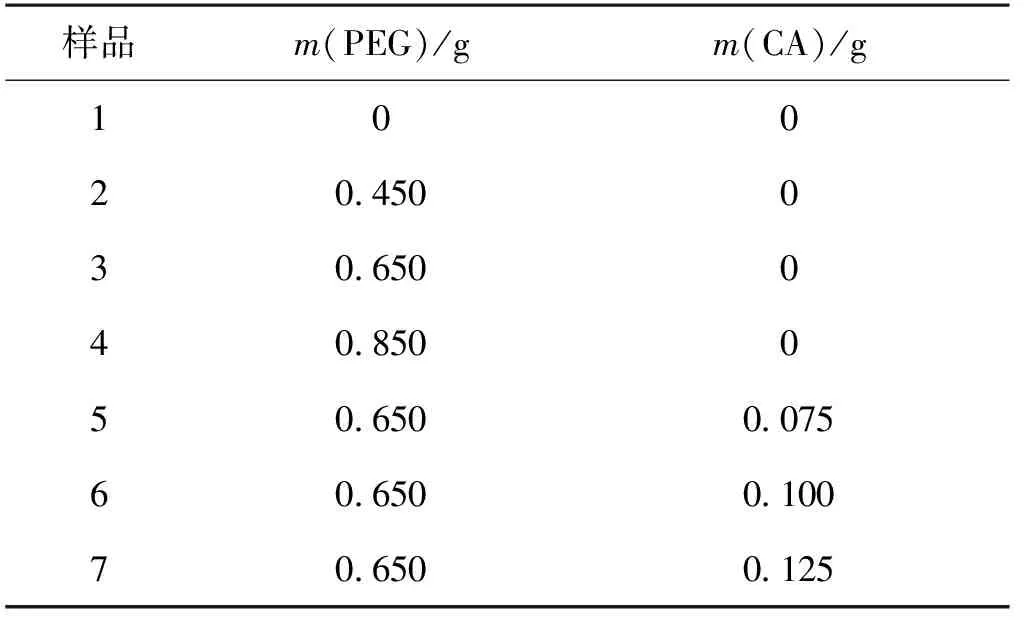
表1 离子筛前驱体微球的PEG和CA添加量
1.3 离子筛前驱体微球稳定性测定
称取1 g离子筛前驱体微球,加入含有100 mL去离子水的锥形瓶中,密封,室温下,将其放入超声波振荡器中,震荡24 h,然后抽滤,在50 ℃下干燥24 h,称取干燥后离子筛前驱体微球的质量,按式(1)计算其质量损失率。质量损失越大,离子筛前驱体微球的稳定性就越差。
ω=(m0-me)/m0×100%
(1)
式中:ω为样品的质量损失率,%;m0为加入样品的质量,g;me为处理后样品的质量,g。
1.4 离子筛微球的吸附实验
用LiCl配制质量浓度为100 mg/L的含Li+溶液,用配制好的氨水-氯化铵缓冲溶液(摩尔比4∶1)调节溶液pH为10,在固液比为1 g/L、35 ℃条件下进行离子筛微球对Li+的吸附试验。每隔一段时间取样,经0.45 μm滤头过滤后,用ICP检测样品中的Li+含量。
1.5 吸附动力学拟合
在与1.4节相同的条件下,磁力搅拌吸附24 h,每隔一段时间取样,用ICP测定溶液中Li+含量,计算微球吸附量,并按式(2)和(3)对其做拟一级动力学和拟二级动力学拟合。
ln(qe-qt)=lnqe-K1t
(2)

(3)
式中:qe为平衡吸附量,mg/g;qt为t时的吸附量,mg/g;K1为一级吸附速率常数,h-1;K2为二级吸附速率常数,g/(mg·h)。
1.6 选择性实验

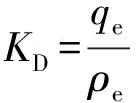
(4)

(5)
式中:ρe为平衡质量浓度,KD1为对Li+吸附的分配系数,KD2为对其他金属离子(K+、Ca2+、Na+、Mg2+)吸附的分配系数。
1.7 循环吸附实验
吸附条件:在与1.4相同的条件下,磁力搅拌吸附12 h,过滤,50 ℃下干燥24 h。解吸条件:用浓度为0.05 mol/L的HCl溶液,按固液比10 g/L加入吸附后的离子筛微球,在65 ℃下酸洗4 h,然后过滤,洗涤至中性,50 ℃下干燥24 h。将解吸后的离子筛微球直接用于重复实验。
2 结果与讨论
2.1 PEG添加量对离子筛前驱体微球和离子筛微球性能的影响
不同PEG添加量的离子筛前驱体微球(不添加CA)的表面形貌和稳定性测试结果分别见图2和表2。由图2可知:随着PEG的增加,离子筛前驱体微球表面孔的数目也逐渐增多,这是由于PEG具有造孔作用。同时,由表2可知:PEG添加量在0、0.450和0.650 g时,离子筛前驱体微球质量损失较小;当PEG添加量在0.850 g时,离子筛前驱体粉体脱落较为明显,离子筛前驱体微球质量损失率达到0.14%,说明PEG添加量过多会导致离子筛前驱体微球表面的孔过多,对离子筛前驱体粉体的包覆性能下降,离子筛前驱体微球的稳定性降低,使得其质量损失增大。

图2 不同PEG含量离子筛前驱体微球的SEM照片Fig.2 SEM images of ion sieve precursor microspheres with different PEG contents
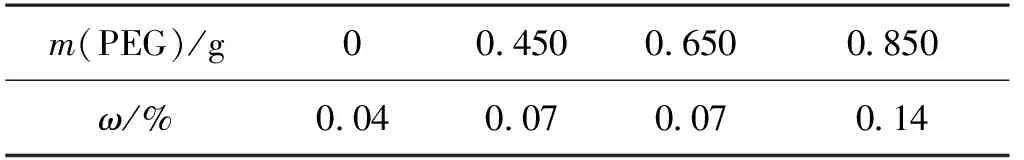
表2 PEG添加量对离子筛前驱体微球强度的影响
图3为PEG添加量对离子筛微球吸附Li+性能的影响。由图3可知:PEG添加量的增加有利于离子筛微球对Li+的吸附。PEG添加量在0.450、0.650和0.850 g时,吸附9 h即可达到吸附饱和的85%以上。这是由于随着PEG的增多,离子筛微球表面孔的数目逐渐增加,使得Li+可以快速地扩散到微球内被离子筛粉体吸附。因此,综合考虑离子筛前驱体微球稳定性和离子筛微球对Li+的吸附效果,选择0.650 g作为优化的PEG添加量。
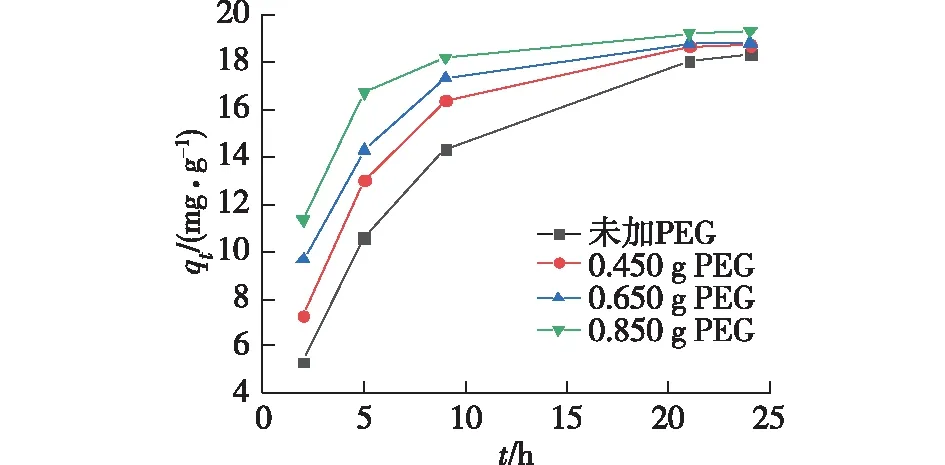
图3 PEG添加量对离子筛微球吸附Li+性能的影响Fig.3 Effects of PEG addition on Li+ adsorption performance of ion sieve microspheres
2.2 CA添加量对离子筛微球吸附Li+性能的影响
固定PEG的添加量为0.650 g,研究CA添加量对离子筛微球吸附Li+性能的影响,结果见图4。由图4可知:当CA添加量分别为0、0.075和0.100 g时,随着CA添加量增加,离子筛微球的吸附速率增加,吸附量也有一定的提升。这是由于CA的添加使离子筛微球的亲水性增强,Li+可以快速地扩散到微球内被离子筛粉体吸附。当CA添加量为0.125 g时,离子筛微球吸附速率和吸附量有所下降,这可能是因为CA虽然能够改善离子筛微球的亲水性,但CA的添加也会增加对离子筛粉体的包裹作用,CA含量过多,对离子筛粉体的包裹过强,使得Li+的扩散路径变长,阻碍了Li+和离子筛粉体的接触。因此,选择0.100 g作为优化的CA添加量。
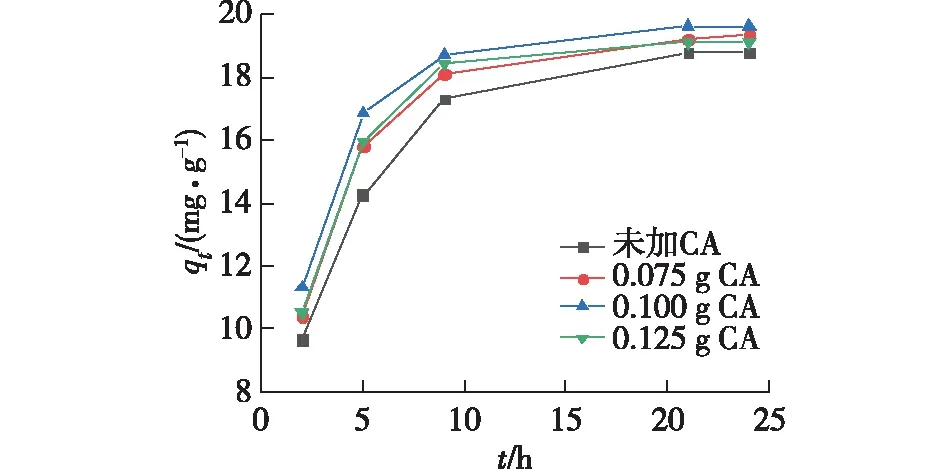
图4 CA添加量对离子筛微球吸附Li+性能的影响Fig.4 Effects of CA addition on Li+adsorption performance of ion sieve microspheres
2.3 HTO、PVC-HTO、PEG/CA-PVC-HTO吸附Li+的性能
图5为HTO、PVC-HTO和PEG/CA-PVC-HTO对Li+的吸附量随时间的变化。由图5可知:离子筛粉体HTO可快速吸附Li+,在5 h基本达到吸附饱和;用PVC对离子筛进行造粒成型后,由于离子筛粉体被包裹在PVC内部,PVC-HTO吸附速率变慢,吸附量降低;与PVC-HTO相比,经过PEG、CA改性后的离子筛微球PEG/CA-PVC-HTO的吸附速率明显加快,吸附量也有所增加, 5 h的吸附量为16.46 mg/g,达到吸附平衡的83%以上。PEG的造孔和CA的亲水改性,使得Li+更容易进入到离子筛微球内与离子筛粉体接触,因而改性后的离子筛微球PEG/CA-PVC-HTO可以快速地吸附Li+。
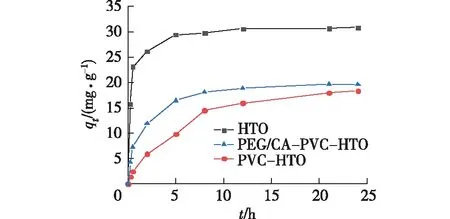
图5 HTO、PVC-HTO、PEG/CA-PVC-HTO对Li+的吸附性能Fig.5 Adsorption properties of HTO, PVC-HTO, PEG/CA-PVC-HTO to Li +
2.4 PEG/CA-PVC-HTO吸附Li+的动力学模型拟合
为进一步认识PEG/CA-PVC-HTO吸附Li+的机制,利用拟一级和拟二级动力学方程对PEG/CA-PVC-HTO吸附Li+的数据做拟合分析。图6为PEG/CA-PVC-HTO吸附Li+的动力学模型拟合结果。由图6可知:PEG/CA-PVC-HTO在吸附Li+时,初始阶段吸附活性位点较多,吸附速率较快,随着吸附时间的延长,吸附活性位点被占据,吸附速率变得缓慢,直到吸附饱和,吸附量为19.62 mg/g。表3为PEG/CA-PVC-HTO吸附Li+的动力学模型拟合参数。由表3可知:拟二级动力学线性拟合度(相关系数R2=0.992 6)要高于拟一级动力学的线性拟合度(R2=0.964 7),说明PEG/CA-PVC-HTO吸附Li+时受化学吸附机制控制,吸附速率为0.044 2 g/(mg·h)。

图6 PEG/CA-PVC-HTO吸附Li+的动力学模型拟合Fig.6 Adsorption kinetic model fittings of PEG/CA-PVC-HTO to Li+
2.5 PEG/CA-PVC-HTO对Li+的选择性
在K+、Na+、Ca2+、Mg2+存在的条件下,研究PEG/CA-PVC-HTO对Li+的选择性,结果见表4。由表4可知:PEG/CA-PVC-HTO对Li+的吸附量较大(14.23 mg/g),而对其他离子吸附量较小,其中镁锂分离系数达202.64,因此,PEG/CA-PVC-HTO对Li+具有较好的选择性。Li2TiO3酸洗脱锂后留下的孔隙对Li+具有识别作用,其空间大小仅能容下离子半径较小的Li+,而离子半径较大的K+、Na+等则被挡在外面,Mg2+离子半径(0.072 nm)与Li+离子半径(0.074 nm)接近,但Mg2+的水合能是Li+的4倍,在吸附过程中Li+更易脱水被吸附,因此,PEG/CA-PVC-HTO对Li+具有较好的选择性。

表3 PEG/CA-PVC-HTO吸附Li+的动力学模型拟合参数
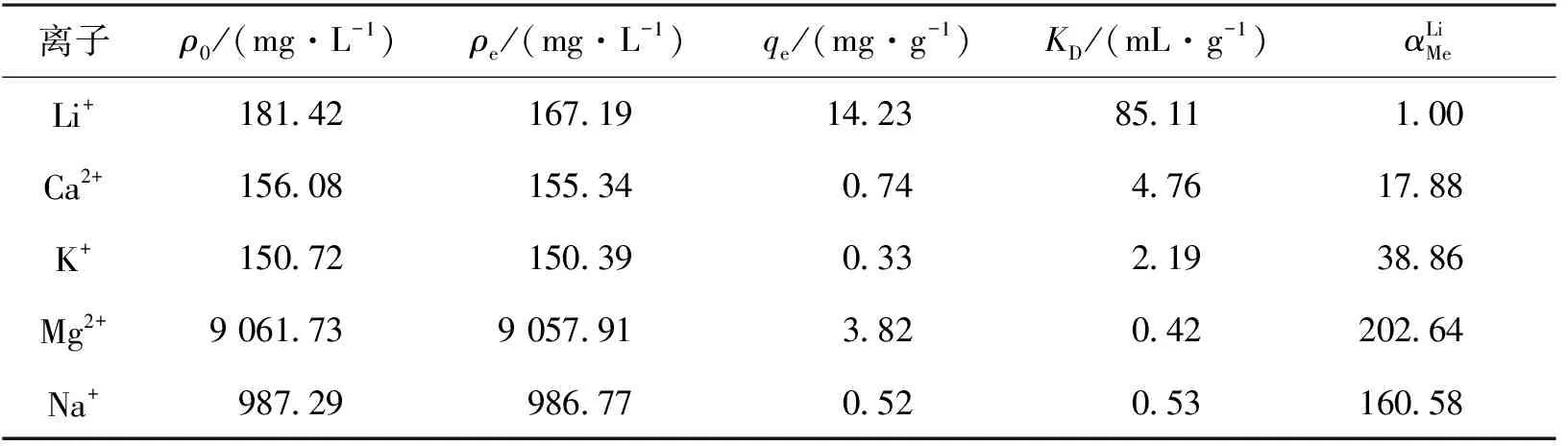
表4 PEG/CA-PVC-HTO对Li+的选择性
2.6 PEG/CA-PVC-HTO对Li+的循环吸附性能
研究PEG/CA-PVC-HTO对Li+的循环吸附性能,结果见图7。由图7可知:PEG/CA-PVC-HTO第1次吸附量最高为19.67 mg/g;随着循环吸附次数的增加,吸附量有所下降,这是因为PEG/CA-PVC-HTO内的离子筛粉体的部分吸附活性位点不稳定,Li+的多次嵌入和脱出导致其结构受到破坏,从而失去对Li+的部分吸附性能;5次循环吸附时,PEG/CA-PVC-HTO对Li+的吸附量仍然维持在较大的水平(14.63 mg/g),仍能保持着较好的吸附效果。因此,H2TiO3具有可循环再生性能,可用于对Li+的循环吸附。

图7 PEG/CA-PVC-HTO对Li+的循环吸附Fig.7 Cyclic adsorption of Li+ by PEG/CA-PVC-HTO
3 结论
1)以PVC为黏结剂,以NMP为溶剂,对合成的Li2TiO3进行造粒,用PEG作为造孔剂,用CA作为亲水性物质对离子筛前驱体微球进行改性。PEG的添加会使离子筛微球表面产生孔,使得Li+可以快速地扩散到微球内。但PEG添加量过多会导致离子筛前驱体微球表面的孔过多,使离子筛前驱体微球的稳定性降低。CA能够改善PVC的亲水性,但CA添加过多会增强对离子筛粉体的包裹作用,阻碍Li+和离子筛粉体接触。经实验优化,PEG的添加量为0.650 g、CA的添加量为0.100 g时,制备的多孔-亲水性离子筛微球PEG/CA-PVC-HTO对Li+具有较好的吸附性能。
2)PEG/CA-PVC-HTO对Li+吸附动力学符合拟二级动力学模型,饱和吸附量达19.62 mg/g,吸附速率常数为0.044 2 g/(mg·h);在K+、Na+、Ca2+、Mg2+存在的条件下,PEG/CA-PVC-HTO对Li+吸附量为14.23 mg/g,镁锂分离系数为202.64,对Li+具有较好的选择性。
3)PEG/CA-PVC-HTO吸附Li+后,用0.05 mol/L的HCl溶液进行解吸。经5次循环吸附,PEG/CA-PVC-HTO对Li+吸附量仍能保持在14.63 mg/g,表现出良好的可循环再生性能,可用于对Li+的循环吸附。
