急性前葡萄膜炎患者血清TL1A的变化及意义探究
2022-04-21严晶
严 晶
(云南省曲靖医学高等专科学校 云南曲靖 655000)
葡萄膜炎的分类可以基于眼内炎症的解剖学参与或病因。解剖学分类包括前葡萄膜炎、中间葡萄膜炎、后葡萄膜炎和全葡萄膜炎[1]。一般人群中葡萄膜炎类型是急性前葡萄膜炎(acute anterior uveitis,AAU),其是一种常见的炎症性眼病,主要影响虹膜和前睫状体[2]。通常,AAU患者会突然出现发红、疼痛、畏光和视力模糊,这些症状通常持续不到3个月。鉴于AAU主要影响20至50岁的人群,因此个人和人口负担很重。人类白细胞抗原(HLA)-B27与AAU密切相关。HLA-B27阳性AAU表现出更显着的细胞和纤维蛋白渗出到房水中、更高的复发趋势以及与强直性脊柱炎的更强关联[3]。但仍有约50%的病例AAU的病因尚不清楚。最近的研究结果表明,除HLA-B27之外的各种其他遗传因素也与AAU相关[4]。长期以来,人们一直在研究AAU和炎症过程之间的关系,T细胞在葡萄膜炎的发病机制中起重要作用[5]。近期研究表明,TNFSF15基因编码的TL1A(tumornecrosisfactor-likecytokine1A)蛋白可以调节T细胞的分化和活化[6]。且Hua等证实TNFSF15-rs3810936与AAU之间存在关联,并表明TL1A通路可能与该疾病的发病机制有关[7]。但目前关于血清中TL1A是否在AUU患者存在异常,是否与患者疾病严重程度存在关联,并不清楚。
1材料与方法
1.1纳入患者和临床数据
2019年10月至2021年3月连续招募AAU患者31例,所有招募的患者和评估标准均符合我国急性前葡萄膜炎临床诊疗专家共识(2016年)中的标准[8]。收集患者病史的详细信息,包括招募年龄、性别、HLA-B27状态和系统性疾病史如AS等。
纳入标准:非复发患者,病程3月内,符合AAU诊断标准。排除标准:合并感染患者;AAU是外伤所致患者;患有心血管疾病、糖尿病、肥胖症、肿瘤、淀粉样变性或其他自身炎症性疾病;近1个月内接受过糖皮质激素或免疫抑制剂等药物;妊娠或哺乳期患者。同步纳入30例健康人群作为研究的对照组,两组人群年龄和性别构成比匹配。
1.2标本采集及血清TL1A及IL-17的浓度测定
采集清晨空腹静脉血3mL于非抗凝管中,静置15min后离心分离血清,置于超低温冰箱保存备用。血清TL1A和IL-17(Interleukin,IL-17)测定所需试剂盒均购自上海朗顿生物科技有限公司。所有步骤均严格按照试剂盒操作说明书执行。
1.3治疗方案
AAU治疗整体治疗方案应遵循个性化原则。AAU主要治疗药物包括糖皮质激素冲击、糖皮质激素滴眼液、睫状肌麻痹剂和非甾体抗炎药物滴眼液等。该研究中患者给予注射用甲泼尼龙琥珀酸钠500mg/d 静滴,连续3d后改为强的松片口服,并逐渐减量。
1.4统计学处理
利用SPSS 23.0统计软件分析,正态分布计量资料采用均数±标准差表示,组间比较采用独立样本t检验。非正态分布的计量资料组间比较采用Mann-Whitney U检验。计数资料用百分率表示,组间比较采用卡方检验。治疗前后指标比较采用配对样本t检验。使用皮尔逊相关系数量化变量之间的相关性。定义双侧p<0.05为差异达到统计学意义。
2结果
2.1两组人群一般资料比较
AAU患者和对照组的人口统计学、临床和血液学变量的比较结果见表1所示。与对照组相比,AAU患者具有更高水平的CRP、ESR、WBC及NEU(p<0.05),而两组人群PLT数量的差异则无统计学意义(p>0.05)。

表1 AAU与对照组一般资料比较
2.2AAU患者血清TL1A及IL-17浓度的变化
如图1所示,AAU患者血清TL1A和IL-17浓度显著高于健康对照组,差异均具有统计学意义(p<0.05)。此外,AAU患者中HLA-B27+的患者相较HLA-B27-的患者具有更高水平的血清TL1A和IL-17,差异均具有统计学意义(p<0.05)。
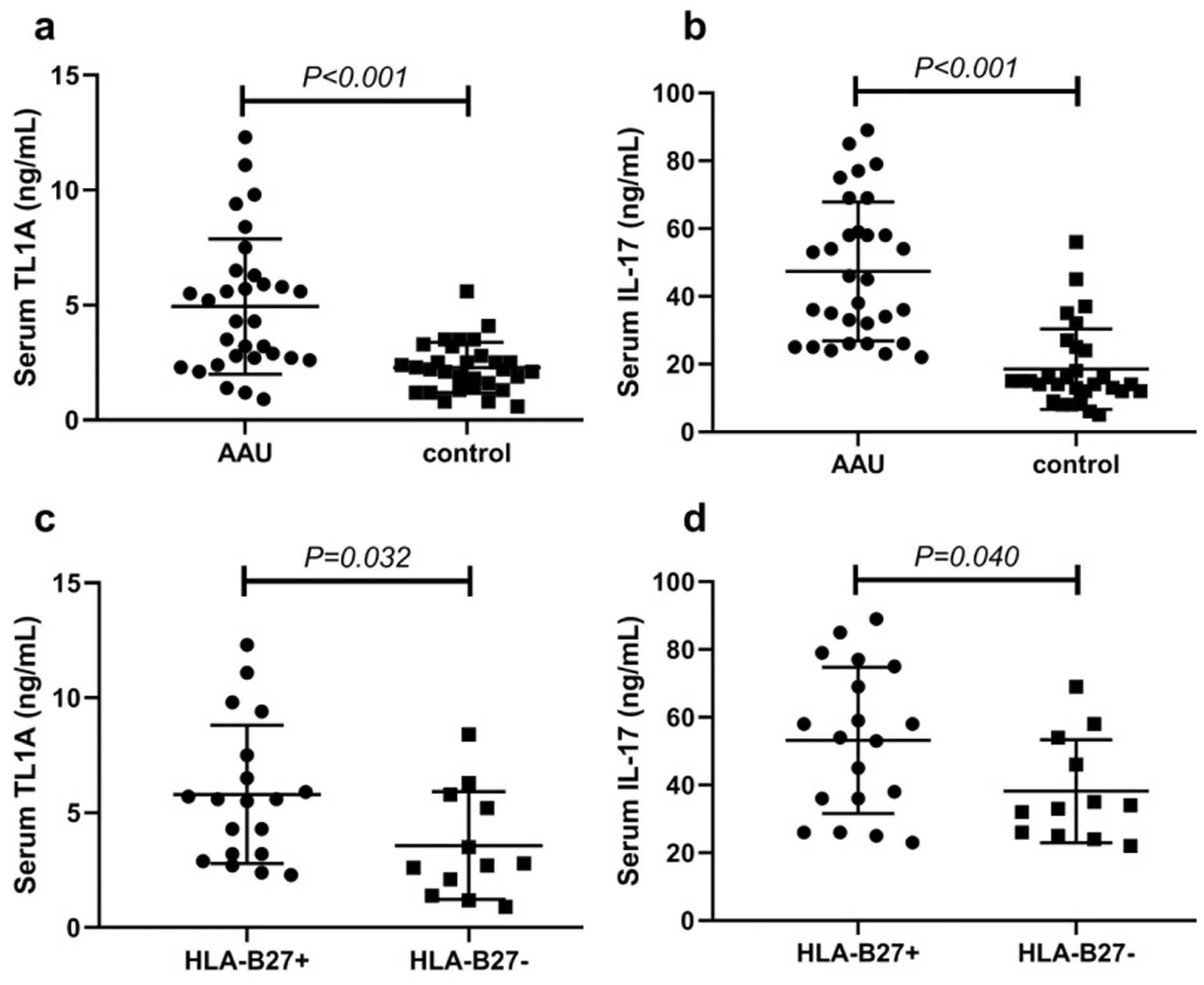
图1 AAU患者血清TL1A及IL-17浓度的变化
2.3 AAU患者血清TL1A与IL-17浓度的相关性分析
Spearman相关性分析结果显示AAU患者中血清TL1A与IL-17浓度呈显著正相关性,R=0.4307,p=0.0156。

图2 AAU患者血清TL1A与IL-17浓度的相关性
2.4 AAU患者治疗前后TL1A与IL-17浓度的比较
治疗后AAU患者血清IL-17和TL1A浓度较治疗前均显著下降,且差异均具有统计学意义(p<0.05),具体见图3。
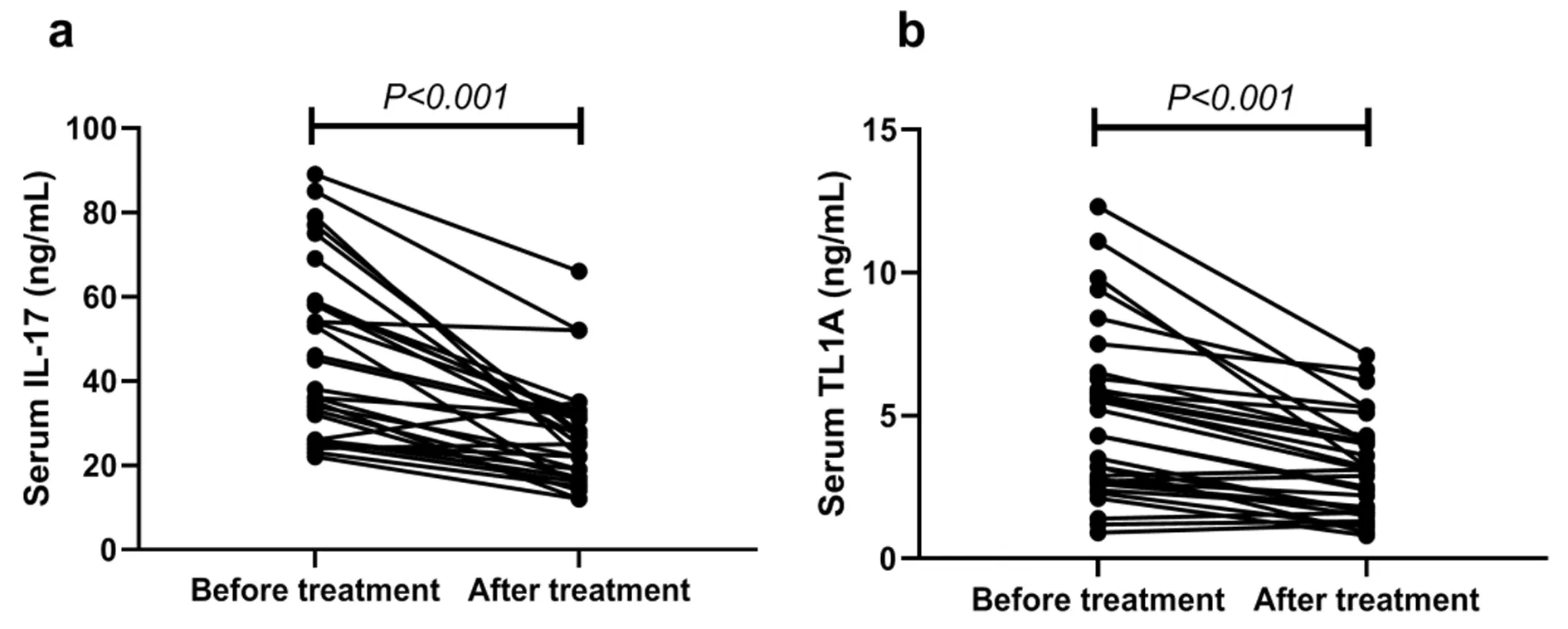
图3 AAU患者治疗前后血清TL1A与IL-17浓度的变化
3讨论
TL1A是TNF超家族成员之一,其可通过与DR3结合发挥生物学作用。先前研究表明,重组TL1A可增强TCR激活的CD4+T细胞IFN-γ分泌能力,并与IL-12和IL-18协同刺激TCR非依赖性分泌IFN-γ[9]。此外,据报道小鼠记忆CD4+T细胞可响应TL1A刺激进而增殖,而幼稚的CD4+T细胞对此并无反应。近期研究发现与Th1和Th2细胞相比,Th17细胞中的DR3表达更强,且发现TL1A在调节Th17分化中的发挥重要作用[10]。尽管TL1A蛋白在体外通过增加IL-2的产生抑制Th17分化,但在没有IL-2信号传导的情况下促进了Th17分化。这也证实TL1A可促进Th17介导的主要促炎途径[11]。在葡萄膜炎小鼠淋巴结细胞中DR3表达呈现显著高水平,而缺乏TL1A的小鼠其疾病严重程度显著降低[12]。但并未有研究报道在人AAU患者中TL1A的表达变化及其与Th17细胞效应细胞因子IL-17的关系。Zou W等发现AAU患者外周血Th1细胞和Th17细胞的比例显著升高,而Treg则低于对照组。并证实Th17细胞水平与AAU疾病活动评分呈正相关,而与Th1和Treg频率无关[13]。这些结果提示Th17在AAU患者中扮演重要角色。与小鼠中的结果类似,本研究发现AAU患者血清TL1A和IL-17均显著升高,且两者之间存在显著正相关性,这也进一步提示AAU中TL1A可能是通过调控Th17途径发挥促炎效应。在其他免疫性疾病中也发现了TL1A的异常高表达,诸如类风湿性关节炎、银屑病、原发性胆汁性肝硬化、炎症性肠病和强直性脊柱炎等[9]。而用TNF-α阻断抗体治疗类风湿性关节炎患者后血清TL1A水平则显著下降[14]。这也提示TL1A水平或可作为反应疾病严重程度的生物标志物。Li H等使用TaqMan SNP基因分型分析和 PCR 限制性片段长度多态性技术在983名AAU患者和1128名健康对照中检测了8个单核苷酸多态性,结果发现在汉族人群AAU患者中发现TNFSF15-rs3810936中TT基因型的频率显著降低,研究表明TL1A编码基因TNFSF15与AAU之间存在关联,并表明 TL1A通路可能与该疾病的发病机制有关[7]。这一结果与该研究契合。
HLA-B27与AAU高度相关,与HLA-B27-AAU相比,HLA-B27+AAU可表现出独特的临床特征[15]。在该研究中,发现HLA-B27+AAU患者的TL1A和IL-17水平均高于HLA-B27-AAU患者。先前的研究表明,HLA-B27可能会影响肠道和/或眼睛本身,其中耐受性的丧失可能会导致葡萄膜炎发生[16]。Dai ML等报道与HLA-B27-AAU患者相比,HLA-B27+AAU患者具有更高水平的炎性标志物血清淀粉样蛋白A[18]。以上结果表明HLA-B27+AAU患者具有更强的免疫炎症反应,可体现在TL1A和IL-17等促炎因子的显著增加。
然而,这项研究存在一些局限性。首先,异常升高且与IL-17密切相关的TL1A虽提示其可能通过Th17参与AAU的发病机制,但需要通过进一步的实验研究加以阐明。其次,该研究纳入病例31例,并不足以反应所有群体的情况,在未来需要扩大样本量行多中心研究。此外,该研究并未分析治疗后患者的TL1A水平变化。
总之,该研究表明AAU患者的血清TL1A异常升高,且与IL-17和HLA-B27状态密切相关,提示其可能参与了AAU的免疫反应过程。
