股骨头坏死愈胶囊对酒精干预大鼠成骨细胞碱性磷酸酶表达的影响*
2022-04-20陈晓波孙永强
孙 楠,陈晓波,李 纳,丁 强,孙永强
(河南省洛阳正骨医院,河南 郑州 450016)
股骨头坏死(osteonecrosis of the femoral head,ONFH)是临床常见的难治性疾病之一,一般分为创伤性和非创伤性两种。非创伤性ONFH多见于中青年,致病因素多达40余种,其中大量酗酒是其主要原因之一。研究[1]显示,20%~45%的ONFH与饮酒有关。过度饮酒可影响局代谢正常进行,同时可导致脂代谢异常、骨髓间充质干细胞异常分化。若ONFH未经有效治疗,则股骨头塌陷使关节功能损毁,严重影响患者的生活质量,因此如何预防和治疗ONFH成为骨科领域的一项世界性难题。非创伤性ONFH的病因最常见为激素和酒精。二十世纪七十年代报道的非创伤性ONFH病例中,酒精性占39%~74%[2];而激素性ONFH,1960 年以前仅见20余例,1964-1977年间增至450例[3]。在2000年的报道中,酒精性ONFH占46%,激素性ONFH占34%[4],酒精因素所占的比例高于激素。伴随医学的发展、激素的广泛使用,激素性ONFH日渐增多。2003年,激素性ONFH占50%,酒精性ONFH占27%[5];2006年,激素性ONFH占49.7%,酒精性ONFH占33.6%[6]。目前,虽然酒精在ONFH致病因素中所占比例已被激素超过,但仍是主要的致病因素。酒精性ONFH的病因病机尚不明确,故其治疗效果欠佳。股骨头坏死愈胶囊是河南省洛阳正骨医院治疗股骨头坏死的经验方,由鹿茸、杜仲、续断、黄芪、鸡血藤、连翘、乳香(制)、没药(制)组成,由河南省洛正制药厂生产,具有一定的临床疗效[7-10]。本实验采用酶消化法分离SD鼠新生24 h内乳鼠股骨中成骨细胞,原代培养,取P3代细胞消化制成单细胞悬液。通过观察股骨头坏死愈胶囊对体外培养的大鼠成骨细胞碱性磷酸酶(alkaline phosphatase,ALP)表达的影响来进一步探索股骨头坏死愈胶囊对骨代谢的作用,以期为揭示其治疗ONFH的作用机制提供细胞层面的理论依据。
1 材料与方法
1.1 动 物
无特定病原体(specific pathogen free, SPF) 级SD大鼠新生24 h内乳鼠6只,不计体质量、不分雌雄,由河南省动物实验中心提供,动物生产许可证号为SCXK(豫)2019-0002,动物使用许可证号为SYXK(豫)2020-0008。
1.2 药品、试剂与仪器
股骨头坏死愈胶囊,河南省洛阳正骨医院产品,批号20200507,0.35 g×60粒;胎牛血清(FBS),以色列BI公司产品,批号04-001-1A;L-DMEM培养基(批号31600)、青链霉素混合液(100×,细胞培养专用,批号P1400)、核糖核酸酶A(RNase A,批号R8020)、碘化丙啶(PI,批号C0080)、高效RIPA裂解液(批号R0010),均为北京索莱宝科技有限公司产品;磷酸缓冲盐溶液(PBS,批号PWL050)、苏木精-伊红(HE)染色试剂盒(批号MB9898)、细胞增殖及毒性检测试剂盒(CCK8,批号MA0218),均为大连美仑生物技术有限公司产品;无水乙醇,天津市富宇精细化工有限公司产品,批号64-17-5;Rat BALP ELISA KIT,上海凡科维生物技术有限公司产品,批号F40061-A;BCA蛋白浓度测定试剂盒,北京全式金生物技术有限公司,批号DQ111-01。CHW-160L型CO2培养箱,常州金坛良友仪器有限公司产品; Tecan Spark酶标仪,帝肯(上海)贸易有限公司产品;RJ-TGL-1850R型医用离心机,瑞江市分析仪器有限公司产品;NovoCyte流式细胞仪,美国安捷伦科技(中国)有限公司产品;EZ4型普通显微镜,德国徕卡显微系统(上海)贸易有限公司产品;TE2000-E型尼康倒置显微镜,日本尼康株式会社产品;JY600C型电泳仪,北京君意东方电泳设备有限公司产品。
1.3 成骨细胞的分离培养
将乳鼠颈椎脱臼处死,置体积分数750 mL/L乙醇溶液内浸泡10 min;取出后放入培养皿,取双侧股骨,剔除肌肉组织,放入PBS缓冲液浸泡;剪下股骨头,用眼科手术剪剪碎;PBS冲洗3次,冲洗干净;加质量分数2.5 g/L胰蛋白酶4 mL消化30 min,自然沉淀后去上清;组织块加质量分数1.5 g/LⅡ型胶原酶5 mL,于37 ℃消化3 h;加4 mL含体积分数100 mL/L FBS的L-DMEM培养基终止消化收集细胞,以10 cm的离心半径、1 000 r/min的转速离心5 min;弃上清,调整细胞密度,转移入25 cm2培养瓶中,使用100 mL/L FBS-L-DMEM培养基进行贴壁培养,置于37 ℃、含体积分数50 ml/L的CO2培养箱中培养;每3天更换1次培养液;待生长细胞铺满平皿80%后,进行传代、冻存及各阶段实验。
1.4 检测指标
1.4.1 成骨细胞形态学观察
取P0、P1和P2代细胞,以质量分数2.5 g/L胰蛋白酶消化;制成细胞悬液,调整细胞密度;将盖玻片置于培养皿中,接种细胞,置入体积分数50 mL/L的CO2培养箱中;待细胞长成单层,取出盖玻片,PBS冲洗3次;体积分数950 ml/L乙醇溶液浸泡15 min;PBS冲洗2次,每次冲洗1 min; HE染色;中性树胶封片;普通显微镜观察。
1.4.2 成骨细胞CCK8法绘制细胞生长曲线
取P2代成骨细胞,按1×104个细胞/孔接种于10个96孔板,每组设置4个重复,常规培养24,48,72,96,120,144,168,192,216,240 h。于上述10个时间点,各取一板,向每孔加入10 μL CCK8溶液的培基(CCK8溶液与培养基按照1∶9的比例混匀),37 ℃下培养2 h,测量450 nm处 OD值,绘制生长曲线,以了解成骨细胞生长周期从而确定药物干预时间、测定时间点。
1.4.3 成骨细胞ALP表达
取P3代细胞消化制成单细胞悬液。设股骨头坏死愈胶囊组、酒精组和空白对照组(培养基组)。股骨头坏死愈胶囊组设140,210,280,336,420,560,672,750,840 mg/L 9个药物梯度。酒精组给以酒精浓度为0.09 mol/L的培养基,股骨头坏死愈胶囊组给以0.09 mol/L酒精及相应浓度的股骨头坏死愈胶囊溶液的培养基,在同等条件下培养;于培养第7天和第14天收集上清液,检测ALP含量;收集对应的细胞提取蛋白,求取单位蛋白含量下对应的ALP含量。根据ALP含量选取关键药物浓度值,分别测定关键药物浓度值组、空白对照组,酒精组培养第7天和第14天的ALP蛋白含量,并进行组间比较。
1.5 统计学方法

2 结 果
2.1 成骨细胞形态学观察
普通显微镜观察分离纯化的P0、P1和P2代成骨细胞,可见:各代细胞均呈现单层分布,呈单核梭形细胞、单核三角形细胞及单核多边形细胞,活跃的成骨细胞为梭形、锥形,胞浆嗜碱性。细胞核位于细胞的一端,核仁明显,表面有短的突起与相邻细胞连接,细胞紧密排列。镜下观符合成骨细胞的特点。见图1。
2.2 成骨细胞生长曲线
P2代成骨细胞生长曲线较为典型。根据生长曲线可知:24~72 h,细胞生长较为缓慢,故可将此期视为潜伏期;96~192 h,细胞呈现出较大斜率的指数生长期;216 h附近时,细胞生长到达平顶期;240 h时,细胞出现退化、衰亡。见图2。
2.3 各组成骨细胞ALP水平对比
空白对照组、酒精组和股骨头坏死愈胶囊不同药物浓度对ALP含量的影响,见表1。由表1可知,培养第14天,股骨头坏死愈胶囊药液浓度为750 mg/L时,ALP含量最高。在培养的第7天和第14天,股骨头坏死愈胶囊药液浓度在140~750 mg/L区间时,ALP含量随着药物浓度的增加而增加;当750 mg/L浓度时,ALP含量达到高峰;药物浓度840 mg/L时,ALP含量出现下降。因此,选定股骨头坏死愈胶囊药液浓度为750 mg/L作为观察浓度。见图3和图4。750 mg/L股骨头坏死愈胶囊组、空白对照组、酒精组在培养第7天和第14天时的ALP含量对比,750 mg/L股骨头坏死愈胶囊组ALP含量高于酒精组和空白对照组,差异具有统计学意义,见表2。
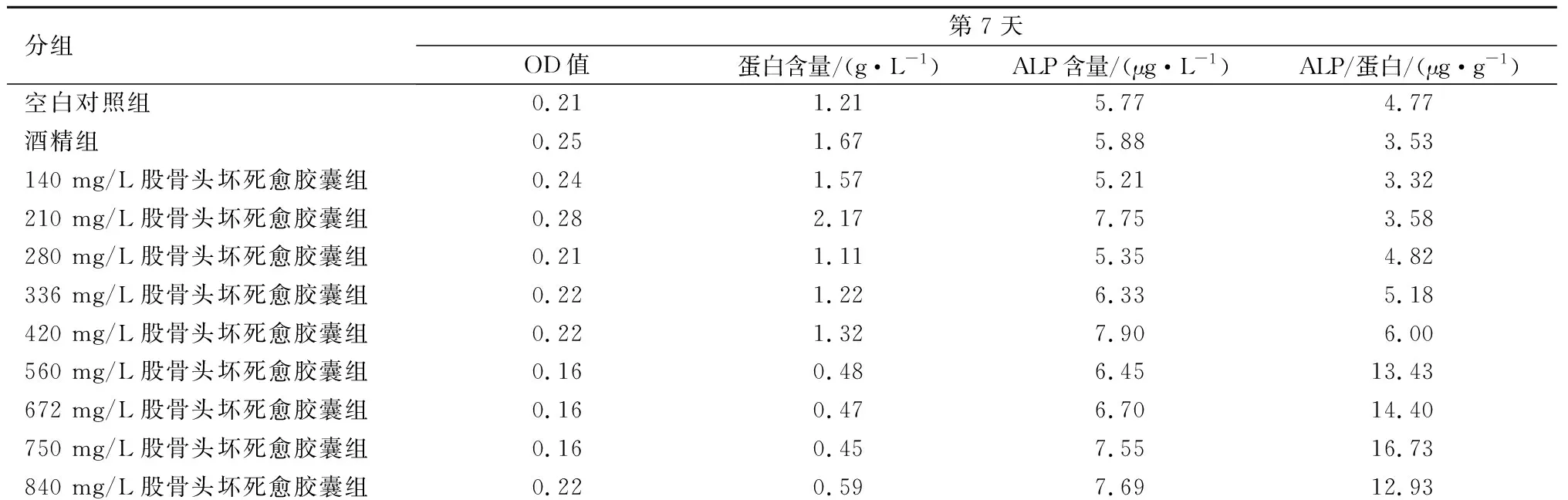
表1 各组培养第7天、第14天成骨细胞ALP含量对比

分组第14天OD值蛋白含量/(g·L-1)ALP含量/(μg·L-1)ALP/蛋白/(μg·g-1)空白对照组0.302.395.852.45酒精组0.302.795.261.89140 mg/L股骨头坏死愈胶囊组0.302.405.102.12210 mg/L股骨头坏死愈胶囊组0.272.024.482.22280 mg/L股骨头坏死愈胶囊组0.271.944.282.20336 mg/L股骨头坏死愈胶囊组0.271.955.112.62420 mg/L股骨头坏死愈胶囊组0.261.814.082.25560 mg/L股骨头坏死愈胶囊组0.200.945.575.95672 mg/L股骨头坏死愈胶囊组0.180.655.077.78750 mg/L股骨头坏死愈胶囊组0.170.606.4610.87840 mg/L股骨头坏死愈胶囊组0.170.574.207.43
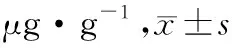
表2 3组第7,14天ALP/蛋白含量对比
3 讨 论
目前股骨头坏死的发病原因尚不明确。研究[11-12]发现:规律饮酒患者ONFH发病危险性高,而且具有明显量效关系。每周酒精摄入量<400 mL、400~1 000 mL和≥1000 mL的患者,其相对危险度分别为3.3,9.8,17.9。酒精性股骨头坏死因其致残性高越来越受到学者及临床医生的重视,治疗时主要根据其疾病分期、分型采用保守治疗、髓芯减压、骨(血管化/非血管化)移植、髋关节置换等方法[13-14],效果参差不齐。
在股骨头坏死的病理过程中,骨的坏死和修复同时存在。成骨细胞在骨代谢的整个过程有重要作用,是参与骨形成的重要功能性细胞,对骨发育和新生骨内环境稳定具有重要意义,同时参与成骨过程及破骨细胞骨吸收功能的调节[15-18]。成骨细胞有细胞生长周期。本实验通过观察成骨细胞体外生长曲线了解成骨细胞在体外的生长规律,并依此确定药物干预的观察时间窗。本实验结果显示:体外培养24~72 h成骨细胞生长较为缓慢,可视为潜伏期;96~192 h呈现出较大斜率的指数生长期;216 h附近到达平顶期;240 h出现退化衰亡。依此选定成骨细胞生长第7天(最为活跃时间)和第14天(进入退化衰亡期)作为实验关键时间点。
ALP是一种普遍存在的膜结合糖蛋白,在碱性pH值下催化磷酸单酯的水解。ALP根据组织表达部位分为4种同工酶,即肠ALP、胎盘ALP、生殖细胞ALP和组织非特异性ALP或肝/骨/肾ALP[19-22]。骨同功酶可能参与哺乳动物的骨钙化[23]。本研究将P3代成骨细胞分为股骨头坏死愈胶囊组、酒精组和空白对照组,观察不同药物梯度对ALP表达的影响,观察时间点为培养第7天和第14天。结果表明:培养第7天酒精组ALP的表达量较空白对照组ALP的表达量低,说明酒精抑制了成骨细胞ALP的表达,从而抑制骨形成。在培养第14天时,酒精组与空白对照组的ALP表达没有差异,可能是细胞生存活性整体下降所致。药物浓度与ALP具有相关性,药物浓度在140~750 mg/L区间内,ALP表达量随着药物浓度的升高而逐渐提高,但浓度在840 mg/L时 ALP表达量出现下降,说明在140~750 mg/L区间内加大药物浓度可使骨代谢更加活跃,药物浓度在750 mg/L时ALP的表达达到峰值。第7天ALP表达量高于第14天的表达量,但是两者趋势相同,说明第14天因成骨细胞进入退化衰亡导致成骨减慢。
综上所述,中药股骨头坏死愈胶囊可促进体外骨细胞ALP的表达,此可能是股骨头坏死愈胶囊治疗股骨头坏死的机制,即股骨头坏死愈胶囊促进成骨细胞ALP的表达,促进骨的生发,从而促进新骨的形成而达到治疗股骨坏死的临床效果。
