高分泌型无赖百当烟草8306突变材料的创制与分析
2022-04-20李旖梅王召军闫筱筱张洪映任书乐李雪君孙计平
李旖梅,王召军,闫筱筱,张洪映,任书乐,李雪君,孙计平,崔 红*
1.河南农业大学烟草学院,郑州市金水区文化路95号 450002 2.河南省农业科学院烟草研究所,河南省许昌市魏都区青梅路与永昌大道交叉口 461000
烟草叶片表面布满表皮毛即烟草腺毛,按有无分泌功能可分为分泌型腺毛和保护毛,烟草腺毛占总表皮毛的85%左右[1]。烟草腺毛是叶面分泌物的主要合成和分泌场所,分泌的叶面化合物主要有二萜化合物、蔗糖酯和蜡质等[2]。二萜化合物和蔗糖酯是烟草香味物质的重要前体物,且对害虫有一定的趋避作用[3],使烟草具有一定的自我防护能力。烟草腺毛是叶面化合物形成积累的基础,叶面分泌物随着烟草生长发育积累到一定程度才能对烟叶品质产生作用。烟草叶面腺毛形成受遗传、生态和栽培等因素的影响,具有不同的腺毛种类和密度,从而形成特定的香气品质和香气风格[4]。因此,烟草香气品质的提高可以通过调控烟草腺毛密度来实现。
植物腺毛的发生机制已有相关报道。拟南芥中CycB1和CycB2基因使单细胞腺毛突变为丛生的多细胞腺毛,且在腺毛中特异性表达[5]。番茄中B型细胞周期蛋白基因SlCycB2,当该基因过表达时,分泌型和非分泌型腺毛显著减少;该基因受抑制时,非分泌型腺毛显著增多,而分泌型腺毛消失[6-7]。孟盈等[8]对K326烤烟品种的NtCycB2基因进行了敲除和过表达研究,发现过表达植株叶片和茎表面光滑少毛,而敲除植株的分泌型腺毛显著增加。潘阳等[9]通过敲除K326的NtCycB2基因创制了高腺毛密度的HK326纯合材料,对腺毛密度统计发现,腺毛密度约为对照的3倍,对叶面化学成分含量(质量分数)检测发现,总含量提高近2倍。因此,NtCycB2基因对烟草分泌型腺毛的发生具有明显的负调控作用。曹宁[10]、蔡传斌[11]和吴拥军等[12]研究发现,对烟草叶片转化ChIFN-γ基因,其后代植株叶片腺毛密度显著提高,表明ChIFN-γ基因也参与调控烟草腺毛的发育,可见调控烟草分泌型腺毛的分子调控机制比较复杂。烟草分泌型腺毛的发育同样也受遗传和外界环境条件的综合影响。薛晓明等[13]和查宏波等[14]研究表明,不同烟草品种间,腺毛密度越大,腺毛分泌物含量越高。Bogdanieski等[15]试验提出,大田灌水量增加会降低烟草的腺毛密度。于卫松等[16]研究发现,烟草施加豆饼等有机肥可显著促进烟叶腺毛生长,进而提高烟草叶面分泌物含量。因此可通过调整烟草种植的外界环境和农艺措施来提高烟草的叶面腺毛密度和分泌物含量。
烟草8306是河南农业大学选育的高分泌型烤烟品系,其叶面分泌物含量显著高于K326等烤烟品种[17]。8306品系具有晾晒烟香气特点,晾晒烟香气特性受NtCPS2基因的调控,NtCPS2基因是萜类代谢途径中调控赖百当二萜合成的基因,且8306品系的杂交后代,如豫烟11号也具有一定的晾晒烟香气特点[18]。为彰显8306品系的烤烟风格,促进其在高香气烤烟育种中的应用,在前期试验基础上对8306品系的NtCPS2基因进行敲除,使纯合突变材料8306-1中赖百当化合物的生物合成受到抑制,但腺毛分泌物总量并无显著变化[19]。为进一步提高8306-1株系腺毛分泌物含量,创制高香气烤烟育种材料,对8306-1株系的NtCycB2基因进行敲除,获得了腺毛密度增加的纯合突变株系8306-2,并对8306品系进行了农艺性状、烟草腺毛、叶面化学成分和基因表达等分析,旨在创制高品质和高香气的育种材料。
1 材料与方法
1.1 试验材料
烟草8306和8306-1种子由河南农业大学国家烟草栽培生理生化研究基地实验室保存。培养条件:种子经消毒后在人工气候箱萌发成无菌苗,温度(26±2)℃,相对湿度(65±3)%,光照强度1 400 lx,进行16 h的光照和8 h的黑暗交替培养。
1.2 试验方法
1.2.1NtCycB2基因敲除载体的构建和菌株转化
采用孟盈等[8]构建的NtCycB2基因敲除载体,将获得的NtCycB2基因敲除质粒转化到根癌农杆菌EHA105中,在含有潮霉素YKR固体的培养基上均匀涂布,挑选多个单独的菌斑用于PCR抗性检测。对阳性菌液进行振荡培养,用于遗传转化侵染。
1.2.2 烟草遗传转化与分子鉴定
采用叶盘法[20]对烟草8306-1株系进行遗传转化。使用农杆菌EHA105菌液侵染叶片,在MS培养基上暗培养2d后转移到筛选培养基(MS+Cef 0.50000g/L+Hyg0.008 00g/L+6-BA 0.00100 g/L+NAA 0.00015 g/L)上,剪去3 cm左右的不定芽转移到生根培养基(MS+Hyg 0.008 00 g/L+NAA 0.000 10 g/L)中培养。使用DNA提取试剂盒[天根生化(北京)科技有限公司]提取抗性植株的DNA,使用NtCycB2特异引物序列[19]进行PCR扩增,由北京擎科生物科技有限公司郑州分公司对回收扩增产物进行序列测定。将得到的阳性植株自交获得T1代种子。采用漂浮育苗,提取烟草幼苗的DNA,使用潮霉素抗性基因筛选出无标记的单株幼苗。利用潮霉素抗性基因扩增引物(F3:5'-CGAGAGCCTGACCTATTGCAT-3',R3:
5'-CTGCTCCATACAAGCCAACCAC-3')对T1代单株进行鉴定,最终得到通过抗性筛选的阳性单株。
1.2.3 农艺性状调查
将8306和创制的两个株系在河南省农业科学院烟草研究所培育成幼苗,在适宜移栽期移栽到专门设置的基因编辑材料试验田,并由河南省农科院烟草研究所统一栽培和管理,依据烟草行业标准[21]测定并记录烟草的株高、叶数和节距等指标。
1.2.4 叶片腺毛形态学观察与密度统计
在烟草旺长期选取第5片(从上往下数)叶长15 cm左右(叶尖至叶基长度)的烟叶,选定叶片从叶尖到叶基第5脉和第6脉间的区域进行染色,参考Lin等[22]的方法对烟叶腺毛组织进行化学染色。使用体积分数为0.2%的罗丹明B溶液对叶片浸染0.5 h,用蒸馏水漂洗4~5次,吸干叶片表面水分并放置在室温下晾干,使用超景深显微镜(VHR-5000,日本基恩士公司)对叶片上表面进行观察,随机选定平整区域内10个左右的视野,对腺毛进行形态观察和拍照,并统计记录不同类型腺毛的数量。
1.2.5 叶面化学成分分析
选取移栽后60 d中部第10~13叶位(从下往上数)烟叶提取叶面分泌物。烟叶取样和前处理参考韩锦峰等[23]和李艳华等[24]的方法。使用500 mL左右的有机溶剂二氯甲烷溶液浸提烟叶,浸提后加入15 g左右的无水硫酸钠除水过滤,过滤液中加入1 mL内标(2.542 mg/mL的正十七烷醇和2.020 mg/mL的蔗糖八乙酸酯的混合溶液),然后旋转蒸发浓缩,使用氮气完全吹干残留的二氯甲烷。之后分别加入250μL的DMF和BSTFA,待瓶中固体溶解后进行水浴1 h,再加入吡啶和N,O-双乙酰胺,常温下放置,待液体完全澄清无沉淀即为待测分析液,如果不立即测定则于4℃保存,检测之前放置到室温下即可。使用气相色谱-质谱联用仪(美国Agilent公司,质谱仪型号vc-70SE,色谱仪型号HP-5890)进行叶面化合物成分检测分析,仪器条件参数设定参考王霄龙等[25]的方法,采用内标定量法(相对校正因子为1)进行定量分析。
1.2.6 荧光定量PCR检测
使用荧光定量试剂盒(南京诺唯赞生物科技股份有限公司)进行荧光定量PCR操作。PCR程序:95℃10 min;95℃10 s,60℃30 s,循环40次。反应体系为30μL:cDNA 1μL;DEPC 3.6μL;上游引物0.2μL;下游引物0.2μL;荧光染料(2×SYBR GreenⅠMaster)5μL,无菌水(H2O)补足至30μL。熔解曲线程序为60℃缓慢升温至97℃,每次采集5次荧光信号,程序结束后对比熔解曲线确定各对引物的特异性,分析确定基因之间的相对表达量,荧光定量PCR引物见表1。

表1 荧光定量引物Tab.1 Primers for fluorescence quantification
1.2.7 数据处理
采用Excel 2013进行数据分析和图表绘制;使用SPSS 21统计软件,采用新复极差法进行数据间差异的显著性检验。
2 结果与讨论
2.1 NtCycB2基因敲除和分子鉴定
对遗传转化的烟草8306-1株系叶片进行分子鉴定。在潮霉素(8 mg/L)筛选培养基上获得13株潮霉素阳性植株,对T0代阳性植株进行目的基因和抗性基因的PCR扩增和产物测序,结果见图1。图1表明,8306-1株系中存在两个NtCycB2基因拷贝,对其进行单克隆测序,在所检测的1株编号C6单克隆中检测到两种类型的突变,分别插入单碱基G和插入单碱基A,并未检测到野生型序列,说明C6中NtCycB2基因的两个拷贝已经发生纯合突变,翻译出来的氨基酸链缩短,导致翻译出来的蛋白丧失原有功能。使用潮霉素抗性基因对T1代幼苗进行筛选,得到纯合无标记基因的株系,自交繁种并命名为8306-2。

CK.8306 1.8306-1 2.8306-2;1和2黄色标注部分为突变碱基,红色标注部分为氨基酸序列差异图1 烟草8306-1株系中NtCycB2基因敲除鉴定及氨基酸序列变化Fig.1 Identification of NtCycB2 gene knockout and amino acid sequence changes of tobacco 8306-1 line
2.2 NtCycB2基因敲除对烟草农艺性状的影响
NtCycB2基因敲除株系的田间观察和农艺性状调查结果见图2。图2显示,8306品系、8306-1与8306-2株系的生长发育状况基本一致。由表2调查结果可知,8306品系和两个株系在农艺性状指标如株高、叶数和节距等均无显著差异。

表2 不同株系的农艺性状比较①Tab.2 Agronomic traits of different lines

图2 不同株系田间植株的形态比较Fig.2 Morphological comparison of tobacco plants in fields among different lines
2.3 NtCycB2基因敲除对烟草腺毛形态和腺毛密度的影响
使用超景深显微镜观察8306品系和创制的两个株系叶片的腺毛形态,结果见图3。叶面腺毛均以长柄分泌型为主,同时存在短柄分泌型和非分泌型腺毛,8306-2株系存在较多分枝型和长柄分泌型腺毛。对腺毛密度分析发现,8306品系和8306-1株系腺毛总数和不同腺毛类型数量均无显著差异,而8306-2株系的腺毛总数、长柄分泌型腺毛和短柄分泌型腺毛数量与8306品系和8306-1株系相比均存在显著差异。与8306-1株系相比,8306-2株系腺毛总数提高25.3%,长柄分泌型腺毛密度提高30.7%,短柄分泌型腺毛密度提高26.1%。可见,NtCycB2基因敲除植株的腺毛密度显著提高,且存在较多的分枝型腺毛。

图3 不同株系叶片腺毛观察和腺毛密度比较Fig.3 Appearance and density of glandular trichomes on leaves of different lines
2.4 NtCycB2基因敲除对叶面化学成分的影响
GC/MS分析结果见图4。从图4中可以看出,在化学成分种类上,8306品系和两个株系中均含有西柏烷类二萜和蔗糖酯类物质,但8306-1和8306-2两个株系中不含有赖百当二醇。在叶面化合物含量上,8306-2株系显著高于8306品系和8306-1株系,且西柏烷类成分含量提高95.7%和93.4%,蔗糖酯类成分含量提高60.8%和62.5%。说明敲除NtCycB2基因可以显著提高叶面化合物含量。
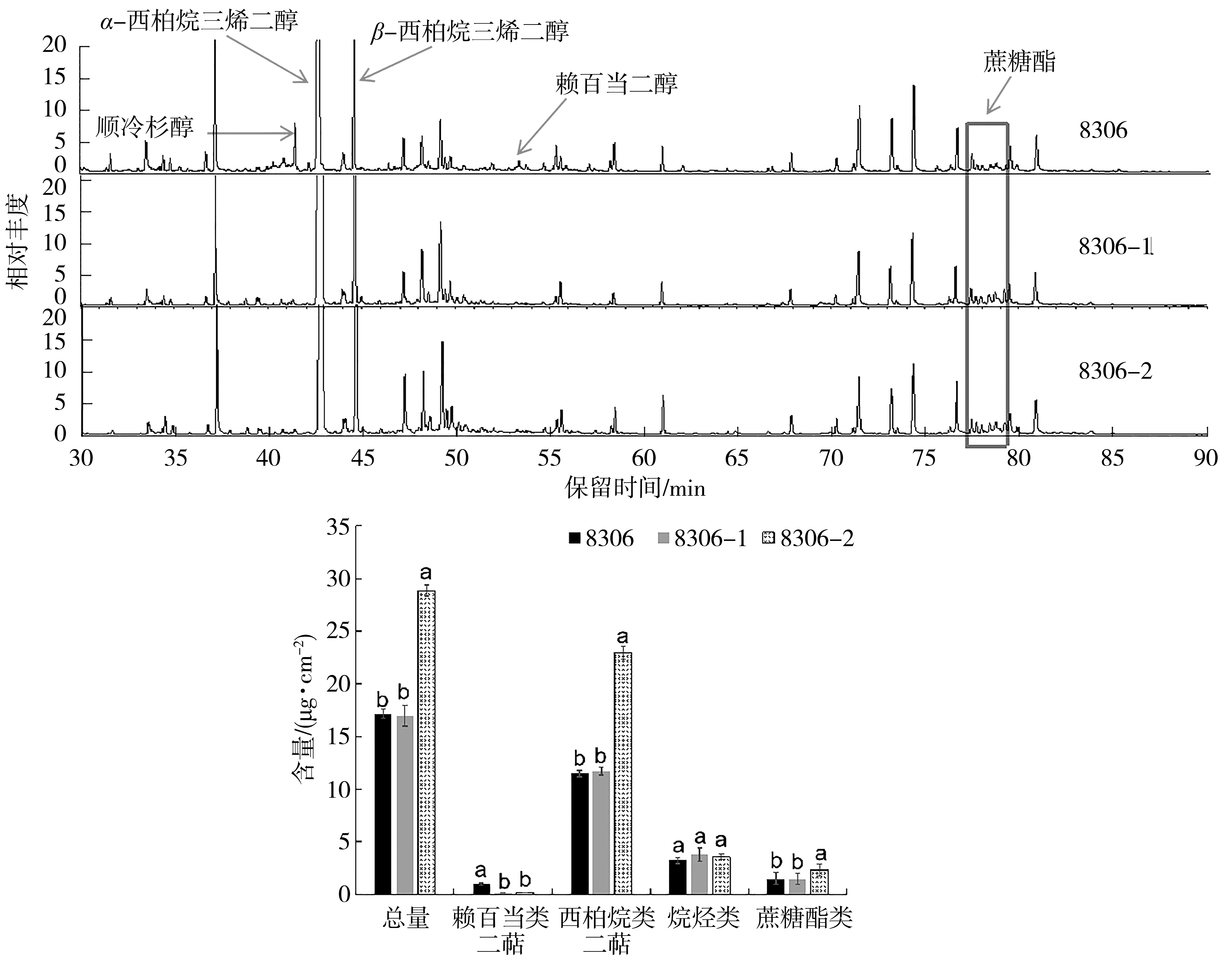
图4 不同株系的叶面化合物含量比较Fig.4 Contents of leaf surface chemical compounds of different lines
2.5 NtCycB2基因突变对烟草二萜代谢相关基因表达的影响
对移栽后60 d中部烟叶进行qRT-PCR检测,结果见图5。与8306品系和8306-1株系相比,8306-2株系二萜合成途径关键基因NtABS、NtCPS2、NtCBT和NtCYP71D16的相对表达量明显上调,其上游基因NtGPPS和NtGGPPS的相对表达量无显著变化,说明敲除NtCPS2对二萜代谢通路相关合成基因表达量无影响,而敲除NtCycB2基因在增加腺毛密度的同时二萜相关合成基因NtABS、NtCPS2、NtCBT和NtCYP71D16的相对表达量显著上调,但对其上游基因NtGPPS和NtGGPPS的相对表达量无显著影响。

图5 不同株系二萜代谢相关基因的表达量比较Fig.5 Expression quantities of genes associated with diterpene metabolism in different lines
3 结论
通过基因编辑技术获得了NtCycB2基因敲除的纯合突变株系8306-2。该株系的长柄分泌型腺毛密度显著提高,使叶面腺毛分泌物总量远远高于8306品系和8306-1株系;而其腺毛分泌物组成成分则与8306-1株系相同,且均缺少8306品系中的赖百当二萜类化合物。腺毛分泌物合成关键基因NtCBT、NtCYP71D16、NtCPS2和NtABS的表达水平在NtCycB2和NtCPS2基因共敲除的8306-2株系中明显上调,而在NtCPS2基因突变的8306-1株系中并未发生显著变化。二萜生物合成的上游基因NtGPPS和NtGGPPS的表达并不受NtCycB2和NtCPS2基因敲除的影响,说明二者功能缺失对烟草整个萜类代谢并无明显影响。8306-2和8306-1株系田间生长发育正常、农艺性状与8306品系无明显差异。可见,8306-2株系中NtCycB2和NtCPS2基因的共敲除,显著提高了腺毛密度,并改变了分泌物的代谢流向,具有叶面腺毛分泌物含量高和不含赖百当类物质的特点。
责任编辑? 董志坚
