强还原土壤灭菌对烟草种植前后土壤化学性质及微生物群落结构的影响
2022-04-20张清壮彭镜先陈前锋田明慧
滕 凯,张清壮,彭镜先,陈前锋,田明慧,巢 进,李 鑫*
1.湖南省烟草公司湘西自治州公司,湖南省湘西土家族苗族自治州吉首市人民南路118号 416000 2.湖南省农业科学院,长沙市芙蓉区远大二路892号 410128 3.湖南省蔬菜研究所,长沙市芙蓉区远大二路890号 410128
作物生产过程常伴随着过度施肥、集约灌溉和单一连作的现象,这会导致土壤品质下降,如土壤酸化、板结以及土传病害的发生等[1-2]。为了有效缓解土壤酸化和控制土传病害,曾尝试短期淹水[3]、水旱轮作[4]以及使用化学杀菌剂[5]等措施。然而,这些措施对改良土壤的效果并不显著,且耗费大量时间与费用[6-8]。而且,随着人们对食品安全和环境污染的日益关注,传统的且土壤消毒效果较好的化学杀菌剂也已逐渐被限制使用[9]。因此,寻找一种能够同时控制土传病害和克服土壤连作障碍的农业生产管理措施势在必行[10]。对此,荷兰和日本的学者提出了土壤强还原灭菌(Reductive soil disinfestation,RSD)的生物学方法,在土壤-植物-微生物的关系中创造有利于作物生长而不利于病原微生物繁殖的土壤环境条件,达到减少化学药剂使用和解决土壤连作问题的目的[11-13]。
与传统的物理化学方法相比,RSD技术具有环境友好、成本低廉等优点。RSD处理是通过改变NH4+-N和NO3--N的相对比例来调节土壤pH,减轻土壤酸化问题[14]。此外,RSD处理能增加土壤中的总碳和总氮含量(质量分数),并将添加的有机质通过微生物分解为有机酸和小分子物质而提高土壤肥力,减少养分流失,缓解连作障碍[15-16]。在控制土传病害方面,目前已有许多研究证实RSD处理能有效防治多种植物土传病害,如由立枯丝核菌(Rhizoctonia solani)引起的植物立枯病,青枯雷尔氏菌(Ralstonia solanacearum)引起的青枯病,疫霉属(Phytophthora)真菌引起的植物晚疫病等[13]。其中,青枯雷尔氏菌(Ralstonia solanacearum)引起的细菌性青枯病是一种在世界范围内发生广泛的植物病害。近年来,烟草青枯病在我国主要产烟区的发病率呈明显增长趋势,成为烟草生产上重要的土传病害,严重威胁烟草产业的安全和可持续发展[17]。目前关于植烟前后RSD处理土壤化学性质及微生物群落的变化尚鲜见报道。为此,采用RSD技术,以豆渣为有机物料,研究植烟前后RSD处理土壤化学性质及微生物群落结构及多样性的变化,并对烟草农艺性状和青枯病发病率进行调查,旨在为构建健康和谐的烟田生态系统以及RSD技术的推广应用提供参考。
1 材料与方法
1.1 供试材料
试验地位于湘西土家族苗族自治州凤凰县烟区千工坪镇(28°02'N,109°50'E),烟草连作多年且病害发生较严重。田间采用豆渣物料,总碳411.09 g/kg,全氮16.07 g/kg,物料被施入土壤前,已经过干燥、粉碎并过270μm孔径的筛子。供试烤烟品种为当地主栽品种云烟87。
1.2 试验设计
采用田间试验,设置3个处理:CK1处理(原始土壤,不进行任何处理);CK2处理(覆膜并饱和水分处理);RSD处理(添加豆渣、覆膜并饱和水分处理)。每个处理3次重复,共9个小区,每个小区面积50 m2,各处理用田垄隔断,总面积共450 m2。厌氧处理时间为冬闲时间段(2019年11月8日实施至2020年3月18日)。处理完成后,揭膜晾晒至无明显水分时,在每小区中采用梅花布点法(7点)采集表层土壤样品(0~20 cm),并将每小区样品混合均匀作为1份土壤样本。土壤取样完成后种植烟草,其栽培管理和施肥措施均按当地优质烟叶生产技术规范实施。烟叶成熟后,同样采用梅花布点法(7点)采集烟株根系附近的表层土壤样品,并将每小区样品混合均匀作为1份土壤样本。每份样本均匀分成两份,一份用于土壤化学性质指标的测定,另一份用于土壤微生物群落结构的分析。RSD处理结束时采集的土壤样品分别标记为CK1、CK2和RSD。烟叶成熟后采集烟株根系周围的土样样本,分别标记为CK1-C、CK2-C和RSD-C。
1.3 土壤化学性质指标的测定
按照文献[18]描述的方法测定土壤pH、全氮、有效磷、速效钾、有机质、NH4+-N和NO-3-N含量(质量分数)等理化性质指标:采用pH计测定土壤pH[18];凯式定氮法测土壤全氮[18];用0.5 mol/L NaHCO3溶液浸提后,采用钼锑抗比色测定土壤有效磷[18];用1 mol/L NH4OAc溶液浸提后,采用火焰分光光度法测定土壤速效钾,采用重铬酸钾滴定法测定土壤有机质[18];用2 mol/L KCl浸提并采用靛酚蓝比色法测定土样中NH4+-N含量,用饱和CaSO4·2H2O提取,酚二磺酸比色法测定土样中NO3--N含量[18]。
1.4 土壤DNA提取与群落检测
使用土壤DNA提取试剂盒E.Z.N.A.®soil DNA kit(广州飞扬生物工程有限公司)进行土壤微生物总DNA的提取。选择16S rRNA基因高变区序列进行细菌群落测序,测序引物为338F(5'-ACTCC TACGGGAGGCAGCA-3')/806R(5'-GGACTACHV GGGTWTCTAAT-3'),测序区域为V3~V4区;真菌选择ITS 1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')/ITS 2R(5'-GCTGCGTTCTTCATCGATGC-3')作为基因引物进行真菌群落测序,测序区域为ITS1区。然后进行PCR扩增,合并引物接头,使用琼脂糖电泳对PCR产物进行纯化、定量和均一化并合成测序文库。对建好的文库进行质检,并在Illumina MiSeq 2500平台完成高通量测序[19]。
1.5 微生物多样性分析
使用Fastp 0.19.6软件进行微生物序列质量控制后,以97%序列相似性将剩余序列聚类到OTU中。再使用Qiime软件将序列与Silva和Unite数据库比对,并在各分类水平分析样本的群落物种组成。采用Mothur 1.30.2软件计算群落多样性指数香农指数(Shannon)和群落丰富度指数Ace和Chao1。基于OTU丰度表计算微生物群落丰度组成,并用Origin 8.5软件绘图。采用Canoco 5软件完成主坐标分析(PCoA)、主成分分析(PCA)和冗余分析(RDA)并绘图。
1.6 烟株农艺性状调查
在各处理中选择具有代表性的5~10株烟株进行挂牌标记,按YC/T 142—2010[20]标准方法,定点定株在烟株旺长期测定烟株的农艺性状指标,包括烟株的株高、茎围、有效叶片数和最大叶面积。
1.7 病害调查
按GB/T 23222—2008[21]标准方法调查烟株青枯病发病情况,病害调查与烤烟农艺性状指标测定同步进行。从烟株发病初期开始调查,每隔6 d调查1次,连续调查8次。
计算公式:
1.8 数据处理
使用Excel 2019软件计算平均值与标准差,用SPSS 19.0软件采用Duncan’s新复极差法进行处理间的差异显著性检验。分别采用Excel及Origin 8.5软件制表和绘图。
2 结果与分析
2.1 不同处理对土壤pH与养分含量的影响
表1显示:与CK1和CK2相比,RSD处理能显著提高土壤pH,植烟后各处理土壤pH较植烟前变化不显著。植烟前RSD处理的土壤NO3--N含量较CK1显著降低,而土壤NH4+-N含量则增加,其中NO3--N含量RSD处理较CK1减少66.00%,NH4+-N含量RSD处理较CK1增加22.71%。此外,RSD处理土壤有效磷含量也显著增加。植烟后RSD-C处理的有效磷、速效钾和NH4+-N含量较CK1-C和CK2-C均有显著提高,分别比CK1-C提高204.35%、37.57%和65.68%,分别比CK2-C提高70.40%、36.70%和34.60%。

表1 不同处理土壤p H和主要养分含量变化①Tab.1 Changes of soil pH and major nutrient contents under different treatments
2.2 不同处理对土壤微生物群落的丰富度和多样性的影响
从18个土壤样品中,分别得到885 485和1 026 323条细菌和真菌有效序列,总长度分别为370 370 081 bp和237 294 043 bp,片段平均长度分别为418 bp和231 bp。根据97%的相似度阈值对微生物群落进行聚类与物种注释,共得到6 692个细菌OTUs和1 556个真菌OTUs。其中,细菌归属于44门,140纲,332目,516科,947属和2 076种;真菌归属于14门,45纲,107目,221科,387属和614种。
基于OTUs对微生物多样性指数香农指数和丰富度指数Ace、Chao1指数进行估算。结果(表2)显示,除RSD-C处理真菌群落Chao1显著低于CK1外,其余土壤微生物群落丰富度指数无显著差异。植烟前RSD处理土壤的细菌和真菌香农多样性指数均显著低于CK1,而植烟后RSD-C处理土壤的真菌香农多样性指数则显著降低。

表2 微生物群落多样性和丰富度指数①Tab.2 Diversity and richness indexes of microbial communities
2.3 不同处理对土壤微生物群落结构的影响
2.3.1 细菌群落组成
不同处理细菌群落在门和属水平的相对丰度如图1所示。各处理中丰度大于1%的细菌门为变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、酸杆菌门(Acidobacteriota)、绿弯菌门(Chloroflexi)、厚壁菌门(Firmicutes)、芽单胞菌门(Gemmatimonadota)、Myxococcota、嗜甲基菌门(Methylomirabilota)、拟杆菌门(Bacteroidota)、Latescibacterota、硝化螺旋菌门(Nitrospirota)(图1A),表明植烟前后RSD处理土壤细菌门结构组成没有改变,但优势种群比例发生明显变化。在门水平上(图1A),RSD处理土壤中的变形菌门(Proteobacteria)、酸杆菌门(Acidobacteriota)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)的相对丰度与对照(CK1、CK2)相比存在显著差异。其中,RSD处理土壤中酸杆菌门(Acidobacteriota)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidota)的相对丰度显著高于CK1和CK2,而变形菌门(Proteobacteria)的相对丰度却显著低于CK1和CK2。在属水平上(图1B),植烟前RSD处理土壤中Flavisolibacter属、芽胞杆菌属(Bacillus)及粪球菌属(Coprococcus)的相对丰度显著高于CK1和CK2,而雷尔氏菌属(Ralstonia)显著降低。植烟后RSD-C土壤中Flavisolibacter、雷尔氏菌属(Ralstonia)的相对丰度较CK1-C和CK2-C显著减少,而芽胞杆菌属(Bacillus)、粪球菌属(Coprococcus)显著增加。

图1 细菌门(A)和优势菌属(B)的相对丰度比较Fig.1 Relative abundances of bacterial phyla(A)and dominant genera(B)
2.3.2 真菌群落组成
不同处理真菌群落在门和属水平的相对丰度如图2所示。各处理主要真菌门包括子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和被孢霉门(Mortierellomycota)(图2A)。在属水平上(图2B),RSD处理柄孢壳菌属(Podospora)及被孢霉属(Mortierella)的相对丰度显著增加,镰刀菌属(Fusarium)、丝核菌属(Rhizoctonia)和原隐球菌属(Saitozyma)的相对丰度显著降低。植烟后RSD-C处理柄孢壳菌属(Podospora)、毛壳菌属(Chaetomium)和被孢霉属(Mortierella)的相对丰度显著增加,而镰刀菌属(Fusarium)及原隐球菌属(Saitozyma)的相对丰度则显著降低(图2B)。
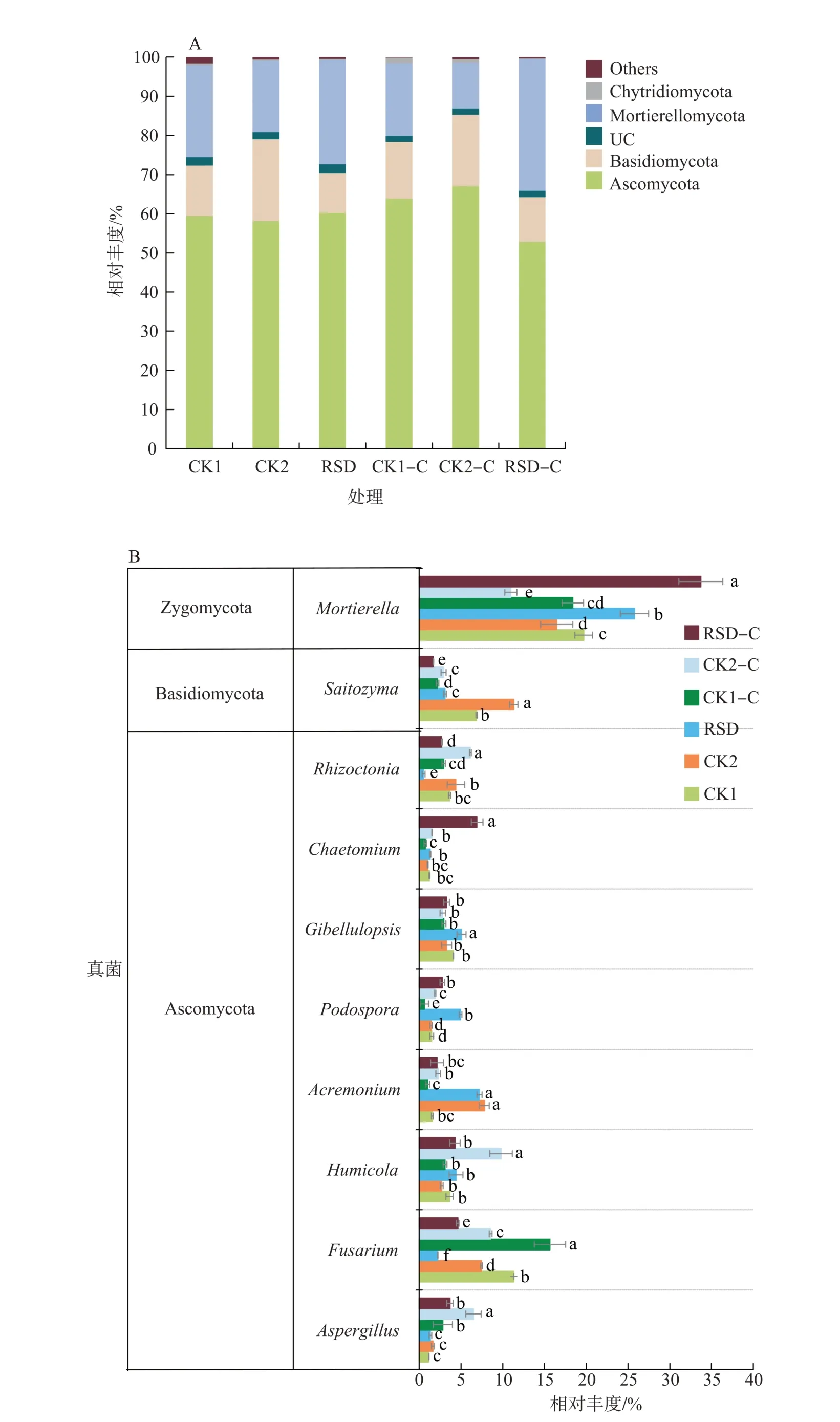
图2 真菌门(A)和优势菌属(B)的相对丰度Fig.2 Relative abundances of fungal phyla(A)and dominant genera(B)
2.4 土壤微生物群落与土壤环境因子之间的关系
对环境因子与主要菌门进行PCoA、PCA和RDA分析,结果见图3。由图3a和3b可知,CK1和CK2的群落结构分别在细菌群落和真菌群落中表现相似,而RSD处理土壤菌群较CK1和CK2变化显著。植烟后土壤处于好氧条件下,土壤中NH4+-N、有机质、速效钾和有效磷含量显著影响微生物的群落结构(图3c和3d)。土壤环境因子与微生物优势菌门的RDA结果分析表明,微生物群落结构变化与环境因子间存在一定的相关性。细菌RDA分析(图3e)发 现,土 壤NH4+-N与嗜甲基菌门(Methylomirabilota)、酸杆菌门(Acidobacteriota)的变化呈正相关,土壤有机质、速效钾、有效磷与放线菌门(Actinobacteriota)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和绿弯菌门(Chloroflexi)的变化呈正相关。真菌RDA分析(图3f)发现,被孢霉门(Mortierellomycota)、子囊菌门(Ascomycota)和担子菌门(Basidiomycota)分别受土壤NH4+-N、全氮和有机质含量的影响较大。

2.5 不同处理对烟草农艺性状和发病率的影响
不同处理烟草农艺性状和发病率如表3所示。RSD处理土壤烟株株高、有效叶片数和最大叶面积均显著高于CK1和CK2,分别较CK1增加3.6%、9.4%和9.3%,分别较CK2增加2.9%、8.0%和1.2%。RSD处理烟株发病率均显著低于CK1和CK2,分别较CK1、CK2降低59.0%、49.6%。

表3 不同处理烟草农艺性状和发病率比较①Tab.3 Agronomic traits and incidence rate of tobacco under different treatments
3 讨论
长期连作会导致土壤养分含量减少以及土传病原菌的发生,而对土壤进行单一淹水的物理消毒法所创造的厌氧环境下的微生物代谢活动较弱,不能有效改良土壤品质和抑制土传病害[22]。研究表明,通过在厌氧环境中添加适量有机物料,不仅能够在短时间内改善酸化土壤,而且还增加土壤养分含量[23]。本研究中RSD处理创造的强还原环境能使土壤pH显著增加,表明RSD处理可缓解土壤酸化,与前人研究结果基本一致[24]。RSD处理土壤NH4+-N含量显著增加,NO3--N含量显著降低。其中,土壤NH4+-N含量的增加可归因于RSD处理中有机物料的矿化导致NH4+-N的产生[24],土壤中NO3--N含量降低则归因于RSD处理创造的强还原土壤环境,促进NO3-的还原进而导致NO3--N含量降低[15,25]。RSD处理还可显著提高土壤中有效磷含量,这可能是因为在RSD处理的土壤厌氧环境下,添加的有机物料被厌氧微生物分解,促进了有机磷向无机磷的转化,从而增加土壤中磷的有效性[26-27],这与刘亚男等[23]的研究结果相似。本研究中RSD处理的植烟土壤中的有效磷、速效钾和NH4+-N含量较未处理和仅淹水覆膜处理土壤有所增加,同时,烟草的农艺性状也得到了改善,其原因可能是土壤恢复好氧环境,经过RSD处理已经改变的土壤微生物群落对土壤中有机质的分解能力及养分活化能力增强[24,28],从而增加土壤养分含量并改善烟草的农艺性状,这与Huang等[28]在黄瓜上的研究结果一致。
本研究中PCoA分析结果表明,RSD处理后土壤微生物群落发生显著变化,这一方面归因于RSD处理在较短的时间内创造的强还原、厌氧和高温等土壤环境[29],另一方面是由于添加外源的有机物料所致。根据土壤环境因子与微生物群落之间的关联分析(PCA、RDA)结果,RSD处理后土壤中养分含量发生变化也促进土壤微生物群落的改变。此外,RSD处理创造的特殊的强还原土壤环境还可杀灭土壤中一些病原微生物,这主要归因于RSD处理土壤产生的一些有机酸和挥发性气体等物质,他们对于病原微生物有显著抑制作用[29]。在本研究中,雷尔氏菌属(Ralstonia)的相对丰度及烟草青枯病发病率在RSD处理后显著降低,这表明RSD处理有效抑制了雷尔氏菌属(Ralstonia)的生长,这与Mowlick等[30]和刘亚男等[23]的研究结果相似。同时,RSD-C处理创造的厌氧土壤环境使烟株青枯病的发病率显著低于未处理土壤以及仅淹水覆膜的土壤,这再次证明了RSD处理对土壤青枯病的显著灭菌效果。
RSD处理后细菌的优势菌属包括芽胞杆菌属(Bacillus)、粪球菌属(Coprococcus)和Flavisolibacter。已有研究证实了芽胞杆菌属(Bacillus)在作物生长过程中具有拮抗病原真菌的作用[31],且芽胞杆菌属(Bacillus)作为一种可还原Fe3+和Mn4+的细菌,其代谢物(H2S、NH3、Fe2+和Mn2+)也具有杀灭病原体的效果[28,32]。同时,这些代谢物在土壤恢复有氧状态时,H2S和NH3将被分解和硝化,而Fe2+和Mn2+将被转化,因此不会对植物产生毒害作用[28,32]。粪球菌属(Coprococcus)是有机酸的生产者,如乙酸、丁酸和丙酸[33],这些酸类物质的产生也是RSD处理期间发挥消灭病原菌作用的关键因素[34]。此外,有研究表明Flavisolibacter在利用易分解有机碳源时能够释放多种功能酶,如葡β-萄糖苷酶(β-glucosidase)和N-乙酰-β-氨基葡萄糖苷酶(N-acetyl-β-glucosaminidase),能够辅助有机质的降解[35-36]。
此外,RSD处理显著影响了真菌群落结构,其中柄孢壳菌属(Podospora)及被孢霉属(Mortierella)的相对丰度显著增加。柄孢壳菌属(Podospora)是健康土壤中含量最高的真菌属之一[37],可抑制植物黄萎病的发生[38]。被孢霉属(Mortierella)对土壤养分转化和有效性具有重要贡献。例如,被孢霉属(Mortierella)具有通过释放多种有机酸来溶解土壤磷的潜力[39],在果园土壤中添加被孢霉(Mortierellasp.)可显著增加有效磷、钾、钙、镁和硼含量[40]。这表明RSD处理能促进有益微生物群落的构建,降低土壤中的病原菌数量,增加土壤肥力从而为作物生长创造良好的土壤生态环境。
土壤灭菌处理完成后,随着烟草的种植土壤微生物群落再次发生显著变化,一是因为好氧环境的恢复以及高温环境的消除[13];二是因为在植物的生长过程中,植物根系释放的分泌物具有一定能力驱动及选择特定的微生物[14,41]。在本研究中,植烟后RSD-C处理中毛壳菌属(Chaetomium)相对丰度显著增加。毛壳菌属(Chaetomium)作为一种需氧微生物,对许多植物病原菌具有潜在的生物防治作用,可作为土传和种传病原菌的拮抗物[42-43],在生命活动过程中产生抗真菌化合物(如四氢呋喃)[44],还可以通过重寄生作用、胞外酶溶菌作用、次生代谢产物的抑菌作用、诱发植物的保卫反应等方式杀死病原菌[45-46]。本研究中还发现,RSD技术的关键在于有机物料与厌氧环境同时存在才能起到良好的灭菌效果,降低青枯病的发病率,同时改善烟草的农艺性状。单纯的淹水覆膜处理(CK2)创造的厌氧环境并不能起到改良土壤的效果,这与朱同彬等[24]的研究结果相似。
4 结论
①应用RSD技术可显著影响植烟土壤pH及养分含量,即RSD处理可增加土壤NH4+-N及有效磷养分含量,提高土壤pH。②RSD技术可显著影响植烟土壤的微生物群落结构组成,RSD处理后的土壤中Flavisolibacter、芽胞杆菌属(Bacillus)、粪球菌属(Coprococcus)、柄孢壳菌属(Podospora)和被孢霉属(Mortierella)等功能微生物菌属的相对丰度显著提高,而青枯病致病菌属如雷尔氏菌属(Ralstonia)的相对丰度显著降低。植烟后土壤中有益微生物群落丰度仍然维持较高水平。③RSD处理植烟土壤可通过改善土壤理化性质及土壤微生物群落结构来改善烟株农艺性状从而降低烟株青枯病的发病率。
