杀菌/中和内毒素的双功能杂合抗菌肽LLH 的设计及特性研究
2022-04-20王瑞琪刘辰鹏姚宏纪熊婧妍李国玉
王瑞琪,刘辰鹏,姚宏纪,熊婧妍,李国玉,张 勇
(1. 海南医学院基础医学与生命科学学院,海南 海口, 571199;2. 哈尔滨商业大学药物工程技术研究中心,黑龙江 哈尔滨
150076)
随着抗生素耐药问题日趋严峻,细菌感染对人类健康的威胁越来越大。开发新型抗菌药物对于缓解抗生素耐药问题及临床细菌感染治疗压力迫在眉睫,尤其针对革兰氏阴性细菌[1]。革兰氏阴性细菌治疗过程中除了抑制或杀灭细菌外,临床上还面临着细菌杀灭过程中释放的内毒素引起的炎症因子风暴等问题[2],如败血症的治疗[3]。设计新型具有杀菌和中和内毒素双重功能的药物是解决革兰氏阴性细菌感染治疗过程面临的内毒素问题的有效途径之一。
LBP(86-99)(RVQGRWKVRASFFK)为LPS(内毒素)结合蛋白,能够与血清中内毒素结合,发挥中和内毒素的作用,但其对革兰氏阴性细菌的抗菌活性较弱[4]。HLF(1-11)(GRRRRSVQWCA)为人源的乳铁蛋白多肽,无毒性,稳定性好,抗菌谱广,但无内毒素中和效果[5]。本研究通过GGGS 的4 肽Linker 实现LBP(86-99)与HLF(1-11)多肽的杂合,得到具有高抗菌活性和高效内毒素中和作用的新型杂合抗菌LLH,为新型抗革兰氏阴性细菌的抗菌药物的设计与开发提供新思路和参考。
1 材料与方法
1.1 材料
1.1.1 菌 种 大 肠 杆 菌Escherichia coli(E. coli)ATCC 25922,E. coliATCC DH5α 由 本 实 验 室保存。
1.1.2 主要试剂及仪器 酵母浸粉,胰蛋白胨,琼脂,NaCl 等试剂购自于北京索莱宝科技有限公司;显色基质鲎试剂盒购自于北京索莱宝科技有限公司;主要仪器有海尔生物安全柜(HR900-IIA2);细菌恒温培养箱(INNOVA44R),多功能酶标仪(Syn‑ergyHTX),离心机等。
1.2 方法
1.2.1 双功能杂合肽的设计和合成 LBP(86-99)(RVQGRWKVRASFFK)为具有中和内毒素功能的多肽,但抗菌活性较弱;HLF(1-11)(GRRRRS‑VQWCA)为人源的乳铁蛋白多肽,具有一定的广谱抗菌活性,抗菌活性较弱,不具有中和内毒素功能。通过GGGS 4 肽Linker 进行偶联设计出新型的杂合肽LLH,见表1。各多肽均由生工生物工程(上海)股份有限公司采用固相合成法合成,纯度>98%。采用EMBOSS 和ExPASy 生物信息学相关软件对各多肽进行理化结构参数、二级结构、疏水性进行预测分析。
1.2.2 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)测定 最小抑菌浓度测定方法参考前期研究[6],具体如下:合成后多肽和阳性药氨苄青霉素(Amp)用无菌LB 液体培养基配制成浓度为256 μmol/L 的母液,并进行2 倍比稀释。取50 μL 系列不同浓度的多肽溶液和Amp 溶液加入无菌96 孔细胞培养板中,每个浓度3 个平行,以无菌LB 液体培养基为阴性对照,制备MIC 板。E. coliATCC 25922 和E. coliATCC DH5α 采 用LB 液 体 培 养 基培养,37 ℃振荡培养至OD600nm为0.4,将大肠杆菌菌液制备成浓度为0.5 麦氏比浊标准的菌悬液,用预热(37 ℃)无菌LB 液体培养基1 000 倍稀释,向每个制备好的MIC 板样品孔中加50 μL 菌悬液(初始菌浓度约为1.0×105cfu/mL),37 ℃恒温孵育16~18 h,观察并记录MIC 结果。并对各处理孔的菌液进行10 倍梯度稀释后,每个梯度稀释液取50 μL 涂布于LB 固体培养基,3 个重复,37 ℃恒温孵育16~24 h,直至长出菌落,进行菌落计数。以多肽处理孔中菌落数低于初始接种量的99.9%的培养孔所对应的最低浓度为MBC。
1.2.3 杀菌动力学曲线测定 同1.2.2 制备E. coliATCC 25922 和ATCC DH5α 的1.0×105cfu/mL 浓度的菌悬液。取50 μL 菌悬液至每个96 孔板的培养孔中,并分别加入终浓度为1×,2×,4×MIC 的LLH 杂合肽溶液,37 ℃培养箱孵育。同时,加入相同体积的LB 培养基和2×MIC 终浓度的Amp 作为空白对照和阳性对照处理。分别在0、1、2、4、6、12 h时间点取样涂布LB 固体培养基,37 ℃倒置培养18~24 h,统计单菌落数,绘制时间-杀菌曲线。
1.2.4 内毒素中和实验 样品制备:如1.2.2 制备E.coliATCC 25922 菌悬液,终浓度为1.0×105cfu/mL(三角瓶250 ℃干烤2 h 去除热原,其它耗材均采购无热原耗材)。向96 孔细胞培养板中加入90 μL菌悬液,并加入10 μL 一定浓度的LLH 杂合肽,使终浓度为4×MIC,加入无热原等体积生理盐水和2×MIC Amp 为对照处理。以不接种细菌和药物,加入等体积无热原生理盐水组为空白对照组。每组6 个复孔,37 ℃静置孵育处理2 h。
细菌内毒素检测:每个处理组选择3 个平行复孔,收集菌液上清,用于内毒素水平测定。其检测原理如下:鲎试剂为鲎科动物东方鲎的血液变形细胞溶解物的冷冻干燥品,细菌内毒素能够激活鲎试剂中的C 因子,激活凝固酶原形成凝固酶,进而分解显色基质产生黄色的对硝基苯胺(pNA),pNA 与偶氮化试剂偶联形成pNA 偶氮化物(λ=545 nm)。在一定时间内,pNA 偶氮化物的生成量与细菌内毒素浓度成正相关。具体测定方法和操作步骤参考显色基质鲎试剂盒(T7571,索莱宝)。
细菌数量检测:每个处理组选择3 个平行复孔,用于菌落平板计数,检测培养液中活菌数量,评价LLH 的抗菌活性。
1.2.5 溶血性测定 LLH 杂合肽细胞毒性实验通过多肽对兔红细胞溶血性进行测定,参考方法如下。将LLH 杂合肽溶解于无菌生理盐水中,配置成浓度为230 μmol/L(800 µg/mL)的母液,2 倍倍比稀释至浓度为0.1 µg/mL。通过兔耳缘静脉采集5 mL 血液,4 ℃,1 500 r/min,离心5 min,去血清,收集红细胞,无菌生理盐水洗涤红细胞3 次,至上清无色透明。制备8%红细胞悬浮液,取100 µL 红细胞悬浮液和LLH 杂合肽系类浓度溶液加入96 孔板,37 ℃孵育处理1 h,1 500 r/min 离心5 min,吸取上清至ELISA 酶标板检测540 nm 下紫外吸光值。无菌生理盐水和0.1% Triton X-100 分别为0%和100%溶血对照实验。溶血程度计算公式如下:
溶血度(%)=[(Abs540nm杂合肽LLH-Abs540nm生理盐水)/(Abs540nm0.1% Triton X-100-Abs540nm生理盐水)]×100%
1.3 统计学处理
本研究相关数据采用Graphpad Prism 5.0 进行数据的统计分析和制图,不同处理组间两两比较采用t检验,多组间比较采用Two-way ANOVA 检验,P<0.05 为差异显著。
2 结果
2.1 多肽设计 -
以HLF 和LBP 为 母 体 肽,通 过GGGS 4 肽Linker 实现LBP 与HLF 多肽杂合,设计获得LBPLinker-HLF(LLH)杂合肽。相关多肽的分子量、电荷数、等电点,两亲性和疏水性参数见表1。相对于母体肽HLF,杂合肽LLH 所携带电荷数增加至+9,两亲性指数增加至45.33,另外,疏水参数GRA‑VY 值降低。

表1 多肽序列及理化参数Tab 1 Polypeptide sequence and physicochemical parameters
2.2 LLH 杂合肽二级结构特征
通过EMBOSS/garnier 软件GOR 法对LLH 二级结构进行预测,结果表明,LLH 主要呈现β-折叠和β-转角结构,见图1A;通过EMBOSS/Pepwin‑dowall 分析序列疏水性情况,结果表明,LLH 的10aa-20aa 肽段呈现较强的疏水性,两端呈现亲水特征,见图1B。
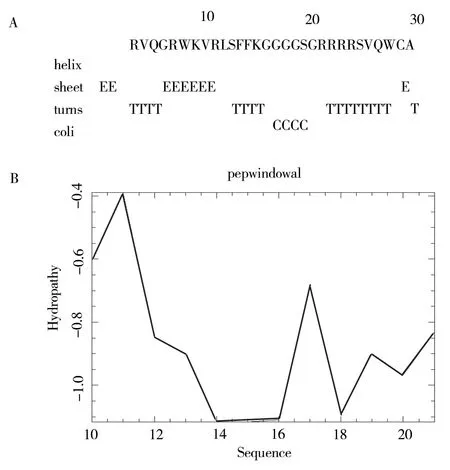
图1 LLH 二级结构预测和疏水性预测Fig 1 Prediction of LLH secondary structure and hydro⁃phobicity
2.3 LLH 的抗菌作用
选 择2 株E. coli菌 株(ATCC 25922,ATCC DH5α)对LBP(86-99)和HFL(1-11)抗大肠杆菌活性进行评估,结果如表2 所示,LBP(86-99)和HFL(1-11)均表现一定的抗大肠杆菌活性,其对ATCC 25922 的MIC 分别为16 µmol/L 和64 µmol/L,而只有LBP(86-99)对ATCC DH5α 表现出一定的抗菌活 性,MIC 为8 µmol/L。 杂 合 抗 菌 肽LLH 对ATCC 25922 和ATCC DH5α 的MIC 分 别 为4µmol/L 和4 µmol/L,相对于母体肽,抗菌活性明显增强。进一步对MBC 进行测定,LLH 杂合肽抗大肠杆菌的MBC 值均是MIC 值的1~2 倍,LLH 杂合肽具有较强的杀菌作用。与传统抗生素Amp 相比,综合MIC 和MBC 测定结果,杂合肽LLH 活性优于Amp,见表2。

表2 杂合肽LLH 的MIC 和MBC (μmol/L)Tab 2 MIC and MBC of heterozygous peptide LLH (μmol/L)
2.4 LLH 的杀菌动力特征
通过体外杀菌-时间曲线探究LLH 杂合肽在不同浓度和时间下的杀菌能力进行检测,选择大肠杆菌ATCC 25922 和ATCC DH5α 作为代表菌株。经活菌计数检测E. coliATCC 25922 和E. coliATCC DH5α 初 始接种量 为(4.54±0.09)log10cfu/mL 和(4.91±0.11)log10cfu/mL,未经LLH 干预处理的,37oC 孵育12 h 后,E. coliATCC 25922 和E. co‑liATCC DH5α 分 别 增 加 至(8.27±0.10)log10cfu/mL 和(8.41±0.09)log10cfu/mL。 经1×MIC,2×MIC、4×MIC 的LLH 处 理1 h 后,E. coliATCC 25922 菌落数分别减少了1.1、1.5、2.2 log10cfu/mL,而E. coliATCC DH5α 菌落数分别减少了0.6、1.4、1.9 log10cfu/mL,由此表明,1 h 处理后,90%以上的E. coli均被杀死。处理12 h 后,E. coliATCC 25922 菌落数分别减少了3.2、3.5、3.5 log10cfu/mL,见图2A,而E. coliATCC DH5α 菌落数分别减少了3.5、3.9、3.9 log10cfu/mL。相对于未经LLH 处理组的LB medium 组,4×MIC 的LLH 组菌落数下降了7.2 log10cfu/mL。由此可见,LLH 对E. coli表现出较强的杀菌活性,且持续12 h 未见反弹,见图2。

图2 LLH 杂合肽杀菌动力学曲线Fig 2 Bactericidal kinetic curve of LLH heterozygous peptide
2.5 LLH 杂合肽中和内毒作用
选择E.coliATCC 25922 作为受试菌,进一步研究LLH 杂合肽杀菌过程对内毒素释放的影响。4×MIC 的LLH 杂合肽处理2 h 后,E. coliATCC 25922 数 量 显 著 下 降3.5 log10cfu/mL,2×MIC 的Amp 菌落数下降2.59 log10cfu/mL,提示4×MIC LLH 杂合肽和2×MIC Amp 均表现出了一定的杀菌作用。
相同处理条件,笔者通过对细菌培养液上清中内毒素水平进行测定,结果表明,4×MIC LLH 杂合肽处理组相对于正常组,内毒素检测水平显著降低,而2×MIC Amp 处理组内毒素水平显著高于4×MIC LLH 杂合肽处理组。与正常组相比,2×MIC Amp 处理组的内毒水平也显著升高,见图3。
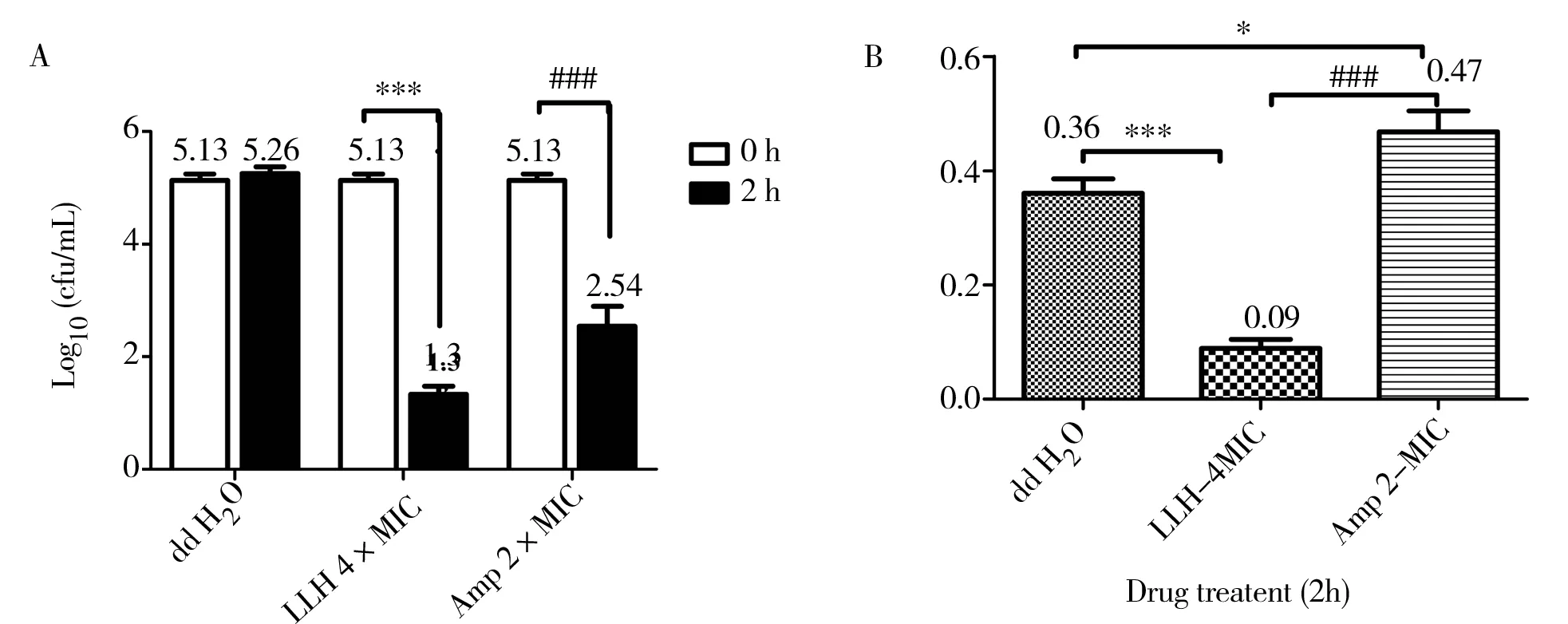
图3 LLH 杂合肽对内毒素的中和作用Fig 3 Neutralization effect of LLH hybrid peptide on endotoxin
2.6 LLH 杂合肽的溶血性
笔者进一步探究了LLH 杂合肽对哺乳动物红细胞的破坏而引起的溶血性情况。结果如图,0~115 μmol/L(400 µg/mL)的不同浓度LLH 杂合肽溶血性程度都低于1%,低于200 µg/mL 浓度时,溶血性低于0.1%,见图4。因此,LLH 杂合肽对哺乳动物红细胞不具有毒性,可应用于哺乳动物体内杀菌,具有潜在临床应用价值。

图4 LLH 的溶血性Fig 4 Hemolysis of LLH
3 讨论
抗生素耐药问题一直以来都是临床抗感染治疗面临的重要挑战,尤其是革兰氏阴性菌的感染,对人类健康造成极大威胁[7,8]。为了缓解传统抗生素耐药性压力,新型的抗耐药性、高活性、低毒性的抗菌药物开发刻不容缓。抗菌肽作为具有独特杀菌机制,高效快速杀菌活性及不易产生耐药性等特点[9],被认为是潜在新型抗菌药物,已被广泛关注并寄予厚望。
对于革兰氏阴性菌感染,尤其以败血症,脓毒症为代表相关疾病,其治疗过程中单纯的杀菌还不能满足临床治疗目的[10,11]。革兰氏阴性细菌生长或抗菌药物杀菌的过程往往会伴随内毒素的释放,进而诱发炎症因子风暴,诱发相关疾病,如败血症,严重威胁患者生命[12]。杀灭细菌和中和内毒是革兰氏阴性细菌治疗面临的重要挑战。本研究基于此双重功能,通过GGGS 柔性linker 实现两个分别具有内毒素中和作用和快速杀菌作用的多肽杂合,实现双重功能有效发挥,并不具有显著溶血性。
基于小肽柔性Linker 为铰链连接两个具有功能活性的多肽或蛋白质亚基实现双重功能的发挥是新型多功能多肽或蛋白药物设计和开发的效手段[12-14]。这些Linker 多以(GGGGS)n 或(G)n 形式,被广泛用于不同功能的多肽或蛋白的融合构建,实现 多 种 功能 的 发 挥,如LHP7[14]和Syn-GNU7 杂 合肽[12]。考虑到母体肽均为短的多肽,尽可能减少柔性铰链区Linker 序列对母体肽结构和功能影响,笔者选择GGGS 4 肽Linker。结果表明,这种杂合构建的新型LLH 杂合肽具有内毒素中和作用和更强的抗菌活性。结果也进一步证实了,通过柔性Link‑er 实现多功能多肽或蛋白的设计策略是可行的。
新型杂合抗菌肽LLH 表现出类似LBP(86-89)的内毒素中和作用(LPS 结合作用),同时,表现出显著的抗E. coli活性(MIC,4~8 μmol/L),且强于母体肽LBP 和HLF。通过二级结构分析表明,LLH 杂合肽正电荷数增加至+9,两亲性和疏水性位于两母体肽之间。诸多研究表明,抗菌肽的正电荷跟其抗菌活性密切相关,正电荷越多,其与细菌细胞膜结合作用可能越强[15,16]。同时,两亲性和疏水性的平衡也是抗菌肽抗菌活性发挥的关键因素[15]。因此,笔者推测,LLH 杂合肽抗菌活性的增强可能与其正电荷的增加及两亲性和疏水性的平衡有关,具体机制有待后续进一步的研究。
溶血性是反映药物对哺乳动物红细胞毒性的重要参数。抗菌肽开发为临床抗菌药物的限制因素之一就是细胞毒性[17]。一些抗菌肽虽然具有广泛的抗菌活性和独特抗菌特性,但其无差别破坏细胞膜易引起溶血[18]。科学家可以通过对抗菌肽进行改造,如增加柔性Linker[19]、侧链[20]、净电荷[21]、疏水性[22]等方式,提高抗菌肽的杀菌活性同时降低溶血性。笔者通过柔性Linker 连接实现的中和内毒素和增效抗菌活性的新型双功能杂合肽LLH 并未表现出显著的溶血性,表明临床应用具有一定的安全性。
总之,借助柔性Linker GGGS 多肽,实现了母体肽LBP(86-99)和HFL(1-11)中和内毒素和高效抗菌活性双重功能的发挥,为新型抗大肠杆菌等革兰氏阴性细菌感染药物的设计提供思路和参考。同时,LLH 表现出显著中和内毒素作用,强大快速的抗大肠杆菌活性(MIC,4~8 μmol/L)和无溶血性,提示其是潜在用于治疗大肠杆菌感染的抗菌肽。
作者贡献度说明:
张勇:负责实验的设计,数据的处理,文章的撰写;李国玉:负责文稿审校,实验指导;王瑞琪、刘辰鹏、姚宏纪、熊婧妍:负责实验的实施,数据的收集。
