止痒平肤液对表皮生长因子受体抑制剂相关皮损的治疗作用
2022-04-20谭可欣薛崇祥鲁星妤董慧静俞仪萱胡紫馨崔慧娟
张 旭,谭可欣,李 嘉,薛崇祥,鲁星妤,董慧静,俞仪萱,胡紫馨,崔慧娟
(1.北京中医药大学 北京 100029;2.中日友好医院,中西医结合肿瘤内科 北京 100029)
表皮生长因子受体抑制剂(epidermal growth factor receptor inhibitors;EGFRIs)已成为EGFR基因突变阳性的晚期肺癌、KRAS基因野生型的晚期结直肠癌等多种恶性肿瘤的一线标准治疗方案,然而随着其广泛应用,该药物不良反应的发生频率越来越高。在EGFRIs 相关的不良反应中,最常见的不良反应为皮肤毒性,发生率最高可达100%[1],其中又以皮疹最为常见[2],已经成为影响晚期肿瘤患者生活质量的最主要因素[3]。
目前认为EGFRIs 相关皮疹的发生与角质形成细胞的炎症反应等有较为明确的关系[4,5],主要机制包括促炎因子和趋化因子的分泌异常[3,6]、角质形成细胞的增殖和分化异常[7]等。在治疗方面,国内、外临床指南均以他克莫司、多西环素、米诺环素等抗生素或激素外用或口服作为推荐的治疗方案[8-12],但临床使用效果不尽人意,并未得到广泛推广。
既往文献及研究发现[13,14],中医药治疗靶向药相关皮疹具有较好的疗效,且安全性较高,目前已被国内的指南推荐应用[12]。中医认为,靶向药所导致的皮疹等不良反应可归属于中医学“痤疮”、“药毒疹”、“肺风粉刺”等范畴。其病因、病机不外乎内因和外因两方面,内因主要与禀赋不足有关,外因主要与药毒及“风、湿、热、毒、瘀”等壅塞于皮肤腠理等有关,内外合邪,发为药疹[12]。
有研究认为,EGFRIs 相关皮疹的病位虽然在皮肤,但因“皮毛为肺脏所主”,故究其根本,为肺经之病变[15]。风热袭肺,则可见皮疹、瘙痒、脓疱等症。病程日久,导致气阴两伤,则可见皮肤干燥、脱屑等症。故在皮疹治疗上强调当以“清热解毒、燥湿消肿、祛风止痒”为基本法则,使“热可消、湿可去、风可停”,则病可愈。基于丰富的临床经验,崔教授创制了纯中药外用制剂止痒平肤液。
止痒平肤液主要由黄芩、苦参、白鲜皮、马齿苋等药物组成。其中黄芩为方中君药,其性味苦寒,归肺经、大肠经等,发挥清热燥湿,泻火解毒之效。苦参、马齿苋二者共为臣药,辅助君药加强其清热解毒之力。白鲜皮为佐使之药,协助君臣增强清解热毒之效,同时又可发挥其祛风止痒的疗效。全方配伍严谨精妙,共奏清热解毒、燥湿消肿、祛风止痒之功。
止痒平肤液作为临床经验方,应用于临床已达10 年余,其对EGFRIs 相关皮疹的疗效明确[16-18],有效率在90%以上,目前已被纳入专家共识[12]。本课题组基于既往临床研究的基础,进行了以下基础实验,旨在验证其疗效,为进一步的临床应用及研究提供更充足的证据,并为进一步的机制探讨打下基础。
1 材料与方法
1.1 实验动物
BN 大鼠,雌性,体重100~120 g,购于北京维通利华实验动物技术有限公司。饲养环境为中日友好医院临床医学研究所医学实验动物平台SPF 动物房[SYXK(京)2016-0043]。
1.2 实验药品和试剂
吉非替尼片:商品名易瑞沙,购于阿斯利康。止痒平肤液:主要成分为黄芩20 g、苦参20 g、白鲜皮30 g、马齿苋30 g,由中日友好医院药学部制剂室提供。大鼠肿瘤坏死因子(TNF-α)ELISA 试剂盒和大鼠白介素-6(IL-6)ELISA 试剂盒均购置于Raybio 公司。
1.3 动物模型的构建
BN 大鼠随机分为空白组(Control group)和吉非替尼组(Gefitinib group),数量分别为6 只和21只。空白组不做任何干预;吉非替尼组大鼠予吉非替尼灌胃给药。吉非替尼的给药剂量为37.5 mg/kg q.d.,共给药21 d。
1.4 分组处理
实验第22 天,吉非替尼组大鼠再次进行分组,随机分为模型组(Model group)6 只、吉非替尼+外用止痒平肤液组(Gefitinib+ZY)9 只、吉非替尼+外用生理盐水组(Gefitinib+NS)6 只,并剃除大鼠背部毛发。各实验组大鼠继续予吉非替尼灌胃,用药剂量同前。同时,Geftininb+ZY 组开始外用中药止痒平肤液,Gefitinib+NS 组予以等剂量的生理盐水外用。各实验组中外用药物剂量均为1.4 mL/只,每日1 次,给药30 min 后用清水擦去皮肤上残留药物,连续给药7 d。
1.5 监测指标
1.5.1 皮疹严重程度分级 每日观察大鼠皮肤表现并拍照记录。在外用药物干预前以及干预7 d 后对大鼠背部剃毛部位的皮疹进行详细记录并严格按标准进行分级[19]。见表1。

表1 MASCC 皮疹分级标准Tab 1 MASCC grading standards
1.5.2 皮肤炎症状态评分 在外用药物干预前以及7 d 后对大鼠背部皮肤的炎症状态进行详细记录并按照评分标准进行严格评分[20],即根据红疹、脱屑、渗出、皮肤增厚等方面进行综合评分。见表2。

表2 皮肤炎症状态评分Tab 2 Inflammation status score of skin
1.5.3 大鼠皮肤形态学变化 在实验过程中用数码相机对大鼠背部皮肤进行拍照记录,动态观察实验过程中大鼠的皮肤形态学变化。
1.5.4 大鼠皮肤病理变化 皮肤取材后用10%福尔马林溶液进行固定,经石蜡包埋固定后进行切片。切片后进行标准的脱蜡、不同浓度梯度的乙醇脱水等标准处理,并进行苏木素-伊红(HE)染色,于光学显微镜100、200、400 倍视野下观察皮肤病理变化。
1.5.5 大鼠血清中炎症因子 ELISA 法测定大鼠血清中炎性因子肿瘤TNF-α、IL-6 含量。将BN 大鼠麻醉,取心尖部血液5 mL,静置1~2 h,用离心机进行离心,离心后用移液枪吸取上清液约1 mL,保存在2 mL 的EP 管中,并储存于−80 ℃冰箱中待测。按照试剂盒说明书进行实验操作,最终测出样本血清中目标炎症因子的浓度并做好记录。
1.6 统计学处理
采用SPSS 20 统计软件进行统计分析,数据中计量资料以均数±标准差表示。总体资料服从正态分布或近似正态分布,运用t检验进行分析;若数据不符合正态分布,则运用非参数检验。多样本均数的比较采用方差分析。药物有效率比较时运用Fisher 确切概率法。检验标准α=0.05。
1.7 伦理批准
该研究经中日友好医院临床医学研究所医学实验动物平台伦理委员会批准(编号:190114)。
2 结果
2.1 止痒平肤液可降低皮疹的分级
本实验重点关注大鼠背部及耳后皮疹的情况。除空白组大鼠外,各组大鼠颈背部、耳后等均产生了不同程度的皮疹。通过对实验结果进行分析发现,Model 组大鼠背部皮疹随用药时间延长而逐渐加重;在用中药3 d 后Gefitinib+ZY 组大鼠皮疹开始减轻,用药7 d 后共有8 只大鼠皮疹较用药前明显减轻甚至消失;Gefitinib+NS 组仅有1 只大鼠皮疹较用药前好转。在有效率方面,止痒平肤液有效率(88.89%)较生理盐水有效率(16.67%)有显著提高(P=0.001)。见表3。
2.2 止痒平肤液能降低皮肤炎症评分,减轻炎症反应
在外用药物干预前后对大鼠背部皮肤进行炎症评分并记录。通过统计分析发现,在应用中药后,Gefitinib+ZY 组 炎 症 评 分 较Model 组 和Gefi‑tinib+NS 组均有明显下降(P=0.001);Gefitinib+ZY 组炎症评分较用药前也明显下降(P=0.004)。见表4。
表4 皮肤炎症状态评分(±s)Tab 4 Skin inflammation status score(±s)
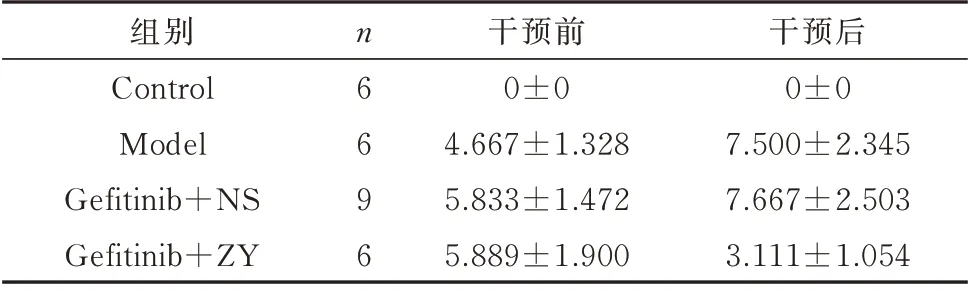
表4 皮肤炎症状态评分(±s)Tab 4 Skin inflammation status score(±s)
组别Control Model Gefitinib+NS Gefitinib+ZY n 6 6 9 6干预前0±0 4.667±1.328 5.833±1.472 5.889±1.900干预后0±0 7.500±2.345 7.667±2.503 3.111±1.054
2.3 皮肤形态学变化
2.3.1 动物模型构建阶段 从图1 中可以得知,空白组在实验前后皮肤表现未见明显改变,而吉非替尼组大鼠在吉非替尼灌胃21 d 后,皮肤上出现了典型的红色丘疹、渗出、结痂等皮肤炎症表现,与临床和文献报道表现一致。

图1 应用吉非替尼前后各组大鼠皮肤表现Fig 1 Skin change before and after 21d of administration of gefitinib
2.3.2 外用药物干预前后 从图2 中看出,空白组前后皮肤表现无明显改变;Model 组和Gefitinib+NS 组大鼠皮肤表现较7 d 前明显加重,尤其大鼠耳后皮肤,可以看到明显的红色丘疹、结痂及渗出等炎性表现;而Gefitinib+ZY 组大鼠在应用“止痒平肤液”7 d 后,大鼠背部皮疹明显消退。
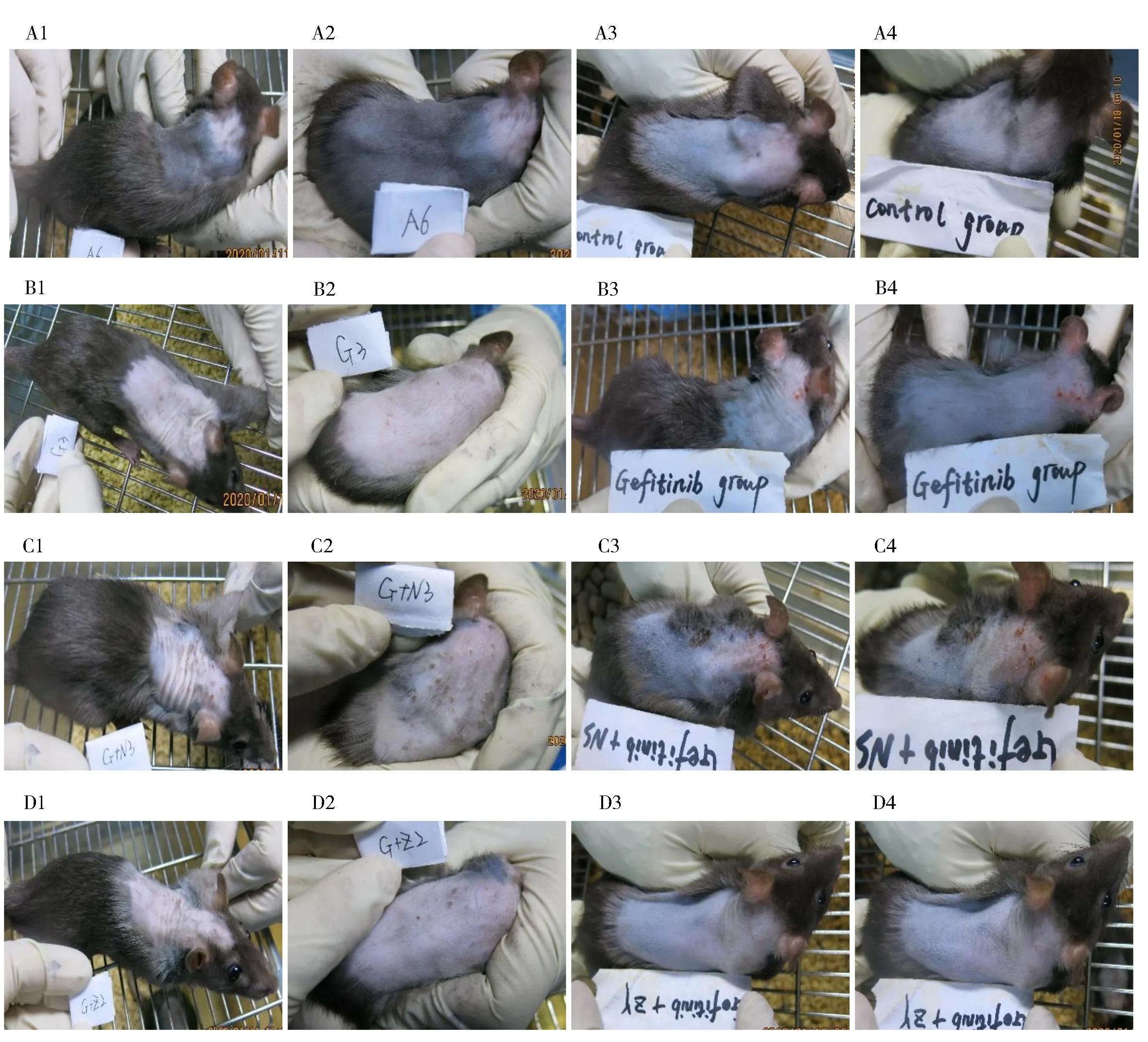
图2 应用不同药物干预前后皮肤表现Fig 2 Skin change before and after topical drug intervention
2.4 皮肤病理
与空白组相比,Model 组和Gefitinib+NS 组均有大量炎症细胞浸润、表皮增厚、棘层松解、角化不全等皮肤炎症的表现;而Gefitinib+ZY 组大鼠表现较空白组并无明显差异,炎症表现不明显。见图3。

图3 大鼠皮肤病理表现Fig 3 Pathological changes of rats in different groups
2.5 大鼠血清中相关炎症因子
2.5.1 TNF-α Model 组TNF-α 浓 度 较 空 白 组 显著升高,差异有统计学意义(P<0.001)。Gefi‑tinib+ZY 组TNF-α 浓度组较Model 组明显下降,差异有统计学意义(P=0.002),与空白组相比未见明显差异(P=0.279)。Gefitinib+NS 组TNF-α 浓度与空白组相比显著升高(P=0.002),较Model 组未见明显下降(P=0.210),见表5。
2.5.2 IL-6 Model 组IL-6 浓度较空白组有显著升高,差异有统计学意义(P<0.001)。Gefitinib+ZY 组IL-6 的浓度较Model 组明显下降(P=0.002),相比空白组无明显变化(P=0.165)。Gefi‑tinib+NS 组IL-6 浓 度 明 显 低 于Model 组(P=0.029),且与空白组相比无明显变化(P=0.064),见表5。
表5 各组TNF-α 和IL-6 浓度比较(±s,pg/mL)Tab 5 Concentration of TNF-α and IL-6(±s,pg/mL)

表5 各组TNF-α 和IL-6 浓度比较(±s,pg/mL)Tab 5 Concentration of TNF-α and IL-6(±s,pg/mL)
注:因所测得的TNF-α 数值较小,故用OD 值代替。
组别Control 组Model 组Gefitinib+NS 组Gefitinib+ZY 组IL-6 0.998±0.501 2.548±0.553 1.610±0.350 1.442±0.105 n 6 6 9 6 TNF-α (OD 值)0.058±0.029 0.069±0.041 0.066±0.046 0.061±0.026
3 讨论
根据既往研究基础[21],应用吉非替尼21 d 后,EGFRIs 相关皮疹模型可成功建立,动物皮肤会有明显的红色丘疹、结痂、渗出等表现,皮肤病理可看到明显的炎症表现,且血清中TNF-α、IL-6 等炎症因子的浓度相比正常会有显著升高。本研究中吉非替尼组大鼠在应用吉非替尼后也出现了相同的表现,而且血液指标较空白组有明显提高,和既往研究基础及文献报道类似[22-25],据此可验证皮疹动物模型的成功建立。
自实验第22 天开始,除空白组和Model 组外,各研究组在口服吉非替尼的基础上开始外用不同的药物。研究中发现,就皮肤大体表型而言,Model组大鼠的红色丘疹、结痂表现则随着吉非替尼用药时间的延长则逐渐加重,在实验结束时,大鼠红色丘疹、结痂、渗出等表现为各组中最严重,炎症评分较高;Gefitinib+NS 组大鼠在外用生理盐水后,大鼠红色丘疹、结痂、渗出表现较前并未明显减轻,甚至逐渐加重;而Gefitinib+ZY 组大鼠在应用止痒平肤液3 d 后,大鼠的红色丘疹、结痂、渗出等表现开始逐渐减轻;在应用中药7 d 后,红色丘疹、结痂、渗出等炎症表现较用药前及Model 组等明显减轻,某些大鼠体表结痂渗出等甚至完全消失,炎症评分为各实验组中最低。
而从皮肤病理观察,Model 组和Gefitinib+NS组大鼠皮肤HE 染色可以看到明显的表皮增厚、中性粒细胞浸润等炎症表现,与既往文献报道类似[22,26,27];而Gefitinib+ZY 组大鼠的皮肤HE 染色表现与空白组相比未见明显差别,在表皮厚度、中性粒细胞等的浸润等方面无明显差异。故单纯从皮肤表现而言,止痒平肤液治疗靶向药相关皮疹效果显著,该研究结果与既往临床研究相符。
就血液学指标而言,TNF-α、IL-6 等炎症因子浓度的高低与炎症的程度有密切相关,为常见的炎症反应标记物,可以作为判断机体炎症严重程度的参考指标[28,29]。从机制来看,TNF-α 可激活角质形成细胞的EGFR 信号通路,并可促进EGFR 的磷酸化过程,但若过量表达,则促进角质形成细胞中炎症介质的表达,导致炎症反应的发生[30];而IL-6 作为引起炎症的核心介质[31],具有催化和放大免疫炎症的 作 用[29,32,33]。在 靶 向 药 相 关 皮 疹 患 者 血 液 中,TNF-α、IL-6 等细胞因子的表达会显著增高[3],这或许是导致EGFRIs 相关皮疹的重要因素[6]。同样,本 研究中,Model 组大鼠 血清中TNF-α 和IL-6 浓度比正常大鼠血清中炎症因子的浓度显著升高,与既往文献等保持一致,这或许也是吉非替尼组大鼠出现了较为明显的红色丘疹、皮肤结痂等炎症反应的重要原因。
研究证实,若应用TNF-α、IL-1 等的拮抗剂进行治疗,其皮疹等不良反应会有较明显的减轻[23,24]。本研究中,Gefitinib+ZY 组大鼠在应用止痒平肤液后,血清中炎症因子TNF-α 和IL-6 浓度比Model 明显降低,且与空白组无明显差异;而Gefitinib+NS组大鼠在外用生理盐水后,其炎症因子TNF-α 浓度并与Model 组相比无明显异常,较空白组仍明显升高。故从血清学指标而言,止痒平肤液可降低TNF-α、IL-6 等炎症因子的水平,减轻大鼠皮肤皮疹等反应,有效性得到进一步证实。
另外,现代药理学研究发现,止痒平肤液的主要药物 组成中,苦参[34,35]、黄 芩[36]、白鲜皮[37]、马齿苋[38,39]等可下调外周血中TNF-α、IL-6 等细胞因子的表达,发挥抗炎作用。故综合以上研究结果,我们可证实止痒平肤液可下调血液中TNF-α、IL-6 等炎症因子的水平,明显减轻EGFRIs 引起的皮损。
作者贡献说明:
张旭进行文章的构思、写作与修改、实验设计与操作;崔慧娟进行实验设计、文章构思、文稿修改与校对;谭可欣进行文章修改及数据分析;李嘉、薛崇祥进行实验操作及图片信息采集;鲁星妤、董慧静、俞仪萱、胡紫馨进行文章内容校对及数据收集与核对。
