稳心颗粒对心肌梗死大鼠BCL⁃2/BAX/Caspase凋亡途径基因表达的影响
2022-04-20纪晓迪刘珂珂娄利霞赵久丽吴爱明
吕 梦,纪晓迪,刘珂珂,杨 丁,娄利霞,聂 波,赵久丽,吴爱明
(北京中医药大学东直门医院/中医内科学教育部和北京市重点实验室,北京 100700)
心血管病高居我国城乡居民总死亡原因的首位[1],并且发病率持续升高,其中冠心病患病人数已达1 100 万之多[2]。心肌梗死是冠心病的急危重症,由于冠状动脉供给心肌的血液阻断,造成部分心肌因严重的持久性缺血而发生局部坏死,随着坏死区域的扩大,心功能降低,心肌细胞大量凋亡,进而出现严重的心力衰竭或并发心律失常而致死。研究表明,调控心肌细胞凋亡对心肌梗死的治疗有积极意义[3,4]。
细胞凋亡是细胞主动死亡的过程,发挥着清除机体内受损或多余细胞的作用,以维持组织器官及内环境的稳定,而凋亡异常也会导致疾病的发生[5]。机体内主要存在外源性、内源性及内质网应激3 种细胞凋亡途径,其中内源性途径作为主要的细胞凋亡传导途径在心肌梗死病理进展中发挥着关键作用[6,7]。BCL-2 家族及Caspase 家族基因参与调控内源性凋亡途径,有研究发现在缺血再灌注的心肌细胞中,BCL-2 家族中的BCL-2、BAX基因表达改变,激活Caspase 凋亡途径启动因子Caspase-9 及执行因子Caspase-3,最终诱导细胞凋亡[8-10]。课题组前期研究发现稳心颗粒具有改善心肌梗死大鼠心肌细胞纤维化、心室重构等心脏保护作用[11,12],但其内在机制并不清楚,本研究旨在从BCL-2/BAX/Cas‑pase 凋亡途径基因调控角度深入研究稳心颗粒发挥疗效的分子机制,为促进其临床应用提供新的实验室证据。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF 级别雄性SD 大鼠40 只,体质量(210±20)g,由北京维通利华实验技术有限公司购入,许可证号SCXK(京)2016-0006。本动物实验经北京中医药大学东直门医院实验动物伦理委员会批准。
1.1.2 药物及试剂 稳心颗粒,规格5 g/袋(山东步长制药股份有限公司,国药准字Z10950026),酒石酸美托洛尔片,规格25 mg/片(阿斯利康制药有限公司,国药准字H32025391),TUNEL 试剂盒(Pro‑mega 公司,货号G3250),苏木素-伊红(HE)染液(南京建成科技有限公司,货号:D026-1),Trizol 试剂盒(Thermo Fisher Scientific,货号:15596026),Real-time PCR 扩增试剂盒(美国ABI 公司,货号:4472897)。
1.1.3 仪器 超高分辨率小动物超声成像系统(加拿大VisualSonics 公司,型号:Vevo 2100),小动物呼吸机(ALC-VBS),光学显微镜(德国徕卡显微系统,型号DMC5400),徕卡全自动封闭组织脱水机(型号:ASP300S),徕卡组织包埋机(型号:EG1150H),徕卡烤片机(型号:HI1220),实时荧光定量PCR 仪(型号:Stratagene Mx3000P),4 ℃低温高速离心机(美国Thermo 公司,Thermo)。
1.2 方法
1.2.1 模型制备 采用心脏左冠状动脉前降支结扎法建立心肌梗死大鼠模型[13]。1%戊巴比妥钠麻醉大鼠,随后左胸前区备皮,仰卧位固定于鼠板,气管插管后连接小动物呼吸机,参数设置呼吸频率80次/min,潮气量0.7~0.8 mL。手术区皮肤消毒后,用眼科剪在左胸前区三四肋间逐层剪开皮肤、肌肉层,眼科镊钝性分离肋骨层,撕开心包膜后,充分暴露手术范围,于左心耳下冠状动脉分叉处下约2 mm 行结扎术,肉眼可见结扎线下心肌组织缺血变白,随后复位心脏、肋骨,逐层缝合肋骨层、肌肉层和皮肤。术后即刻心电图可见ST 段抬高,术后24 h 心电图可见病理性Q 波形成。
1.2.2 分组及给药 术后24 h 心电图见V3~V6、Ⅰ、AVL 导联兼V1或V2导联出现病理性Q 波为造模合格纳入分组标准[14]。随机分为模型组,美托洛尔组,稳心颗粒低、高剂量组,另设只穿线不结扎的假手术组作为对照,每组8 只。各组大鼠给药剂量通过等效剂量换算方法进行折算,稳心颗粒低剂量组(1.35 g/kg)及美托洛尔组(2.25×10-3g/kg)采用等效剂量,稳心颗粒高剂量组给药剂量(2.7 g/kg)为低剂量组的2 倍。术后24 h 灌胃给药,每日一次,连续治疗2 周。假手术组及模型组给予等体积去离子水。
1.2.3 超声心动图检测 治疗2 周后,采用超声心动图检测各组大鼠心脏结构和功能。1%戊巴比妥钠腹腔注射麻醉,心前区大范围备皮,将大鼠固定于操作台,选取胸骨旁左室短轴切面,由二维超声引导M 型曲线进行检测,主要指标包括大鼠左心室收缩末期前壁厚度(LVAWs)、收缩末期内径(LVIDs)、收缩末期后壁厚度(LVPWs)、舒张末期前壁厚度(LVAWd)、舒张末期内径(LVIDd)、舒张末期后壁厚度(LVPWd)以及左室射血分数(LVEF)。所有测量值取3 个连续心动周期的平均值。
1.2.4 HE 染色 心脏超声检测后,进行心脏组织取材,大鼠麻醉后,固定于鼠板,开胸后迅速取出心脏,在冰上低温操作,用眼科剪剪去左心耳及右心房、右心室,于心脏最大横截面处切取厚度4 mm 的组织块,浸泡于4%多聚甲醛溶液中充分固定,使用全封闭组织脱水机进行组织处理,而后进行石蜡包埋和切片,片厚4 μm。HE 染色先将石蜡切片60 ℃烤片1 h,随后使用二甲苯充分脱蜡、梯度乙醇下行,自来水冲洗5 min,苏木素染色液染核8 min,自来水冲洗5 min,盐酸酒精分化40 s,自来水冲洗返蓝10 min,伊红溶液染细胞质8 min,自来水冲洗3 min,梯度乙醇上行脱水,二甲苯中透明,中性树胶封片,光学显微镜下观察心肌组织病理变化。
1.2.5 实时荧光定量PCR(Real-time PCR)检测取大鼠梗死边缘区心肌组织,采用Trizol 法提取心脏总RNA。紫外分光光度计测定OD260/OD280,计算各组总RNA 浓度,参照试剂盒说明书配置反转录反应体系。采用Real-time PCR 检测目的基因相对表达水平,扩增条件为:95 ℃预变性10 min,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸20 s,循环40 次。引物序列为:BAX(上游引物TTGCTA‑CAGGGTTTCATCC, 下 游 引 物 GTC‑CAGTTCATCGCCAAT)、BCL-2( 上 游 引 物CAGAATCAAGTGTTCGTCAT,下游引物TC‑GTTCTTCACCTCCACCATGA)、Caspase-9(上游引物GCCACTGCCTCATCATCAACAA,下游引物AGTCTTCATCTCCAGTATCC)、Caspase-3(上游引物GAATCCACGAGCAGAGTC,下游引物TCAACAAGCCAACCAAGT),HMBS(上游引物CCTATGTCTGGCTGTCAAG,下游引物CAACAACTCTGGTTCAATCTC),以HMBS 为内 参[15]采 用2-ΔΔct法 计 算 各 目 的 基 因 的 相 对 表 达水平。
1.2.6 TUNEL 染色 根据TUNEL 试剂盒说明书,将石蜡切片置于烤片机上60 ℃烤片1 h,二甲苯Ⅰ、Ⅱ、Ⅲ各15 min,梯度乙醇下行各5 min,充分脱蜡水化后,于固定液中固定15 min,PBS 漂洗后,加入20 μg/mL 的蛋白酶K 溶液室温孵育10 min,PBS漂洗后,平衡液孵育10 min,之后滴加rTdT 孵育缓冲液,37 ℃孵育1 h,孵育结束后,终止液终止15 min,再用PBS 漂洗后,滴加抗荧光淬灭封片剂封片。在荧光显微镜下进行图像采集,在520 nm 激发光下观察凋亡细胞核的绿色荧光,在460 nm 激发光下观察正常细胞核的蓝色荧光。采用ImageJ 计算凋亡细胞核及正常细胞核数目,计算各组细胞凋亡率。
1.3 统计学处理
使用SPSS 软件进行统计学分析,计量资料采用均值±标准差(±s)表示,符合正态性分布的数据,用单因素方差分析,方差齐时组间比较用LSD法,方差不齐组间比较用Dunnett’s T3 法,非正态分布的数据用非参数秩和检验,均以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠超声心动图结果比较
心肌梗死2 周后,模型组大鼠LVAWs、LVP‑Ws、LVPWd 及LVEF 均 显 著 减 少(P<0.05~0.01),LVIDs、LVIDd 显著增加(P<0.05~0.01);与模型组相比,稳心颗粒低、高剂量组及美托洛尔组大鼠LVAWs、LVPWs、LVPWd 及LVEF 均显著增加(P<0.05~0.01),LVIDs 显著减小(P<0.01),稳心颗粒低剂量组与美托洛尔组LVIDd 显著减少(P<0.05~0.01);LVAWd 差异无统计学意义(P>0.05)。见表1。
表1 各组大鼠超声心动图结果比较(n=8,±s)Tab 1 Comparison of echocardiographic results of rats in each group(n=8,±s)

表1 各组大鼠超声心动图结果比较(n=8,±s)Tab 1 Comparison of echocardiographic results of rats in each group(n=8,±s)
注:与假手术组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01。
组别假手术组模型组稳心颗粒低剂量组稳心颗粒高剂量组美托洛尔组LVEF (%)84.36±0.84 29.81±4.08**54.19±6.02*#63.39±5.52##67.15±6.20##16.329 0.000 FP LVAWs (mm)3.52±0.15 1.82±0.11**2.81±0.15*#2.70±0.21*#2.95±0.30##19.551 0.001 LVIDs (mm)3.31±0.15 6.83±0.10**4.67±0.15*##4.27±0.36##3.68±0.46##11.152 0.000 LVPWs (mm)3.42±0.18 2.21±0.20**3.28±0.22##3.46±0.19##3.50±0.19##14.731 0.005 LVAWd(mm)2.07±0.12 1.60±0.16 1.86±0.12 1.64±0.15 1.95±0.16 1.989 0.118 LVIDd (mm)6.56±0.30 7.85±0.46*6.63±0.34#7.11±0.32 6.06±0.41##3.273 0.022 LVPWd (mm)2.51±0.21 1.84±0.13*2.48±0.12#2.37±0.09#2.70±0.26##3.380 0.019
2.2 各组大鼠心脏组织病理改变
HE 染色结果显示,假手术组可见心肌纤维呈长条状排列整齐,细胞核大小形态正常,胞浆染色均一,心肌细胞结构完整;模型组大鼠梗死边缘区心肌纤维断裂溶解,细胞核形态异常,细胞质染色深浅不一,细胞结构排列紊乱;与模型组相比,各给药组心肌细胞结构有所改善,病理改变减轻。见图1。
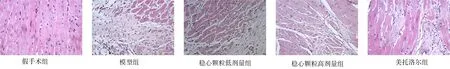
图1 各组大鼠心脏组织病理改变(HE 染色,40×)Fig 1 Pathological changes of heart tissue of rats in each group(HE staining,40 ×)
2.3 各组大鼠凋亡相关基因mRNA 表达的变化
建立心肌梗死模型2 周后,与假手术组相比,模型组大鼠BCL-2mRNA 相对表达水平和BCL-2/BAX 比 值 明 显 减 少(P<0.01),BAX、Caspase-9、Caspase-3mRNA 相对表达水平明显增高(P<0.01);药物治疗2 周后,与模型组相比,稳心颗粒低剂量组BCL-2/BAX 比值明显增加(P<0.05),BAX mRNA 表达水平明显降低(P<0.05),稳心颗粒高剂量组及美托洛尔组BCL-2mRNA 表达水平和BCL-2/BAX 比 值 显 著 增 加(P<0.05,P<0.01),BAX、Caspase-9、Caspase-3mRNA 表达水平显著降低(P<0.05,P<0.01)。见表2。
表2 各组大鼠凋亡相关基因表达比较(n=8,±s)Tab 2 Comparison of apoptosis related gene expression of rats in each group(n=8,±s)

表2 各组大鼠凋亡相关基因表达比较(n=8,±s)Tab 2 Comparison of apoptosis related gene expression of rats in each group(n=8,±s)
注:与假手术组相比,*P<0.05,**P<0.01;与模型组相比,#P<0.05,##P<0.01。
组别假手术组模型组稳心颗粒低剂量组稳心颗粒高剂量组美托洛尔组Caspase-3 1.01±0.05 2.35±0.11**1.86±0.15**1.43±0.09*##1.53±0.18#16.446 0.000 FP BCL-2 1.02±0.07 0.60±0.06**0.82±0.07 0.94±0.04##0.85±0.10#13.635 0.009 BAX 1.03±0.09 1.62±0.05**1.37±0.06**#1.27±0.07*##1.25±0.07*##8.955 0.000 BCL-2/BAX 1.08±0.18 0.38±0.05**0.64±0.06*#0.76±0.07##0.69±0.10*#19.919 0.001 Caspase-9 1.05±0.12 1.61±0.07**1.40±0.10*1.30±0.11#1.19±0.10##4.335 0.006
2.4 各组大鼠心肌细胞凋亡率比较
建立心肌梗死模型2 周后,与假手术组相比,模型组心肌细胞凋亡率显著升高(P<0.01);与模型组相比,稳心颗粒低、高剂量组及美托洛尔组心肌细胞凋亡率显著降低(P<0.01)。见图2,表3。
表3 各组大鼠凋亡率比较(n=8,±s)Tab 3 Comparison of apoptosis rate of rats in each group(n=8,±s)
注:与假手术组相比,*P<0.01;与模型组相比,#P<0.01。
凋亡率(%)1.01±0.04 5.73±0.33*2.74±0.12*#1.46±0.04*#1.43±0.04*#143.245 0.000组别假手术组模型组稳心颗粒低剂量组稳心颗粒高剂量组美托洛尔组F P

图2 各组大鼠心肌细胞凋亡率比较(免疫荧光,40×)Fig 2 Comparison of cardiomyocyte apoptosis rate of rats in each group(immunofluorescence,40 ×)
2.5 稳心颗粒发挥心脏保护作用的分子机制
稳心颗粒调控心肌梗死大鼠BCL-2/BAX/Caspase 凋亡途径基因表达,见图3。

图3 稳心颗粒调控心肌梗死大鼠BCL-2/BAX/Caspase 凋亡途径基因表达Fig 3 Wenxin granule regulates gene expression of BCL-2/BAX/Caspase apoptosis pathway in rats with myo⁃cardial infarction
3 讨论
心肌梗死属中医学胸痹、心痛范畴,病机主要为本虚标实,其中以气虚血瘀为多见,中医治疗多采用益气活血法[16]。稳心颗粒由党参、三七、琥珀、黄精、甘松五味药组成,具有益气养阴,活血复脉定悸之功效。研究表明稳心颗粒可有效减少心梗后心律失常发生事件,发挥心脏保护作用[17]。本研究发现,大鼠结扎左冠状动脉前降支后,心肌血供阻断,导致心肌缺血性坏死损伤,心室结构及功能障碍,出现左心室室壁厚度变薄,左室内径增大,左室射血分数降低,心脏病理学形态紊乱。以上心肌梗死大鼠模型的检测结果与刘威威等[18]报道的临床上心梗患者的心脏病理特征高度一致,基于此动物模型进行稳心颗粒的药理学研究具有较强的参考价值。与模型组相比,稳心颗粒组大鼠心脏结构功能及病理性损伤有明显改善。本研究结果显示,心肌梗死2 周后,模型组大鼠心肌细胞凋亡指数显著升高,说明心肌梗死后处于缺血缺氧状态的心肌细胞凋亡加重,可见心肌细胞凋亡在心脏病理性改变过程中发挥重要作用[19],而心肌细胞的凋亡水平与抗凋亡及促凋亡因子的表达相关。本研究进一步观察心肌梗死大鼠BCL-2/BAX/Caspase 凋亡途径基因表达变化及稳心颗粒的心脏保护作用机制。
研究结果显示,心肌梗死2 周后,模型组BCL-2 mRNA 表 达 水 平 及BCL-2/BAX 比值下调,BAX、Caspase-9、Caspase-3 mRNA 表达上调,心肌细胞凋亡指数显著升高,表明BCL-2/BAX/Caspase 是诱导心肌细胞凋亡的重要途径,心肌梗死后,心肌细胞内产生凋亡信号(缺血、氧化应激等),促凋亡基因BAX 及抗凋亡基因BCL-2 可通过调控线粒体外膜通透性,调节线粒体凋亡途径,使线粒体内的细胞色素C、细胞凋亡诱导因子(AIF)等物质释放至细胞质中,激活Caspase-9 参与凋亡启动,进而活化下游凋亡的执行子Caspase-3,影响DNA 复制、降解凋亡抑制蛋白等,促进心肌细胞凋亡[20-23],表现为心肌细胞凋亡率增加,心脏病理性损伤加重,这是导致模型组大鼠心脏病理性变化的分子机制,此结果与占天为等[24]在心肌梗死大鼠中的凋亡研究相一致。而BCL-2 可抑制BAX 活性阻止其嵌入线粒体外膜上,进而抑制Caspase 家族活性,发挥抗凋亡的作用,本研究结果证实稳心颗粒能在基因水平调控上述过程从而抑制心肌细胞的过度凋亡。
综上所述,稳心颗粒能通过上调凋亡抑制因子BCL-2基 因 表 达,减 轻BCL-2/BAX/Caspase 凋 亡途径介导的细胞凋亡,这是稳心颗粒发挥心脏保护作用的分子机制之一。
本研究仅局限在整体动物水平对稳心颗粒调控心梗大鼠心脏BCL-2/BAX/Caspase 凋亡通路基因表达进行了初步探讨,后续研究将进一步从细胞水平和蛋白表达方面进行实验验证。
作者贡献度说明:
吴爱明:对实验进行设计,实验造模以及文章审校;聂波,娄利霞:对实验提供技术指导;赵久丽:提供超声心动图指标检测技术支持;吕梦,纪晓迪,刘珂珂,赵久丽:负责药物干预,指标检测,数据分析;吕梦:执笔撰写论文。
