影响电解水演示实验结果准确性的因素
2022-04-20梁志锋
梁志锋

摘要:在电解水的演示实验中,装置的电极对实验非常重要,现在购买的许多电解水教学演示装置中,企业为了节省成本并不是用纯铂电极,有的是用其他金属替代或者在其他金属上焊接一小片铂片,时间久了导致电极氧化变小而断落。这时就需要寻找材料来制作电极,本文将研究介绍在没有铂电极的情况下如何寻找合适的替代材料,以及如何提高实验的准确性。
关键词:电解水演示实验;电极;导电剂;溶解性
科学课中教学演示实验的准确性在演示实验中非常重要,直接关系到实验的成败,影响教学效果。电解水演示实验是初中科学教学中一个重要的演示实验,在水的组成和化学变化的微观解释的教学中起着重要的作用。电解水实验的实验结果理论上是氢气与氧气的体积比为2:1,但是在实际实验中由于仪器装备中电极的氧化和导电剂等原因,实际结果中氧气的体积比理论值小,有时小很多。这对教师的教学和学生理解知识产生很大的影响。接下去笔者对影响电解水实验的准确性的因素进行的一些研究。
教师对产生氧气比理论值小的结果的解释一般有二个:一、氧气与电极起氧化反应消耗了一部分氧气。二、氧气在水中的溶解度比氢气大。下面对这二个原因来分析一下。
先分析第一个原因,氧气是一种比较强的氧化剂,氧气在电极上产生时与电极上的金属发生氧化反应是可能的,笔者在用铜、银等金属作为阳极电极,在电解水时的确观察到电极上有黑色的氧化物生成。所以实验结果与理论值有较大差异与阳极金属和氧气反应消耗了一部分氧气是有关系的。
因此我们在做电解水实验时,要提高实验结果的准确性主要是从电极考虑,如何减少电极与氧气的氧化反应。那电极与氧气的氧化反应与哪些因素有关呢?
1、可能与电极材料的活泼行有关;
2、与电解水时加的导电剂有关;为了电解水时不产生其他物质一般加的导电剂为稀硫酸或氢氧化钠溶液。
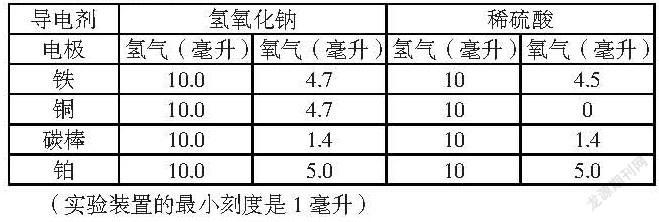
针对这两个因素笔者进行了实验,实验中阴极统一都为铜,因为阴极产生氢气,不存在氧化现象。而阳极分别用铁、铜、碳棒和铂(网购的)作为电极,导电剂分别为氢氧化钠和稀硫酸进行了实验。实验数据如下表:
从实验数据可以看出:
1、用铂作为阳极电极时,實验结果最为准确,氢气和氧气体积比为2:1,与理论值一致。其他铜、铁等金属作为阳极电极时,用不同导电剂结果有所不同,氢氧化钠作为导电剂时,实验数据与理论值都相差较小;用稀硫酸作为导电剂时,不同金属作为阳极实验数据与理论值有或大或小的不同差异;碳棒作为阳极时,在氢氧化钠和稀硫酸作为导电剂的两种情况下,实验数据与理论数据相差都比较大。
2、当阳极不是铂电极时,不同的导电剂对实验结果影响比较大。稀硫酸作为导电剂的情况下,尤其是当铜为阳极时,阳极几乎没有氧气产生,铁为阳极时,产生的氧气也比氢氧化钠为导电剂时要少一些,而用非金属的碳棒作为阳极时,不同导电剂下产生的氧气没有差异。因此用氢氧化钠作为导电剂时,金属阳极电极的氧化作用比用稀硫酸作为导电剂时要弱。
再分析第二个原因,在20摄氏度,1个标准大气压下,氧气的溶解度是0.031,氢气的溶解度是0.018,溶解度的确氧气比较大,但是在做实验时用的水是自来水,是天然水,空气中本身就含有约20%的氧气,天然水中本来就溶解了很多的氧气,而空气中几乎不含氢气,所以天然水中也几乎不含氢气。所以在电解水的时候产生的氢气和氧气到底是哪一种溶解在水中多?这是不确定的,所以第一种解释是不严谨的。实际情况如何,我们可以通过实验来说明。
实验设计:分别来电解天然自来水和经过沸煮后的冷开水,天然水中溶解有空气,沸煮后的冷开水溶解在其中的空气已经逸出,水中没有氧气也没有氢气。都加入氢氧化钠作为导电剂,阳极电极为网购的纯铂电极,阴极为铜电极。
从数据看氧气和氢气的溶解性差异对实验的结果没有影响,因为氢气和氧气在水中的溶解性都不大,如果再加上在进行实验准备时的试做,水中的氢气和氧气基本饱和了,在进行教学演示实验时,溶解性差异对实验结果就不会造成影响了,因此实验实际数据与理论值相差较大不是由于氢气和氧气溶解性差异造成的。
通过以上研究发现,影响电解水实验结果的因素主要是电极材料和导电剂,与氧气和氢气的溶解性差异没有太大关系。采用铂电极实验结果最为准确,但是,由于铂为贵金属,铂电极价格昂贵,现在学校购买来做演示实验用的电解水装置的电极都不是纯铂电极。时间久了电极容易氧化损坏。在学校条件有限,没有铂电极的条件下,我们如何来进行电解水实验的演示呢?分析实验数据,也可以找出替代方案:用氢氧化钠作为导电剂,用铜或铁作为电极。这样虽然实验结果不是非常准确,但误差也相对较小。在教学时,只要跟学生说明氧气比氢气偏少的原因,不但不会对教学效果产生太大影响,还顺带预习一下氧气比较活泼的化学性质。
