小鼠半规管造模的实验技术优势及其应用
2022-04-19王天颖车慕瑶李轶
王天颖 车慕瑶 李轶
首都医科大学附属北京同仁医院(北京 100730)
半规管开窗技术是指对半规管骨壁进行钻孔并去除的一项耳外科手术技术,临床上常利用此技术进行开窗后半规管阻塞,开窗后给药、开窗后冷冻、开窗后化学迷路切除等手术,用于治疗一些保守治疗效果不佳的前庭周围性眩晕。曾也有人通过半规管开窗进行某些疾病复杂情况下的手术,如先天性传导聋、耳硬化症的听力重建等[1,2]。半规管开窗后阻塞尤其被认为是改善顽固性眩晕非常有效的方法[3-5],但有临床研究者发现此手术可能永久损伤残余听力,临床上对此技术的安全性尚不明确[6]。
在动物实验的研究中,有学者通过半规管开窗进行造模,开展相关内耳病理生理学研究。豚鼠由于半规管结构大,易于实施外科手术,常被用于半规管开窗造模[7-9]。但豚鼠繁殖周期长,耳科学遗传背景不明晰等原因,其作为耳科学实验动物存在诸多局限性。
随着对小鼠遗传背景认识增加,其在耳科学疾病和功能紊乱尤其是内耳疾病的基因和靶向治疗方面的研究价值日益凸显,逐渐替代豚鼠成为研究人类遗传性内耳疾病有价值的模型。但小鼠微小的半规管结构使得外科手术操作难度大,因此,目前国内外相关文献报道较少。有学者通过小鼠半规管开窗进行基因导入并成功在内耳表达,但实验中的基因表达模式仍然不明确[10,11];也有研究者通过此技术向半规管内注射耳毒性药物进行损伤内耳毛细胞造模的实验[12-13],但对于药物完整分布情况以及机制也仍然未知[13]。
因此,本实验以小鼠为研究对象,进行了小鼠半规管开窗后给药或阻塞模型的可行性探究,对给药后药物在内耳中的分布、阻塞后半规管的形态变化进行了观察,以阐明经小鼠半规管开窗技术进行实验造模的可行性和优势。此种造模方法可以为今后研究半规管阻塞后内耳的病理生理变化,以及通过半规管给药进行耳毒性药物或内耳基因治疗的研究提供更可靠的动物实验技术和模型支持。
1 材料与方法
1.1 材料
实验动物:20只两月龄CBA小鼠由首都医科大学动物部提供。主要试剂:Texas Red耦合的庆大霉素(Texas Red-conjugated AG,AGTR),火棉胶,鬼笔环肽(Phalloidin)购于Invitrogen公司。所有荧光照片使用Leica激光共聚焦显微镜拍摄。
1.2 动物手术方法
所有动物均以左耳作为手术耳。小鼠经腹腔注射甲苄噻嗪(7mg/kg)和氯胺酮(65mg/kg)麻醉后,用电动动物剪毛器剪去左侧耳后区的毛发,红霉素眼膏覆盖小鼠眼部,术前皮下注射止痛剂美洛昔康(1 mg/kg),并用75%的乙醇消毒三次。手术均在无菌手术台的手术显微镜下进行。使小鼠右侧卧位,左耳朝上,在距左耳耳后沟3mm处作1cm切口(图1A),分离皮下组织及肌肉。
1.2.1 保留膜迷路的外侧半规管和后半规管开窗后阻塞
定位并暴露外侧半规管和后半规管(图1B),在暴露的外侧半规管和后半规管中部分别用动物手术电钻进行如图示的钻孔,有透明液体涌出,同时经钻孔处观察到骨壁破坏后呈现近白色半透明组织(图1C),用钝头镊轻触此组织,确认为软组织。取一小块事先准备的肌肉(使其蒸发掉部分水分)分别将孔填塞(图1D),并取骨蜡和生物胶封闭。关闭切口,缝合皮肤。动物放入温箱自然苏醒后置于饲养箱,正常进食。整个手术过程需严格避免出血,以免血液经半规管钻孔处混入淋巴液,影响模型的可靠性。手术时间控制为20min。
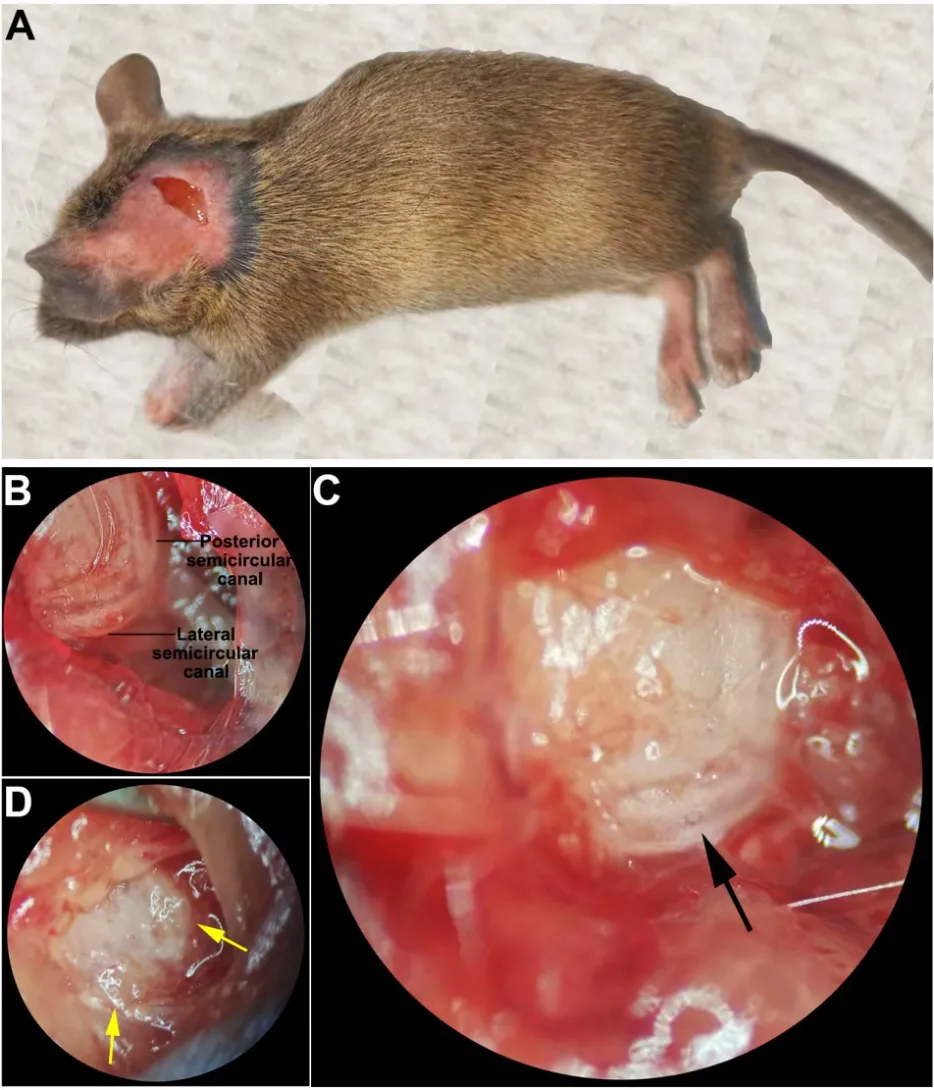
图1 小鼠外侧半规管和后半规管开窗及阻塞的手术方法。A:小鼠右侧卧位,手术切口距耳后约3mm;B:钝性分离肌肉后定位并暴露的外侧半规管和后半规管;C:经动物手术电钻磨除部分骨壁后的半规管(外侧半规管),黑色箭头所示为钻孔处,可见近白色半透明组织;D:经肌肉和筋膜阻塞的外侧半规管和后半规管(左耳)。Fig.1 Fenestration and occlusion of lateral semicircular ca-nal and posterior semicircular canal in mice.A:the mouse was placed in the right lying position,and the surgical inci-sion was made about 3mm behind the ear.B:the lateral semi-circular canal and the posterior semicircular canal were locat-ed and exposed after separation of the muscle;C:semicircular canal after partial removal of the bone wall by an animal sur-gical drill(lateral semicircular canal).The hole shown by the black arrow shows nearly white translucent tissue;D:the mus-cle-filled hole in the lateral semicircular canal and posterior semicircular canal(left ear).
1.2.2 经后半规管开窗注射Texas Red耦合的庆大霉素(AGTR)
如文献中报道的方法[14],暴露后半规管,同时取一块肌肉晾干(用于后续封闭孔洞)。在暴露的后半规管中部钻孔,观察到液体流出,过程中注意避免损伤血管。将微型管尖端经孔插入后半规管约1-2mm(尖端朝向半规管总角),将AGTR(庆大霉素浓度为50μM)通过微量进样器泵入(每次手术给药量为1μl)。注射完成后将备好的肌肉填塞进孔内,将孔进行封堵,确保孔洞完全密封,无液体流出。复位组织,缝合皮肤。手术结束后30min处死,取出颞骨组织,进行处理,并用荧光显微镜拍摄。
1.3 半规管的火棉胶切片制备
小鼠经阻塞手术后1月,麻醉成功后断头处死。取出听泡,在解剖显微镜下去除镫骨,开放圆窗、卵圆窗,并在蜗顶处打孔,进行4%多聚甲醛液灌注。将处理好的组织置于4%多聚甲醛溶液中于4℃冰箱固定24h,再以10%EDTA溶液中脱钙3天,随后分别进行乙醇的分级梯度脱水,后置于1:1酒精乙醚溶液中12h,两次。取出后将样品进行分级浓度的火棉胶包埋,共6周,放置密封皿中使其硬化。对包埋并硬化好的颞骨组织进行修剪,分别沿着堵塞半规管的长轴进行厚度为20μm的连续组织切片,将切片置于80%乙醇溶液中,随后进行HE染色,取有代表性的组织片进行拍摄。
1.4 前庭组织和耳蜗基底膜组织的标本制备
将1.2.2得到的部分颞骨组织用4%多聚甲醛溶液固定2h,用PBS冲洗3次后,仔细解剖,取出椭圆囊及壶腹,并分离出耳蜗基底膜。耳蜗基底膜标本以0.3%Triton X-100处理,用鬼笔环肽(1:100,30min)避光孵育,DAPI(4’6-二脒基-2苯基吲哚,1:1000)进行细胞核染色5min,样品用PBS漂洗后,封片。用Leica激光共聚焦显微镜进行观察照相。
2 结果
2.1 经开窗并阻塞后的半规管形态学
我们用CBA小鼠进行了半规管骨壁开窗并阻塞的手术,实验中,我们发现小鼠的上半规管被颅骨遮盖,无法通过肌肉的钝性分离进行暴露,而外侧半规管和后半规管暴露充分(图1B)。而临床中,后半规管和/或外侧半规管的开窗填塞也相对常见[14],因此,我们进行了小鼠外侧半规管和后半规管开窗后填塞的手术。
我们对术后的小鼠进行了前庭功能方面的观察,手术后第1天、第3天、第7天、第28天均未观察到打转、头偏、步态异常等前庭功能障碍的情况。术后第28天,颞骨组织的切片及染色显示(图2BE),后半规管(图2B,D)和外侧半规管(图2C,E)已被完全阻塞,阻塞部位可见与周围组织走形及密度不同的已经机化的不规则团块状软组织(图2D,E黄色箭头所示),可观察到膜迷路仍然保留(图2D,E蓝色箭头所示)。结果表明,用本研究的手术方法可以使得小鼠外侧半规管和后半规管填塞确切,可能保持膜迷路的完整性。
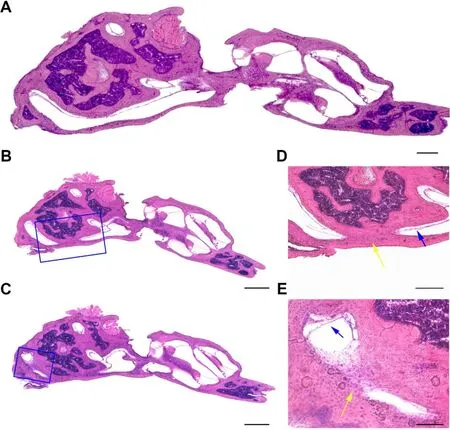
图2 小鼠半规管开窗阻塞后的形态学。A:未经开窗阻塞的正常半规管形态;B,D:阻塞后的后半规管形态;C,E:阻塞后的外侧半规管形态(黄色箭头所示为填塞位置与周围组织走形和密度不同的已经机化的不规则团块状软组织、蓝色箭头所示为保持完整的膜迷路)。A、B、C标尺为200μm;D、E标尺为100μm。Fig.2 Morphology of mouse semicircular canal after fenestra-tion and occlusion.A:normal semicircular canal shape with-out occlusion;B,D:posterior semicircular canal shape after occlusion;C,E:lateral semicircular canal shape after packing.(The yellow arrow shows the location of the occlusion and the irregular mass of soft tissue that is different from the surround-ing tissue in shape and density,and the blue arrow shows the intact membrane labyrinth.)Bars in A,B and C:200μm;bars in D,E:100μm.
2.2 经半规管开窗注射后的庆大霉素分布
为了探究半规管给药能否成功将药物送达前庭和耳蜗。本研究采用Texas Red耦合庆大霉素(AGTR)作为药物示踪方式,来观察经示踪剂耦合的庆大霉素(本实验中的庆大霉素浓度几乎不造成毛细胞丢失)通过后半规管注射后,在内耳中的分布情况,以及被前庭感受器及耳蜗细胞摄取的情况。AGTR注射进入后半规管30min后,我们立即进行了颞骨组织的取材,进行激光共聚焦显微镜拍摄观察,结果如图3所示。我们发现,此时,荧光剂已充满了整个内耳(图3A,B)。我们又分离出了椭圆囊、壶腹和耳蜗基底膜进行观察,在前庭感受器中的椭圆囊和壶腹上的毛细胞均清晰检测到了荧光(图3C),同时,发现耳蜗基底膜也有荧光的摄取,即使在顶转中也检测到了荧光(图3D),且高亮的区域与毛细胞和纤毛的位置相匹配(图3E)。我们保留了两只小鼠进行前庭感觉方面的观察,与2.1半规管阻塞实验结果中不同的是,在术后第1天、第3天均观察到了打转、头偏和步态不稳的情况,术后第7天上述现象消失。结果显示,庆大霉素在经小鼠后半规管注射30min后,即可导入并灌注整个内耳,可成功到达前庭、耳蜗,尤其是可以被耳蜗顶转的毛细胞摄取。

图3 后半规管开窗并注射AGTR 30min后的荧光分布和免疫荧光染色。A,B:充满红色荧光的内耳组织及其明场中所见;C:AGTR被椭圆囊及壶腹毛细胞摄取;D,E:AGTR被耳蜗基膜中的细胞和组织摄取(图为基底膜顶转),高亮区基本与毛细胞和纤毛匹配。图中红色代表AGTR,绿色代表鬼笔环肽(Phalloidin)染色的F肌动蛋白、纤毛,蓝色代表DAPI染色的细胞核。A、B的标尺为2mm;C的标尺为100μm;D、E的标尺为25μm。Fig.3 Fluorescence distribution and immunofluorescent staining after fenestration and injection with AGTR of the pos-terior semicircular canal for 30 min.A,B:Inner ear filled with red fluorescence and its view in bright field;C:AGTR is taken up by the hair cells in the utricle and ampulla;D,E:AG-TR is taken up by cells and tissues in the cochlear basement membrane(the image shows the apex),the highlighted area basically matches with hair cells and cilia.Red:AGTR;green:Phalloidin;blue:DAPI.Bars in A,B:2mm;bars in C:100μm;bars in D,E:25μm.
3 讨论
随着近年来对内耳疾病的深入研究,经半规管开窗的手术操作也被重新认识并应用。经半规管开窗的相关技术,可用于耳科学中许多相关的临床和基础研究。进行半规管开窗主要有两个目的:内耳给药或行半规管阻塞[15,16]。
在耳科学基础研究中,常见的使药物到达内耳的动物给药方式有三种:全身给药,经圆窗膜给药以及经半规管开窗给药。全身给药常常有着难以避免的全身性副作用。经圆窗膜给药及病毒辅助的基因转导效率相对较低,有效的药物剂量及基因转导仅在耳蜗底部的毛细胞有效,且导入剂量不能准确控制[17],另外,小鼠的耳蜗底部常有镫骨动脉走行穿过镫骨,为圆窗给药操作带来额外的困难。而经半规管开窗给药相比前两者,有着给药剂量可控的优势,同一个体可进行多次手术给药[14]。同时,无需通过血迷路屏障,可避免药物经全身代谢后代谢产物的作用和影响。且半规管开窗给药有保留耳蜗功能和听力的优势[12],对耳蜗和前庭的损伤较小[14,17]。因此,经半规管开窗给药逐渐流行,主要用来导入药物或者进行基因转导,进行多种模型的建立,以满足不同的实验需求。同时,对此技术最大的期待和展望,是其作为一种基因转导路径,在内耳基因转导实验中的应用。有国内研究团队经小鼠半规管开窗进行基因转导,成功在前庭和内耳毛细胞表达了GFP[14];他们还通过半规管开窗给药的方式进行了多种实验模型的建立和研究[14,18-21]。
豚鼠由于其半规管体积相对较大,操作更方便的特点,曾一度成为了用于此类手术造模的主流实验动物[10]。而小鼠与豚鼠相比,有着繁殖速度快,饲养简单,且人们对其基因组遗传背景了解更加透彻,基因突变更加容易追踪的优势,同时,人类的许多遗传性内耳疾病已有了与之匹配的同源基因小鼠模型。除了其内耳结构体积小,对术者操作要求更高之外,显然是一个理想的半规管开窗相关模型的实验动物选择。我们的实验中,用示踪剂的方法直观地展示了药物在小鼠半规管给药后的分布情况,结果显示注射荧光示踪剂耦合的庆大霉素30min后,整个前庭和耳蜗即充满了荧光,因此,我们的实验证实了通过小鼠半规管开窗导入进行内耳给药的方法是确切可行的,其高效性更是显而易见的,且证实了此方法相较于圆窗给药作用的范围更广,药物可到达蜗顶。
虽然半规管开窗后阻塞技术对前庭周围性眩晕非常有效[4,5],但有文献指出有临床患者在接受此手术后出现了听力下降[5],原因和机制尚不明确[22]。我国最新的梅尼埃病诊疗指南中,主要将半规管阻塞手术用于四期患者[23]。可见由于此手术可能造成听力下降,因此在临床中的应用受限。在动物实验中,半规管开窗后阻塞的模型常用来研究两个方面的问题:一是半规管阻塞后对听觉系统的影响及其机制;二是研究半规管填塞后是否会带来内、外淋巴液环境的变化。有学者猜想过去的实验中之所以不能明确半规管开窗阻塞手术是否影响听力,可能在于手术过程复杂,手术所致的膜迷路损坏、淋巴液丢失等,使淋巴液环境变化超出了代偿能力,影响听力。也可能是某些术中出血进入了淋巴循环成为损害因素[9]。因此,我们尝试从手术时长统一、手术步骤统一(钻孔大小基本一致、尽量保持膜迷路完整),以及半规管形态学评估阻塞的确切性三个维度,来确保建立小鼠半规管阻塞模型的可靠性、可重复性和稳定性。在技术上,我们选用了不同的材料进行尝试,经筛选发现针对小鼠细小的半规管,蒸发掉部分水分的肌肉和筋膜填塞是最有效的。我们在切片中也观察到了阻塞部位发生的软组织增生,这种增生的团块状组织不规则,且密度和组织走形特点与周围正常的呈线性结构的迷路不同,但我们没有观察到骨质增生和纤维化,我们猜想可能是由于肌肉填塞的操作创伤小,没有对骨壁造成非常大的刺激和损伤。此模型为在今后实验动物层面进行半规管阻塞后内耳病理生理学改变的相关研究提供新的实验模型参考。
本研究中,我们观察到单耳半规管阻塞的小鼠和单耳半规管造口并给药的小鼠在前庭功能上表现不同。后者出现了短暂的前庭功能障碍,与文献报道也不一致[21]。出现上述不同表现,可能是由于实验过程中,外淋巴液丢失程度不同,内、外淋巴液环境压力变化不同,也可能是药物的一过性影响。但这一设想还有待进一步实验探究。我们用小鼠作为实验动物,其优势虽然明显,但我们发现,小鼠的上半规管嵌于颅骨下方的切迹,通过手术钝性分离组织的方法无法暴露,除非破坏颅骨结构。因此,我们认为,小鼠成为上半规管手术的实验动物有其局限性。
综上所述,我们探究了两种经半规管开窗技术的小鼠模型建立方法:经半规管开窗阻塞模型和经半规管开窗注药模型。本研究结果表明,经小鼠半规管开窗进行相关造模在技术上是可行的,具有一定的可靠性、稳定性和可重复性,同时相较于其他的造模方式有着很多优势,这为今后进行相关内耳生理、病理学研究,耳毒性药物相关研究以及内耳病基因治疗等研究的动物模型建立提供了新的选择和技术参考。
