忍冬叶化学成分及其保肝活性研究
2022-04-19李丽丽于金倩
王 凯,刘 双,李 蒙,李丽丽,于金倩,王 晓*
忍冬叶化学成分及其保肝活性研究
王 凯1, 2,刘 双2,李 蒙2,李丽丽2,于金倩2,王 晓2*
1. 山东中医药大学药学院,山东 济南 250300 2. 齐鲁工业大学(山东省科学院)山东省分析测试中心 山东省大型精密仪器应用技术重点实验室,山东 济南 250014
研究忍冬叶化学成分及其保肝活性。采用硅胶柱色谱、反相C18柱色谱、Sephadex LH-20柱色谱、半制备型高效液相色谱等方法进行分离与纯化,并根据理化性质和波谱学数据分析鉴定化合物结构;利用体外肝细胞损伤模型,采用MTT法检测化合物单体抵抗对乙酰氨基酚(APAP)诱导的人肝癌HepG2细胞损伤的作用。从忍冬叶醇提物中分离得到19个化合物,分别鉴定为断氧化马钱苷酸(1)、8-表番木鳖酸(2)、马钱苷酸(3)、咖啡酸(4)、绿原酸(5)、隐绿原酸(6)、新绿原酸(7)、6′--β--呋喃芹糖基獐牙菜苷(8)、demethylsecologanol(9)、獐牙菜苷(10)、断马钱子苷半缩醛内酯(11)、表断马钱子苷半缩醛内酯(12)、木犀草素-7--β--葡萄糖苷(13)、异绿原酸A(14)、异绿原酸B(15)、木犀草苷(16)、木犀草素-7--[α--吡喃阿拉伯糖基-(1→6)]-β--吡喃葡萄糖苷(17)、木犀草素-7--木糖(18)、忍冬苷(19);其中化合物2~11、1~15、17具有较好的抗APAP肝损伤作用。化合物1、2、8、11、12、18均首次从忍冬叶中分离得到,其中化合物18首次从忍冬植物中分离得到,化合物2~11、13~15、17具有明显的保肝活性。
忍冬叶;保肝活性;断氧化马钱苷酸;8-表番木鳖酸;6′--β--呋喃芹糖基獐牙菜苷;断马钱子苷半缩醛内酯
忍冬Thunb.为忍冬科(Caprifoliaceae)忍冬属Linn. 多年生半常绿缠绕灌木,是一种具有悠久历史的常用中药,其花、茎、叶均可入药[1]。忍冬资源丰富,在全国各地均有分布,主产区主要有山东、河南、河北等地区。其入药可追溯到梁代,始载于陶弘景《本草经集注》,“今处处皆有,似藤生,凌冬不凋,故名忍冬”“十二月采,阴干”,说明在古代忍冬药用部位为茎、叶。现代研究表明忍冬叶中含有黄酮类、有机酸、环烯醚萜类、挥发油等化学成分。药理活性实验发现其具有抗病原微生物、保肝、消炎、抗氧化、降调血脂等作用[2]。忍冬叶作为中药金银花的副产品,产量是花的10倍左右[3],具有很好的潜在开发利用价值。
为使忍冬非药用部位价值最大化,发现新药源,本研究对忍冬叶醇提物的化学成分进行系统性研究,从中分离得到19个化合物,分别鉴定为断氧化马钱苷酸(secologanoside,1)、8-表番木鳖酸(8-epiloganic acid,2)、马钱苷酸(loganic acid,3)、咖啡酸(caffeic acid,4)、绿原酸(chlorogenic acid,5)、隐绿原酸(cryptochlorogenic acid,6)、新绿原酸(neochlorogenic acid,7)、6′--β--呋喃芹糖基獐牙菜苷(6′--β--apiofuranosyl sweroside,8)、demethylsecologanol(9)、獐牙菜苷(sweroside,10)、断马钱子苷半缩醛内酯(vogeloside,11)、表断马钱子苷半缩醛内酯(-vogeloside,12)、木犀草素- 7--β--葡萄糖苷(luteolin-7--β--glucoside,13)、异绿原酸A(isochlorogenic acid A,14)、异绿原酸B(isochlorogenic acid B,15)、木犀草苷(cynaroside,16)、木犀草素-7--[α--吡喃阿拉伯糖基- (1→6)]-β--吡喃葡萄糖苷(luteolin-7--[α-- pyranafinosyl-(1→6)]-β--glucopyranoside,17)、木犀草素-7--木糖(luteolin-7--xyloside,18)、忍冬苷(lonicerin,19)。化合物1、2、8、11、12、18均首次从忍冬叶中分离得到,其中化合物18首次从忍冬植物中分离得到。化合物2~11、13~15、17具有明显的保肝活性。
1 仪器与材料
Waters 2695高效液相色谱仪(美国Waters公司);Bruker-400核磁共振波谱仪(瑞士Bruker公司);EYELA N-1200A型旋转蒸发器(日本东京理化);半制备HPLC分析仪器为岛津LC-20A(日本岛津公司);普源L-3000型色谱仪(北京普源精电科技有限公司);AB-8大孔树脂(天津南开和成科技有限公司);薄层硅胶GF254、柱色谱硅胶(200~300目)(青岛海洋化工厂);HPLC用甲醇、乙腈为色谱纯(天津市康科德科技有限公司),其余试剂均为分析纯;HF90二氧化碳培养箱(上海力升科学仪器);Nikon Eclipse Ts 2倒置显微镜;LDZM立式压力蒸汽灭菌锅(上海申安医疗器械厂);Spark多功能酶标仪(瑞士Tecan公司);湘仪离心机(湖南湘仪实验室仪器开发有限公司);RPMI-1640培养基(武汉赛维尔生物科技有限公司);青链霉素混合液、PBS、MTT、胰酶(索莱宝生物科技有限公司);对乙酰氨基酚(paracetamol,APAP)、双环醇(中国食品药品检定研究院);人肝癌HepG2细胞(中国协和医科大学细胞中心)。
忍冬叶药材采集自山东省平邑县流峪镇,经山东中医药大学李佳教授鉴定为忍冬科忍冬属植物忍冬Thunb.的干燥叶。
2 提取与分离
干燥的忍冬叶30 kg,粉碎后过筛,用30%乙醇渗漉提取,提取液减压浓缩至无醇味膏状物,得到浸膏3 kg。随后采用AB-8大孔树脂柱色谱进行分离,以不同梯度乙醇(0、20%、40%、60%、80%、95%)进行洗脱,得到6个部位(Fr. 1~6)。
选取水部位Fr. 1(1 kg)经硅胶柱色谱,以二氯甲烷-甲醇(15∶1、10∶1、5∶1、1∶1)进行梯度洗脱,得到4个部位(Fr. 1-1~1-4),Fr. 1-4(200 g)经中压-Flash液相以甲醇-水(15%、20%、25%、30%、35%、100%)进行洗脱,经高效液相色谱分析检测合并得到6个组分(Fr. 1-4-1~1-4-6),Fr. 1-4-4即是化合物1(0.4 g);Fr. 1-4-2经半制备高效液相色谱仪(乙腈-0.1%甲酸水9∶91)得到化合物2(20 mg)、3(23 mg)、4(30 mg)、5(120 mg)、6(40 mg);Fr. 1-4-1经半制备高效液相色谱(乙腈- 0.1%甲酸水8∶92),得到化合物7(11 mg);Fr. 1-4-5经半制备HPLC(乙腈-0.1%甲酸水10∶90)得到化合物8(21 mg);Fr. 1-4-3经半制备HPLC(乙腈-0.1%甲酸水10∶90)得到化合物9(34 mg)、10(52 mg)。
将大孔树脂40%乙醇部位Fr. 3(90 g)过中压C18色谱柱,用甲醇-水(10%、20%、30%、35%、40%、50%、60%、100%)进行洗脱,经分析检测合并得到8个组分(Fr. 3-1~3-8),其中Fr. 3-1采用普源L-3000液相色谱仪(乙腈-0.1%甲酸水14∶86)分离,得到化合物11(10 mg)、12(2 mg);将Fr. 3-4(3.3 g)溶解后过凝胶柱,以80%甲醇等度洗脱,得到5个组分(Fr. 3-4-1~3-4-5)。将Fr. 3-4-3、Fr. 3-4-4、Fr. 3-4-5分别浓缩,即得化合物13(105 mg)、14(44 mg)、15(16 mg);将Fr. 3-4-2经过半制备HPLC(乙腈-0.1%甲酸水15∶85),得到化合物16(25 mg);采用普源L-3000液相色谱仪(乙腈-0.1%甲酸水16∶84)对Fr. 3-4-1进行细分,得到化合物17(21 mg)、18(43 mg)、19(22 mg)。
3 结构鉴定
化合物1:淡黄色粉末。ESI-MS/: 413.3 [M+Na]+,C16H22O11Na。1H-NMR (400 MHz, DMSO-6): 7.40 (1H, brs, H-3), 5.54 (1H, m, H-8), 5.37 (1H, d,= 4.0 Hz, H-1), 5.21 (1H, d,= 16.0 Hz, H-10a), 5.20 (1H, d,= 12.0 Hz, H-10b), 4.50 (1H, d,= 7.6 Hz, H-1′), 3.43 (1H, m, H-5), 2.90~3.70 (6H, m, H-2′~6′), 2.93 (1H, m, H-9), 2.71 (1H, m, H-6), 2.09 (1H, m, H-6);13C-NMR (100 MHz, DMSO-6): 173.7 (C-7), 168.1 (C-11), 151.9 (C-3), 134.0 (C-8), 120.2 (C-10), 109.2 (C-4), 99.0 (C-1′), 95.8 (C-1), 77.7 (C-3′), 77.2 (C-5′), 73.5 (C-2′), 70.4 (C-4′), 61.5 (C-6′), 43.5 (C-9), 34.0 (C-6), 27.3 (C-5)。以上数据与文献报道基本一致[4],故鉴定化合物1为断氧化马钱苷酸。
化合物2:淡黄色粉末。ESI-MS/: 377.4 [M+H]+,C16H25O10。1H-NMR (400 MHz, DMSO-6): 7.27 (1H, s, H-3), 5.36 (1H, d,= 4.0 Hz, H-1), 4.48 (1H, d,= 7.6 Hz, H-1′), 3.67 (1H, m, H-6′a), 3.43 (1H, m, H-6′b), 2.85 (1H, m, H-5), 2.39 (1H, m, H-8), 1.99 (1H, m, H-9), 1.89 (1H, m, H-6a), 1.69 (1H, m, H-6b), 0.94 (3H, d,= 7.2 Hz, H-10);13C-NMR (100 MHz, DMSO-6): 168.7 (C=O), 150.3 (C-3), 113.5 (C-4), 98.6 (C-1′), 94.6 (C-1), 77.7 (C-5′), 77.3 (C-3′), 77.2 (C-7), 73.6 (C-2′), 70.6 (C-4′), 61.8 (C-6′), 44.0 (C-9), 41.6 (C-8), 40.1 (C-6), 30.2 (C-5), 14.4 (C-10)。以上数据与文献报道基本一致[5],故鉴定化合物2为8-表番木鳖酸。
化合物3:浅黄色粉末。ESI-MS/: 377.4 [M+H]+,C16H25O10。1H-NMR (400 MHz, DMSO-6): 7.30 (1H, s, H-3), 5.09 (1H, d,= 5.2 Hz, H-1), 4.48 (1H, d,= 7.6 Hz, H-1′), 3.43 (1H, dd,= 6.4, 12.0 Hz, H-7), 2.06 (1H, m, H-9), 1.81 (1H, m, H-6a), 1.72 (1H, m, H-6b), 1.45 (1H, m, H-8), 0.99 (1H, s, H-10);13C-NMR (100 MHz, DMSO-6): 166.4 (C=O), 148.4 (C-3), 111.0 (C-4), 96.9 (C-1′), 94.4 (C-1), 75.6 (C-3′), 75.1 (C-5′), 71.5 (C-7), 70.5 (C-2′), 68.5 (C-4′), 59.5 (C-6′), 43.1 (C-9), 40.1 (C-6), 38.9 (C-8), 29.3 (C-5), 11.9 (C-10)。以上数据与文献报道基本一致[6],故鉴定化合物3为马钱苷酸。
化合物4:黄色粉末。ESI-MS/: 181.2 [M+H]+,C9H9O4。1H-NMR (400 MHz, DMSO-6): 9.49 (1H, s, H-9), 7.44 (1H, d,= 16.0 Hz, H-7), 7.06 (1H, s, H-2), 6.98 (1H, d,= 8.0 Hz, H-6), 6.78 (1H, d,= 8.0 Hz, H-5), 6.20 (1H, d,= 16.0 Hz, H-8);13C-NMR (100 MHz, DMSO-6): 168.4 (C-9), 148.6 (C-4), 146.0 (C-3), 145.0 (C-7), 126.2 (C-1), 121.6 (C-6), 116.2 (C-8), 115.6 (C-5), 115.1 (C-2)。以上数据与文献报道基本一致[7],故鉴定化合物4为咖啡酸。
化合物5:淡黄色粉末。ESI-MS/: 353.3 [M-H]−,C16H17O9。1H-NMR (400 MHz, DMSO-6): 9.61 (2H, brs, 3′, 4′-OH), 7.43 (1H, d,= 16.0 Hz, H-7′), 7.04 (1H, d,= 2.2 Hz, H-2′), 6.99 (1H, dd,= 2.2, 8.4 Hz, H-6′), 6.77 (1H , d,= 8.4 Hz, H-5′), 6.16 (1H, brs, H-8′), 4.94 (1H, m, H-3), 3.93 (1H, m, H-4), 3.57 (1H, m, H-5), 2.03~1.79 (2H, m, H-2, 6);13C-NMR (100 MHz, DMSO-6): 175.4 (C=O), 166.2 (C-9′), 148.8 (C-4′), 146.0 (C-7′), 145.4 (C-3′), 126.1 (C-1′), 121.8 (C-6′), 116.2 (C-2′), 115.2 (C-8′), 114.8 (C-5′), 73.9 (C-1), 71.3 (C-3), 70.9 (C-4), 68.5 (C-5), 37.7 (C-6), 36.7 (C-2)。以上数据与文献报道基本一致[8],故鉴定化合物5为绿原酸。
化合物6:淡黄色粉末。ESI-MS/: 377.3 [M+Na]+,C16H18O9Na。1H-NMR (400 MHz, DMSO-6): 7.51 (1H, d,= 16.0 Hz, H-7′), 7.05 (1H, s, H-2′), 7.01 (1H, d,= 8.0 Hz, H-6′), 6.78 (1H, d,= 8.0 Hz, H-5′), 6.28 (1H, d,= 16.0 Hz, H-8′), 4.77 (1H, d,= 6.0 Hz, H-4), 4.10 (1H, m, H-5), 4.01 (1H, m, H-3), 1.92~2.04 (4H, m, H-2, 6);13C-NMR (100 MHz, DMSO-6): 175.9 (C=O), 166.8 (C-9′), 148.8 (C-4′), 146.0 (C-7′), 145.3 (C-3′), 126.1 (C-1′), 121.7 (C-6′), 116.3 (C-5′), 115.2 (C-2′), 115.1 (C-8′), 77.4 (C-4), 74.6 (C-1), 67.0 (C-5), 64.4 (C-3), 41.2 (C-2), 38.2 (C-6)。以上数据与文献报道基本一致[9],故鉴定化合物6为隐绿原酸。
化合物7:白色粉末。ESI-MS/: 377.3 [M+Na]+,C16H18O9Na。1H-NMR (400 MHz, DMSO-6): 7.47 (1H, d,= 16.0 Hz, H-7′), 7.03 (1H, d,= 4.0 Hz, H-2′), 6.98 (1H, dd,= 8.0, 4.0 Hz, H-6′), 6.77 (1H, d,= 8.0 Hz, H-5′), 6.21 (1H, d,= 16.0 Hz, H-8′), 5.18 (1H, m, H-5), 4.90 (1H, s, H-3), 3.87 (1H, m, H-4), 1.93~2.19 (4H, m, H-2, 6);13C-NMR (100 MHz, DMSO-6): 176.5 (C=O), 166.5 (C-9′), 148.6 (C-4′), 146.0 (C-7′), 144.9 (C-3′), 126.2 (C-1′), 121.5 (C-6′), 116.3 (C-5′), 115.5 (C-8′), 115.1 (C-2′), 73.4 (C-1), 71.7 (C-5), 71.4 (C-4), 67.7 (C-3), 40.4(C-2), 35.6 (C-6)。以上数据与文献报道基本一致[10],故鉴定化合物7为新绿原酸。
化合物8:浅黄色粉末。ESI-MS/: 513.5 [M+Na]+,C21H30O13Na。1H-NMR (400 MHz, DMSO-6): 7.39 (1H, s, H-3), 5.69 (1H, m, H-8), 5.33 (1H, d,= 8.0 Hz, H-1), 5.20 (1H, d,= 16.0 Hz, H-10), 4.52 (1H, d,= 8.0 Hz, H-1′), 4.03 (1H, d,= 4.0 Hz, H-1′′), 2.96~3.70 (13H, m, H2-7, H-2′~H2-6′, H-2′′, 4′′, 5′′), 2.67 (1H, m, H-5), 2.45 (1H, m, H-9), 1.94 (1H, m, H-6a), 1.61 (1H, m, H-6b);13C-NMR (100 MHz, DMSO-6): 168.6 (C-11), 151.5 (C-3), 135.3 (C-8), 119.2 (C-10), 113.0 (C-1′′), 103.7 (C-4), 99.1 (C-1′), 96.0 (C-1), 77.7 (C-3′′), 77.1 (C-2′′), 73.5 (C-3′), 73.0 (C-5′), 71.0 (C-4′′), 70.5 (C-2′), 68.0 (C-7), 67.5 (C-4′), 65.6 (C-6′), 61.6 (C-5′′), 43.7 (C-9), 30.3 (C-5), 30.1 (C-6)。以上数据与文献报道基本一致[11],故鉴定化合物8为6′--β--呋喃芹糖基獐牙菜苷。
化合物9:白色粉末。ESI-MS/: 377.1 [M+H]+,C16H25O10。1H-NMR (400 MHz, DMSO-6): 7.44 (1H, s, H-3), 5.76 (2H, m, H-1, 8), 5.50 (1H, d,= 2.0 Hz, H-10a), 5.25 (1H, d,= 2.0 Hz, H-10b), 4.67 (1H, d,= 8.0 Hz, H-1′), 3.55 (2H, m, H-7a, 7b), 2.60 (1H, m, H-9), 1.82 (1H, m, H-6a), 1.71 (1H, m, H-6b);13C-NMR (100 MHz, DMSO-6): 170.1 (C-11), 151.8 (C-3), 134.6 (C-8), 117.7 (C-10), 104.6 (C-4), 98.7 (C-1′), 96.2 (C-1), 76.9 (C-5′), 76.5 (C-3′), 73.2 (C-2′), 70.1 (C-4′), 68.3 (C-6′), 59.7 (C-7), 42.4 (C-9), 27.0 (C-6), 24.5 (C-5)。以上数据与文献报道基本一致[12],故鉴定化合物9为demethylsecologanol。
化合物10:浅黄色粉末。ESI-MS/: 359.3 [M+H]+,C16H23O9。1H-NMR (400 MHz, DMSO-6): 7.49 (1H, s, H-3), 4.51 (1H, d,= 5.2 Hz, H-1′);13C-NMR (100 MHz, DMSO-6): 165.1 (C-11), 151.9 (C-3), 132.8 (C-8), 120.7 (C-10), 105.3 (C-4), 96.0 (C-1), 98.5 (C-1′), 77.8 (C-3′), 76.8 (C-5′), 73.6 (C-2′), 70.5 (C-4′), 68.1 (C-7), 61.5 (C-6′), 41.9 (C-9), 27.2 (C-5), 24.7 (C-6)。以上数据与文献报道基本一致[13],故鉴定化合物10为獐牙菜苷。
化合物11:浅灰色粉末。ESI-MS/: 389.4 [M+H]+,C17H25O10。1H-NMR (400 MHz, DMSO-6): 7.53 (1H, d,= 2.4 Hz, H-3), 5.41 (2H, overlapped, H-1, 8), 5.34 (1H, m, H-7), 5.27 (1H, m, H-10a), 5.24 (1H, m, H-10b), 4.52 (1H, d,= 8.0 Hz, H-1′), 3.01 (1H, m, H-5), 2.87~3.17 (6H, m, H-5, 2′~6′), 2.64 (1H, m, H-9), 2.00 (1H, m, H-6a), 1.28 (1H, m, H-6b);13C-NMR (100 MHz, DMSO-6): 164.5 (C-11), 152.7 (C-3), 132.7 (C-8), 121.0 (C-10), 104.3 (C-4), 98.5 (C-7), 99.2 (C-1′), 96.7 (C-1), 77.8 (C-5′), 77.2 (C-3′), 73.6 (C-2′), 70.5 (C-4′), 61.5 (C-6′), 56.5 (OCH3), 41.8 (C-9), 30.4 (C-6), 24.0 (C-5)。以上数据与文献报道基本一致[14],故鉴定化合物11为断马钱子苷半缩醛内酯。
化合物12:黄色粉末。ESI-MS/: 389.4 [M+H]+,C17H25O10。1H-NMR (400 MHz, DMSO-6): 7.51 (1H, d,= 2.4 Hz, H-3), 5.52 (2H, m, H-l, 8), 5.32 (1H, m, H-7), 4.52 (1H, d,= 8.0 Hz, H-1′), 2.85~3.70 (6H, m, H-5, 2′~6′);13C-NMR (100 MHz, DMSO-6): 164.2 (C-11), 152.2 (C-3), 132.5 (C-8), 121.0 (C-10), 104.3 (C-4), 101.5 (C-1′), 99.2 (C-7), 96.0 (C-1), 77.8 (C-5′), 76.8 (C-3′), 73.5 (C-2′), 70.4 (C-4′), 61.4 (C-6′), 56.5 (OCH3), 41.7 (C-9), 28.9 (C-6), 21.8 (C-5)。以上数据与文献报道基本一致[14],故鉴定化合物12为表断马钱子苷半缩醛内酯。
化合物13:浅黄色粉末。ESI-MS/: 463.4 [M+H]+,C21H19O11。1H-NMR (400 MHz, DMSO-6): 7.46 (1H, m, H-2), 7.43 (1H, d,= 4.0 Hz, H-6′), 6.92 (1H, d,= 8.0 Hz, H-5), 6.80 (1H, d,= 2.0 Hz, H-8), 6.76 (1H, s, H-3), 6.46 (1H, d,= 2.0 Hz, H-6), 5.10 (1H, d,= 4.4 Hz, H-1′′);13C-NMR (100 MHz, DMSO-6): 182.3 (C-4), 164.9 (C-2), 163.4 (C-7), 161.6 (C-5), 157.4 (C-9), 150.4 (C-4′), 146.2 (C-3′), 121.9 (C-1′), 119.6 (C-6′), 116.4 (C-5'), 114.0 (C-2′), 105.8 (C-10), 103.6 (C-3), 100.4 (C-1′′), 100.0 (C-6), 95.2 (C-8), 77.6 (C-3′′), 76.9 (C-5′′), 73.6 (C-2′′), 70.0 (C-4′′), 61.1 (C-6′′)。以上数据与文献报道基本一致[15],故鉴定化合物13为木犀草素-7--β--葡萄糖苷。
化合物14:浅绿色粉末。ESI-MS/: 517.5 [M+H]+,C25H25O12。1H-NMR (400 MHz, DMSO-6): 7.53 (1H, d,= 16.0 Hz, H-7′), 7.47 (1H, d,= 16.0 Hz, H-7′′), 7.01 (1H, d,= 8.0 Hz, H-2′′), 7.01 (1H, d,= 8.0 Hz, H-6′), 7.01 (1H, d,= 8.0 Hz, H-6′′), 6.80 (1H, d,= 16.0 Hz, H-5′), 6.80 (1H, d,= 16.0 Hz, H-5′′), 6.28 (1H, d,= 16.0 Hz, H-8′), 6.21 (1H, d,= 16.0 Hz, H-8′′), 5.20 (2H, overlapped, H-3, 5), 3.85 (1H, m H-4), 1.98~2.15 (4H, m, H-2, 6);13C-NMR (100 MHz, DMSO-6): 176.2 (C-7), 166.6 (C-9′′), 166.2 (C-9′), 148.9 (C-4′′), 148.7 (C-4′), 146.1 (C-7′′), 146.0 (C-7′), 145.6 (C-3′′), 145.2 (C-3′), 126.1 (C-1′′), 126.0 (C-1′), 121.9 (C-6′′), 121.7 (C-6′), 116.3 (C-5′′), 116.2 (C-5′), 115.2 (C-2′′), 115.1 (C-2′), 114.6 (C-8′′), 114.1 (C-8′), 73.1 (C-1), 71.4 (C-5), 70.4 (C-3), 68.4 (C-4), 36.7 (C-6), 35.3 (C-2)。以上数据与文献报道基本一致[16],故鉴定化合物14为异绿原酸A。
化合物15:黄色粉末。ESI-MS/: 517.5 [M+H]+,C25H25O12。1H-NMR (400 MHz, DMSO-6): 7.51 (1H, d,= 16.0 Hz, H-7′), 7.45 (1H, d,= 16.0 Hz, H-7′′), 7.05 (1H, d,= 1.8 Hz, H-2′), 7.04 (1H, d,= 1.8 Hz, H-2′′), 6.99 (1H, dd,= 2.0, 8.0 Hz, H-6′), 6.98 (1H, dd,= 2.0, 8.0 Hz, H-6′′), 6.77 (1H, d,= 8.2 Hz, H-5′), 6.76 (1H, d,= 8.2 Hz, H-5′′), 6.27 (1H, d,= 16.0 Hz, H-8′), 6.18 (1H, d,= 16.0 Hz, H-8′′), 5.40 (1H, m, H-3), 4.99 (1H, s, H-4), 4.21 (1H, s, H-5), 2.05~2.24 (4H, m, H-2, 6);13C-NMR (100 MHz, DMSO-6): 175.3 (C-7), 166.5 (C-9′), 166.1 (C-9′′), 149.0 (C-4′), 148.9 (C-4′′), 146.0 (C-7′, 7′′), 145.9 (C-3′, 3′′), 125.9 (C-1′, 1′′), 122.0 (C-6′), 121.9 (C-6′′), 116.3 (C-5′), 116.2 (C-5′′), 115.2 (C-2′), 115.1 (C-2′′), 114.3 (C-8′), 114.1 (C-8′′), 74.1 (C-1), 73.9 (C-4), 68.1 (C-3), 66.9 (C-5), 37.9 (C-2), 37.7 (C-6)。以上数据与文献报道基本一致[17],故鉴定化合物15为异绿原酸B。
化合物16:浅黄色粉末。ESI-MS/: 447.4 [M-H]−,C21H19O11。1H-NMR (400 MHz, DMSO-6): 7.45 (1H, d,= 8.0 Hz, H-6′), 6.90 (1H, d,= 8.0 Hz, H-5′), 6.79 (1H, s, H-8), 6.75 (1H, s, H-3), 6.40 (1H, d,= 16.0 Hz, H-6), 5.08 (1H, d,= 8.0 Hz, H-1′′);13C-NMR (100 MHz, DMSO-6): 182.3 (C-4), 165.0 (C-2), 163.4 (C-7), 161.6 (C-9), 157.4 (C-5), 150.8 (C-3′), 146.4 (C-4′), 121.5 (C-6′), 119.7 (C-1′), 116.4 (C-5′), 113.8 (C-2′), 105.8 (C-10), 103.5 (C-3), 100.4 (C-1′′), 100.0 (C-6), 95.2 (C-8), 77.6 (C-5′′), 76.9 (C-3′′), 73.6 (C-2′′), 70.1 (C-4′′), 61.1 (C-6′′)。以上数据与文献报道基本一致[18],故鉴定化合物16为木犀草苷。
化合物17:黄色粉末。ESI-MS/: 581.0 [M+H]+,C26H29O15。1H-NMR (400 MHz, DMSO-6): 7.49 (1H, d,= 8.4 Hz, H-6′), 7.46 (1H, d,= 7.6 Hz, H-2′), 6.92 (1H, d,= 8.4 Hz, H-5′), 6.80 (1H, d,= 1.2 Hz, H-8), 6.75 (1H, s, H-3), 6.46 (1H, d,= 1.2 Hz, H-6), 5.09 (1H, d,= 7.2 Hz, H-1′′), 4.18 (1H, d,= 6.4 Hz, H-1′′′), 3.95 (1H, d,= 10.8 Hz, H-6′′), 3.31~3.76 (8H, m, H-2′′~5′′, 2′′′~5′′′);13C-NMR (100 MHz, DMSO-6): 182.3 (C-4), 165.1 (C-2), 163.3 (C-7), 161.6 (C-5), 157.4 (C-9), 150.7 (C-4′), 146.3 (C-3′), 121.6 (C-1′), 119.7 (C-6′), 116.5 (C-5′), 114.0 (C-2′), 105.9 (C-10), 103.5 (C-3), 103.5 (C-1′′′), 100.3 (C-1′′), 100.1 (C-6), 95.2 (C-8), 76.6 (C-5′′), 76.0 (C-3′′), 73.5 (C-2′′), 72.9 (C-2′′′), 71.0 (C-3′′′), 69.9 (C-4′′), 68.0 (C-6′′), 67.6 (C-4′′′), 65.1 (C-5′′′)。以上数据与文献报道基本一致[19],故鉴定化合物17为木犀草素-7--[α--吡喃阿拉伯糖基-(1→6)]-β--吡喃葡萄糖苷。
化合物18:浅黄色粉末。ESI-MS/: 441.2 [M+Na]+,C20H18O10Na。1H-NMR (400 MHz, DMSO-6): 7.47 (1H, dd,= 8.0, 2.0 Hz, H-6′), 7.45 (1H, d,= 2.0 Hz, H-2′), 6.90 (1H, d,= 8.0 Hz, H-5′), 6.78 (1H, d,= 2.0 Hz, H-8), 6.74 (1H, s, H-3), 6.48 (1H, d,= 2.0 Hz, H-6), 5.06 (1H, d,= 8.0 Hz, H-1′′), 3.25~3.88 (5H, m, H-2′′~5′′);13C-NMR (100 MHz, DMSO-6): 182.3 (C-4), 165.1 (C-2), 163.3 (C-7), 161.7 (C-5), 157.4 (C-9), 151.0 (C-4′), 146.4 (C-3′), 121.4 (C-1′), 119.7 (C-6′), 116.5 (C-5′), 113.9 (C-2′), 105.8 (C-10), 103.4 (C-3), 100.4 (C-6), 100.0 (C-1′′), 95.2 (C-8), 77.0 (C-3′′), 73.8 (C-2′′), 70.0 (C-4′′), 66.1 (C-5′′)。以上数据与文献报道基本一致[20],故鉴定化合物18为木犀草素-7--木糖。
化合物19:黄色粉末。ESI-MS/: 593.5 [M-H]−,C27H29O15。1H-NMR (400 MHz, DMSO-6): 13.17 (1H, s, 5-OH), 7.45 (1H, dd,= 2.0, 8.0 Hz, H-6′), 7.42 (1H, d,= 2.0 Hz, H-2′), 6.92 (1H, d,= 8.4 Hz, H-5′), 6.77 (1H, s, H-3), 6.75 (1H, d,= 2.0 Hz, H-8), 6.38 (1H, d,= 2.0 Hz, H-6), 5.26 (1H, d,= 7.2 Hz, H-1′′), 5.14 (1H, s, H-1′′′), 3.22~3.79 (m, H-2′′~6′′, 2′′′~5′′′), 1.21 (3H, d,= 7.6 Hz, H-6′′′);13C-NMR (100 MHz, DMSO-6): 182.3 (C-4), 165.0 (C-2), 163.0 (C-7), 161.6 (C-5), 157.4 (C-9), 150.5 (C-4′), 146.3 (C-3′), 121.7 (C-1′), 119.6 (C-6′), 116.5 (C-5′), 114.0 (C-2′), 105.9 (C-10), 103.7 (C-3), 100.9 (C-1′′′), 99.8 (C-1′′), 98.2 (C-6), 94.8 (C-8), 77.6 (C-2′′), 77.5 (C-3′′), 76.8 (C-5′′), 72.3 (C-4′′′), 71.0 (C-3′′′), 70.9 (C-2′′′), 70.1 (C-4′′), 68.8 (C-5′′′), 61.0 (C-6′′), 18.6 (C-6′′′)。以上数据与文献报道基本一致[21],故鉴定化合物19为忍冬苷。
4 体外保肝活性评价
4.1 APAP诱导HepG2细胞肝损伤模型的建立
将人肝癌HepG2细胞以2×105个/mL接种于96孔板,每孔100 μL,培养12 h,待细胞完全贴壁后,分别给予1.875、3.75、7.5、15、30 mmol/L浓度的APAP进行造模,对照组不加APAP,每个浓度平行6个复孔,孵育48 h后,每孔加入1 mg/mL的MTT溶液50 μL,继续培养4 h。弃去上清液,每孔加入100 μL DMSO,振荡,使结晶物充分溶解。试验重复进行3次。多功能酶标仪490 nm波长下测定各孔的吸光度()值,并计算细胞存活率,结果见图1。

图1 APAP对HepG2细胞活性的影响
如图1所示,与对照组相比,随着APAP诱导浓度的增加,HepG2细胞存活率逐渐降低。其中7.5 mmol/L的APAP诱导48 h,细胞存活率为50%左右,肝损伤模型通常选用细胞存活半数的浓度进行模型构建。故选用7.5 mmol/L的APAP诱导HepG2细胞48 h作为肝损伤模型并开展后续保肝活性筛选实验。
4.2 保肝活性实验
取96孔细胞培养板,每孔加入浓度为2×105个/mL的细胞悬液100 μL,在37 ℃、5% CO2培养箱中贴壁培养12 h后,吸出原培养液弃去,分对照组、模型组、实验组,对照组加入100 μL新鲜培养基,模型组加入100 μL的含7.5 mmol/L APAP培养基,阳性对照组加入100 μL双环醇(10 μmol/L)的培养基(含7.5 mmol/L APAP),实验组加入100 μL受试药物(10 μmol/L)的培养基(含7.5 mmol/L APAP),每个浓度平行6个复孔。在37 ℃、5% CO2培养箱中培养48 h后,每孔加入1 mg/mL的MTT溶液50 μL,继续培养4 h。弃去上清液,每孔加入100 μL DMSO,振荡,使结晶物充分溶解。多功能酶标仪490 nm处测量各孔的吸光度()值,试验重复进行3次,并按下式计算抑制率[22],结果见图2。
抑制率=(实验-模型)/(对照-模型)
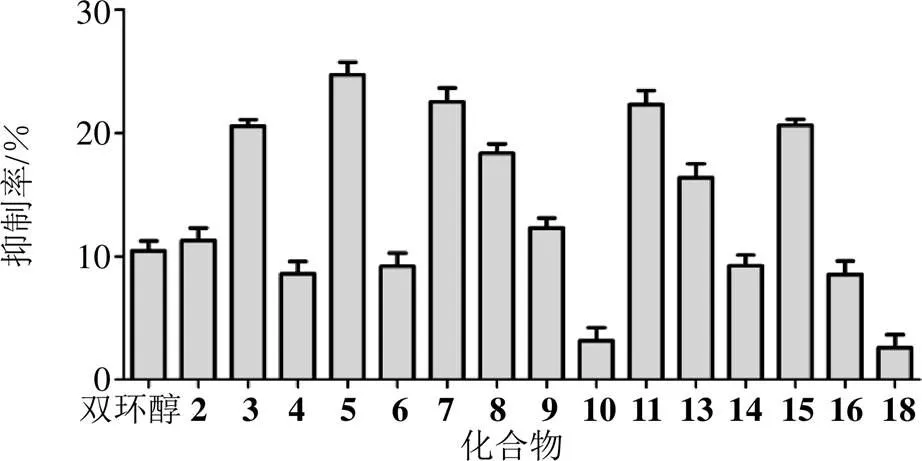
图2 化合物体外保肝活性结果
由图2可知,化合物2~11、13~15、17作用于APAP诱导损伤的HepG2肝细胞,抑制率明显升高,说明具有一定的抵抗APAP引起的肝损伤作用;相较于阳性对照药双环醇,化合物2、3、5、7~9、11、13、15的抑制率均高于10.6%,高于阳性对照组,表明以上化合物的保肝活性要强于阳性对照药。采用GraphPad Prism 5.0软件对所得数据结果进行统计学分析。
5 讨论
忍冬叶和金银花均来源于同一种药用植物忍冬,忍冬叶作为金银花的副产品,古时有“花与叶同功[23]”,在现代研究中也表明了忍冬叶与金银花均含有环烯醚萜类、黄酮类、有机酸、挥发油等化学成分,并且在抗病原微生物、抗炎、抗氧化等药理活性方面具有相似作用[24-25]。据上述可知,忍冬叶有望作为金银花的代用品[26]。
本研究通过忍冬叶化学成分的系统分离,从忍冬叶醇提物中分离得到19个化合物,其中包括6个有机酸类化合物(咖啡酸、绿原酸、隐绿原酸、新绿原酸、异绿原酸A、异绿原酸B)、5个黄酮类化合物(木犀草素-7--β--葡萄糖苷、木犀草苷、木犀草素-7--[α--吡喃阿拉伯糖基-(1→6)]-β--吡喃葡萄糖苷、木犀草素-7--木糖、忍冬苷)、8个环烯醚萜类化合物(断氧化马钱苷酸、8-表番木鳖酸、马钱苷酸、6′--β--呋喃芹糖基獐牙菜苷、demethylsecologanol、獐牙菜苷、断马钱子苷半缩醛内酯、表断马钱子苷半缩醛内酯),其中化合物1、2、8、11、12、18均首次从忍冬叶中分离得到,化合物18首次从忍冬植物中分离得到。
APAP是目前临床使用较为广泛的一种解热镇痛药,经肝脏代谢,过量会造成一定的肝损伤,常用于制备药物性肝损伤模型,来筛选具有保肝活性的药物。本实验通过APAP诱导的HepG2肝细胞损伤模型,利用MTT法对化合物单体进行保肝活性筛选,并选用双环醇为阳性对照药。结果表明,化合物2~11、13~15、17对APAP诱导的HepG2细胞损伤具有一定保护作用,在给药10 μmol/L浓度下,化合物2、3、5、7~9、11、13、15的保肝活性强于阳性对照药,而其他化合物未显示出明显的保肝活性。本研究通过对忍冬叶的化学成分和保肝活性的研究,进一步明确忍冬叶保肝活性的药效物质基础,为忍冬叶开发提供一定的理论依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 纪瑞锋, 刘素香, 王文倩, 等. 忍冬属植物环烯醚萜类成分研究概况 [J]. 中草药, 2012, 43(6): 1226-1232.
[2] 陈玲, 张海艳, 李晓, 等. 忍冬的化学成分研究进展 [J]. 现代药物与临床, 2015, 30(1): 108-114.
[3] 朱姮, 陈静娴, 文蕾, 等. 忍冬叶化学成分的研究进展 [J]. 山东科学, 2016, 29(6): 30-39.
[4] 贺兰云, 黄海疆. 绣球化学成分研究 [J]. 中国当代医药, 2014, 21(22): 59-61.
[5] 廖立平, 张紫佳, 胡之璧, 等. 大花胡麻草环烯醚萜苷类化学成分研究 [J]. 中草药, 2012, 43(12): 2369-2371.
[6] 王云卿, 马国需, 梁琼平, 等. 瑶药“肿瘤藤”(星毛冠盖藤)的化学成分研究 [J]. 中草药, 2016, 47(24): 4326-4330.
[7] Wang Z P, Zhu H, Sun C L,. Separation and purification of six compounds from the flowers of(Matsum.) by high-speed countercurrent chromatography in stepwise elution mode [J]., 2016, 39(11): 532-537.
[8] 龙泽海, 王琦瑶, 李波, 等. 密蒙花中的1个新的环烯醚萜苷类化合物[J]. 中草药, 2021, 52(1): 35-44.
[9] 周岳, 曾婷, 李丽梅. 光叶丁公藤酚性成分研究 [J]. 中草药, 2016, 47(9): 1496-1500.
[10] 赫军, 马秉智, 王晓雪, 等. 藤梨根的化学成分研究(II) [J]. 中国药学杂志, 2015, 50(22): 1960-1963.
[11] 王广树, 周小平, 崔晶, 等. 长白忍冬花蕾中环烯醚萜类成分的研究 [J]. 中国药物化学杂志, 2009, 19(3): 206-208.
[12] Kitajima M, Fujii N, Yoshino F,. Camptothecins and two new monoterpene glucosides from[J].(), 2005, 53(10): 1355-1358.
[13] 蔡乐, 王曙, 李涛, 等. 印度獐牙菜的化学成分研究 [J]. 华西药学杂志, 2006, 21(2): 111-113.
[14] Recio-Iglesias M C, Marston A, Hostettmann K. Xanthones and secoiridoid glucosides of[J]., 1992, 31(4): 1387-1389.
[15] 周宏雷, 袁久荣. 中华苦荬菜化学成分的研究 [J]. 中草药, 1996, 27(5): 267-268.
[16] 冉小库, 窦德强. 牛蒡子化学成分研究 [J]. 辽宁中医药大学学报, 2013, 15(7): 71-72.
[17] 马俊利, 李宁, 李铣. 忍冬叶中咖啡酰奎宁酸类化学成分 [J]. 中国中药杂志, 2009, 34(18): 2346-2348.
[18] 刘芬芸, 张东丽, 侯文彬, 等. 胡芦巴种子化学成分研究 [J]. 中草药, 2020, 51(1): 31-35.
[19] 秦南, 苏艳芳, 王亚笛, 等. 城口东俄芹化学成分研究 [J]. 天然产物研究与开发, 2013, 25(2): 201-203.
[20] Gulluce M, Karadayi M, Guvenalp Z,. Isolation of some active compounds fromL. ssp. vulgare and determination of their genotoxic potentials [J]., 2012, 130(2): 248-253.
[21] 庆伟霞, 王悠悠, 王艳艳, 等. 高速逆流色谱法分离忍冬叶中木犀草素-7--β--葡萄糖苷和忍冬苷 [J]. 中国医药工业杂志, 2015, 46(2): 145-148.
[22] Wang J J, Zhen B, Hu J W,. Boscartins L-O: Cembrane-type diterpenoids from the gum resin ofFlueck [J]., 2019, 163: 126-131.
[23] 王鹏, 周扬, 付先军, 等. 金银花的文献出处及相关药用名称药用部位考证 [J]. 中华医史杂志, 2013, 43(3): 144-146.
[24] 赵媛媛, 杨倩茹, 郝江波, 等. 金银花与忍冬藤及叶药理作用差异的研究进展 [J]. 中国中药杂志, 2016, 41(13): 2422-2427.
[25] 陈两绵, 邹芳艳, 刘晓谦, 等. 3种检测方法比较忍冬药用和非药用部位的抗氧化活性[J]. 世界中医药, 2021, 16(17): 2513-2519.
[26] Cai Z C, Liao H Y, Wang C C.. A comprehensive study of the aerial parts ofThunb. based on metabolite profiling coupled with PLS-DA [J]., 2020, 31: 786-800.
Chemical constituents fromleaves and their hepatoprotective activities
WANG Kai1, 2, LIU Shuang2, LI Meng2, LI Li-li2, YU Jin-qian2, WANG Xiao2
1. School of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250300, China 2. Shandong Key Laboratory for Applied Technology of Sophisticated Analytical Instruments, Shandong Analysis and Test Center, Qilu University of Technology (Shandong Academy of Sciences), Jinan 250014, China
To study the chemical constituents ofleaves and their hepatoprotective activities.The chemical constituents fromleaves were isolated and purified by the chromatography on silica gel column, reversed-phase C18column, Sephadex LH-20 column, and semi-preparative HPLC and their structures were identified by various spectroscopic analysis. In this experiment, anhepatocyte injury model was used, and the MTT method was used to detect the effects of compounds against acetaminophen (APAP)-induced injury of human liver cancer HepG2 cells.Nineteen compounds were isolated from the ethanol extract ofleaves, which were identified as secologanoside (1), 8-epiloganic acid (2), loganic acid (3), caffeic acid (4), chlorogenic acid (5), cryptochlorogenic acid (6), neochlorogenic acid (7), 6′--β--apiofuranosyl sweroside (8), demethylsecologanol (9), sweroside (10), vogeloside (11),-vogeloside (12) , luteolin-7--β--glucoside (13), isochlorogenic acid A (14), isochlorogenic acid B (15), cynaroside (16), luteolin-7--[α-- pyranafinosyl-(1→6)]-β--glucopyranoside (17), luteolin-7--xyloside (18) and lonicerin (19). Among them, compounds 2—11, 13—15, 17 showed significant anti-APAP liver injury effects.Compounds 1, 2, 8, 11, 12 and 18 are isolated fromleaves for the first time, while compound 18 is obtained fromfor the first time. Compounds 2—11, 13—15, 17 showed significant hepatoprotective activities.
leaves; hepatoprotective activity; secologanoside; 8-epiloganic acid; 6′--β--apiofuranosyl sweroside; vogeloside
R284.1
A
0253 - 2670(2022)08 - 2285 - 07
10.7501/j.issn.0253-2670.2022.08.004
2021-12-03
山东省重大科技创新工程(2021CXGC010508);国家自然科学基金项目(21904080);济南市“高校20条”项目(2020GXRC007)
王 凯,男,硕士研究生,研究方向为中药质量控制。E-mail: 987878472@qq.com
王 晓,男,研究员,从事中药质量控制研究。E-mail: wangx@sdas.org
[责任编辑 王文倩]
