基于TOPSIS法的前馈控制在丹参醇提液均化中的应用
2022-04-19陈兆昱金伟锋万海同
陈兆昱,金伟锋,万海同,何 昱
基于TOPSIS法的前馈控制在丹参醇提液均化中的应用
陈兆昱,金伟锋,万海同,何 昱*
浙江中医药大学药学院,浙江 杭州 311402
基于理想解排序(technique for order preference by similarity to an ideal solution,TOPSIS)法的前馈控制实现不同批次丹参醇提液的均化。首先采用积分球漫反射收集各批次丹参药材的近红外光谱数据;然后在不同批次丹参8种有效成分(丹参素、原儿茶醛、丹酚酸B、丹酚酸A、丹参酮I、隐丹参酮、丹参酮IIA、迷迭香酸)提取工艺单因素和含量测定实验的基础上,以提取时间、提取温度、乙醇体积分数为数值因素、批次为分类因素,8种有效成分含量经TOPSIS法综合评价后的得分为响应值,进行I-最优实验设计;最后建立以近红外数据,工艺参数为输入变量,提取液有效成分含量的综合得分为输出变量的遗传神经网络模型,以各批次丹参的近红外数据调整相应的醇提工艺参数,使得不同批次丹参醇提液中8种有效成分的含量差异减小。通过建立的模型调整相应的提取工艺使得4个批次丹参醇提液中各成分含量RSD值的平均值24.9%降低至13.5%。基于TOPSIS法的前馈控制能提升丹参醇提液质量的一致性,为中药提取液的均化研究提供了参考。
前馈控制;TOPSIS法;遗传神经网络;丹参;近红外光谱;中药均化;丹参素;原儿茶醛;丹酚酸B;丹酚酸A;丹参酮I;隐丹参酮;丹参酮IIA;迷迭香酸
在满足一定质量要求的前提下,减少中药材批次变化带来的质量差异是中药提取液均化的主要目标。前馈控制是一种根据扰动量进行补偿的开环控制系统,能够明显减少由于物料变化带来的产品质量波动[1-3],因此前馈控制在中药提取液均化方面的应用有较高的研究价值。目前已有将近红外光谱(near-infrared spectroscopy,NIRS)引入前馈控制中,减少产地变化带来提取液质量波动的报道[4],但并未针对中药提取液成分复杂、有效成分多的特点进行研究。
理想解排序法(technique for order preference by similarity to an ideal solution,TOPSIS)是一种依据评价对象与理想解接近程度进行评分的综合评价法,在中药质量评价方面已有广泛的使用[5-8]。本研究基于TOPSIS法构建前馈控制模型,针对提取液与理想解的接近程度进行控制,通过优化关键工艺的方式提升提取液与理想解的接近程度,从而达到对成分复杂的中药提取液进行控制的目的。
丹参为唇形科鼠尾草属植物丹参Bge.的干燥根和根茎,有活血祛瘀、通经止痛、凉血消痈的功效[9]。其主要有效成分可分为水溶性酚酸类和脂溶性丹参酮类2大类,是常见的活血化瘀药,常用于治疗心血管疾病[10-11]。
在实验过程中,首先收集各批次丹参的NIRS数据,作为前馈控制模型的协变量,然后建立了丹参中水溶性有效成分(丹参素、原儿茶醛、丹酚酸B、丹酚酸A、迷迭香酸)和脂溶性有效成分(丹参酮I、隐丹参酮、丹参酮IIA)的定量方法,并对各个批次的丹参进行含量测定和提取工艺单因素实验。最后在此基础上进行I-最优实验设计,建立了以近红外数据为协变量,提取工艺为可控变量,丹参醇提液中8种有效成分含量经TOPSIS法计算后的综合得分为因变量的遗传神经网络模型。根据各批次丹参近红外数据对提取工艺进行相应的优化,以减少不同批次丹参醇提液中8种有效成分的含量差异,使丹参醇提液质量均化。
1 材料
1.1 仪器
Agilent 1260 infinity型高效液相色谱仪,配备DAD检测器,美国Agilent公司;FA1104N十万分之一电子分析天平,上海精密科学仪器有限公司;超纯水仪,美国Millipore公司;Antaris II型傅里叶变换近红外光谱仪,美国Thermo Fisher公司。
1.2 药材及试剂
不同批次的丹参药材购自各地药房以及药材市场,详见表1,并经浙江中医药大学药学院张水利教授鉴定为唇形科植物丹参Bge.的干燥根和根茎。
对照品丹参素、原儿茶醛、丹酚酸A、丹参酮I、隐丹参酮、迷迭香酸、丹酚酸B、丹参酮IIA均购自成都德思特生物技术有限公司,批号分别为DSTDD001501、DST201109-008、DST201022-013、DST200511-011、DSTDM002701、DSTDY008001、DSTDD000902、DSTDD001102,质量分数均大于98%;甲醇、乙腈为色谱纯,美国Tedia公司;甲酸、95%乙醇均为分析纯。
表1 不同批次丹参的来源、产地、批号
Table 1 Information of medicinal materials of S. miltiorrhiza
编号批号产地来源 S12020456山东安徽省亳州市中药材市场 S22013201山东安徽省亳州市中药材市场 S320101601山东浙江景岳堂药业有限公司 S420102501山东浙江景岳堂药业有限公司 S5200714山东浙江震元医药连锁有限公司杭 S6200918山东杭州方回春堂国药馆有限公司 S7200802山东浙江中医药大学饮片厂 S82011250山东爱珍药品零售有限公司 S920210103山东河北康典药业有限公司 S10201101471山东成都康美药业生产有限公司 S11201120山东安徽广和中药股份有限公司 S12200801山东普宁市泽群中药饮片有限公司 S13221405山西安徽省亳州市中药材市场 S14223021山西安徽省亳州市中药材市场 S15200815山西杭州凝和堂中医门诊部有限公司 S162201026山西杭州太和堂中医门诊部有限公司 S172201029山西杭州民泰中药饮片公司 S182005021四川四川一片叶药业 S192009023四川通化市同福参茸制品有限公司 S20203010安徽安徽省亳州市中药材市场 S21203111安徽安徽省亳州市中药材市场 S22209041河南安徽省亳州市中药材市场
2 方法与结果
2.1 各批次丹参药材NIRS的采集
取上述22批丹参药材粉碎,过80目筛,40 ℃下干燥24 h后,均匀填充于近红外光谱仪的样品杯中,采用积分球漫反射测定。以空气为参比,分辨率为8 cm−1,扫描次数64次,扫描范围4000~10 000 cm−1,每个样品测定3次,求平均光谱。
为了避免NIRS中存在的冗余信息对模型的干扰,在应用NIRS数据前多对其进行预处理及波长筛选[12-13]。本研究采用TQ Analyst软件(版本9.5.0.76,美国Thermo Fisher公司)中自带的标准正则变化(standard normal variate,SNV)和多元散射校正(multiplicative scatter correction,MSC)2种光程矫正方法组合一阶导数(first derivative,1st)和二阶导数(second derivative,2nd)2种光谱格式,共产生4种不同的预处理方式。此外还需将处理后的光谱数据采用S-G滤波平滑(Svaitzky-Golay smoothing)以消除导数引入的光谱噪音。
波长筛选方面,连续投影法(successive projections algorithm,SPA)能充分寻找含有最低限度的冗余信息的变量组,使得变量之间的共线性达到最小。同时能减少建模所用变量的个数,提高建模的速度和效率,故本研究采用连续投影法对预处理后的NIRS筛选波长。经过筛选后共将预处理和波长筛选后的NIRS数据进行主成分分析(principal component analysis,PCA),以主成分得分来反映药材的质量信息[14-15],用于遗传人工神经网络模型的构建。
为了对4种不同的预处理方法进行筛选,本研究采用遗传神经网络模型中训练集和验证集的最大决定误差(maximum absolute erro,MAE)、决定系数(determination coefficient,2)及相关系数(correlation coefficient,)值确定预处理方法,以训练集和验证集MAE趋近与0、2、趋近与1为优,其中神经元数量选为6,主成分数量选为2,具体数据见表2。根据表2,本研究决定采用SNV+1st作为NIRS数据的预处理方法,其通过连续投影法筛选出的波长为4 072.92、4 420.05、4 481.76、 4 844.31、4 936.87、5 075.72、5 260.86、5 268.57、7 062.04、9 881.46 cm−1。除预处理方式外,主成分数量也是一个需要考量的因素。主成分数量越多,累计方差贡献率越高,其能解释的光谱信息也越多。但随着主成分数量增多,模型需输入的变量也随之增多,使得工艺寻优的难度增大。
表2 预处理方法对训练集和验证集MAE、R2、r的影响
Table 2 Effect of pretreatment method on MAE, R2 and rof training data and testing data
预处理方法R2trainMAEtrainrtrainR2testMAEtestrtest 无预处理0.741 40.029 60.862 80.834 20.018 50.925 7 SNV+1st0.995 60.001 90.997 80.968 30.012 90.991 8 SNV+1st0.996 50.001 80.998 30.940 30.019 80.970 6 SMC+2nd0.994 70.003 10.997 30.929 20.021 20.964 2 SMC+2nd0.964 40.007 80.982 00.966 80.012 70.992 1
因此,本研究在选取主成分数量时,采用不同主成分数量所建立模型的MAE、2、3个指标和累计方差贡献率选择主成分数目,结果见表3。由表3可知,当主成分数量2个及以上时模型有较好拟合度,但考虑到主成分数量对后续计算难度的影响,本研究最终选择主成分数量为2来反映药材的质量信息。此时PCA的累积方差贡献率为72%,能反映大部分的NIRS数据信息。
2.2 不同批次丹参中8种成分含量测定的方法学考察
2.2.1 混合对照品溶液的制备 分别精密称取丹参素、原儿茶醛、丹酚酸B、丹酚酸A、丹参酮I、隐丹参酮、丹参酮IIA、迷迭香酸对照品适量,加入80%甲醇制备成质量浓度分别为0.340、0.110、3.100、0.340、0.300、0.560、0.400、0.260 mg/mL的对照品储备液。精确吸取各对照品溶液适量,配制成8种成分质量浓度分别为0.257、0.004、0.906、0.019、0.014、0.063、0.060、0.059 mg/mL的混合对照品溶液。
表3 主成分数量对训练集和验证集MAE、R2、r的影响
Table 3 Effect of number of principal components on MAE, R2 and rof training data and testing data
主成分数量累积方差贡献率/%R2trainMAEtrainrtrainR2testMAEtestrtest 1430.938 90.010 60.968 90.900 40.024 30.949 0 2720.995 60.001 90.997 80.968 30.012 90.991 8 3860.995 70.002 80.997 80.968 00.013 10.996 5 4930.996 50.001 80.998 30.962 30.015 90.984 4
2.2.2 供试品溶液的制备 精密称取干燥后的丹参粉末5 g(过五号筛),置于圆底烧瓶中,以1∶20的液料比精密加入70%乙醇,浸泡30 min后,在80 ℃下加热回流90 min,放冷,滤过,续滤液移至250 mL量瓶中加70%乙醇定容,摇匀。为避免溶剂效应,进样前取供试品0.5 mL与0.5 mL纯水混合,过0.22 μm微孔滤膜。
2.2.3 色谱条件 色谱条件为Agilent Zorbax SB- C18色谱柱(250 mm×4.6 mm,5 μm)及Agilent Zorbax SB-C18保护柱(12.5 mm×4.6 mm,5 μm),流动相为0.4%甲酸水溶液(A)-乙腈(B)-甲醇(C),梯度洗脱:0~8 min,93%~80% A,7%~20% B;8~22 min,80%~76% A,20%~24% B;22~28 min,76%~70% A,24%~30% B;28~33 min,70%~30% A,30%~40% B,0~30% C;33~51 min,30% A,40% B,30% C;51~60 min,30%~20% A,40%~50% B,30% C;60~65 min,20%~93% A,50%~7% B,30%~0 C;柱温30 ℃;体积流量1.0 mL/min;进样量20 μL;检测波长280 nm(丹参素、原儿茶醛、丹酚酸B、丹酚酸A、丹参酮I、隐丹参酮、丹参酮IIA)及330 nm(迷迭香酸)。色谱图见图1。
2.2.4 线性关系考察 取“2.2.1”项下混合对照品溶液,用80%甲醇逐级稀释,得到梯度质量浓度的混合对照品溶液,HPLC进样检测,以峰面积()对各对照品溶液质量浓度()绘制标准曲线,建立回归方程,结果分别为丹参素=8.812+5.601,=0.999 1,线性范围0.513~25.660 μg/mL;原儿茶醛=52.946+3.290,=0.999 3,线性范围0.083~4.151 μg/mL;丹酚酸B=18.784+287.420,=0.999 6,线性范围18.113~906.660 μg/mL;丹酚酸A=34.024+2.571,=0.999 4,线性范围0.385~19.245 μg/mL;丹参酮I=35.350+6.594,=0.999 2,线性范围0.287~14.340 μg/mL;隐丹参酮=57.383+47.884,=0.999 7,线性范围1.268~63.396 μg/mL;丹参酮IIA=66.310+48.884,=0.999 6,线性范围1.207~60.337 μg/mL;迷迭香酸=40.714+50.197,=0.999 5,线性范围1.177~58.870 μg/mL。
2.2.5 精密度试验 取同一混合对照品溶液,按“2.2.3”项色谱条件检测,连续进样6次,记录峰面积,结果丹参素、原儿茶醛、丹酚酸B、丹酚酸A、丹参酮I、隐丹参酮、丹参酮IIA、迷迭香酸8个组分峰面积的RSD分别为2.17%、1.82%、2.00%、2.51%、1.28%、2.01%、1.92%、1.79%,表明仪器精密度良好。
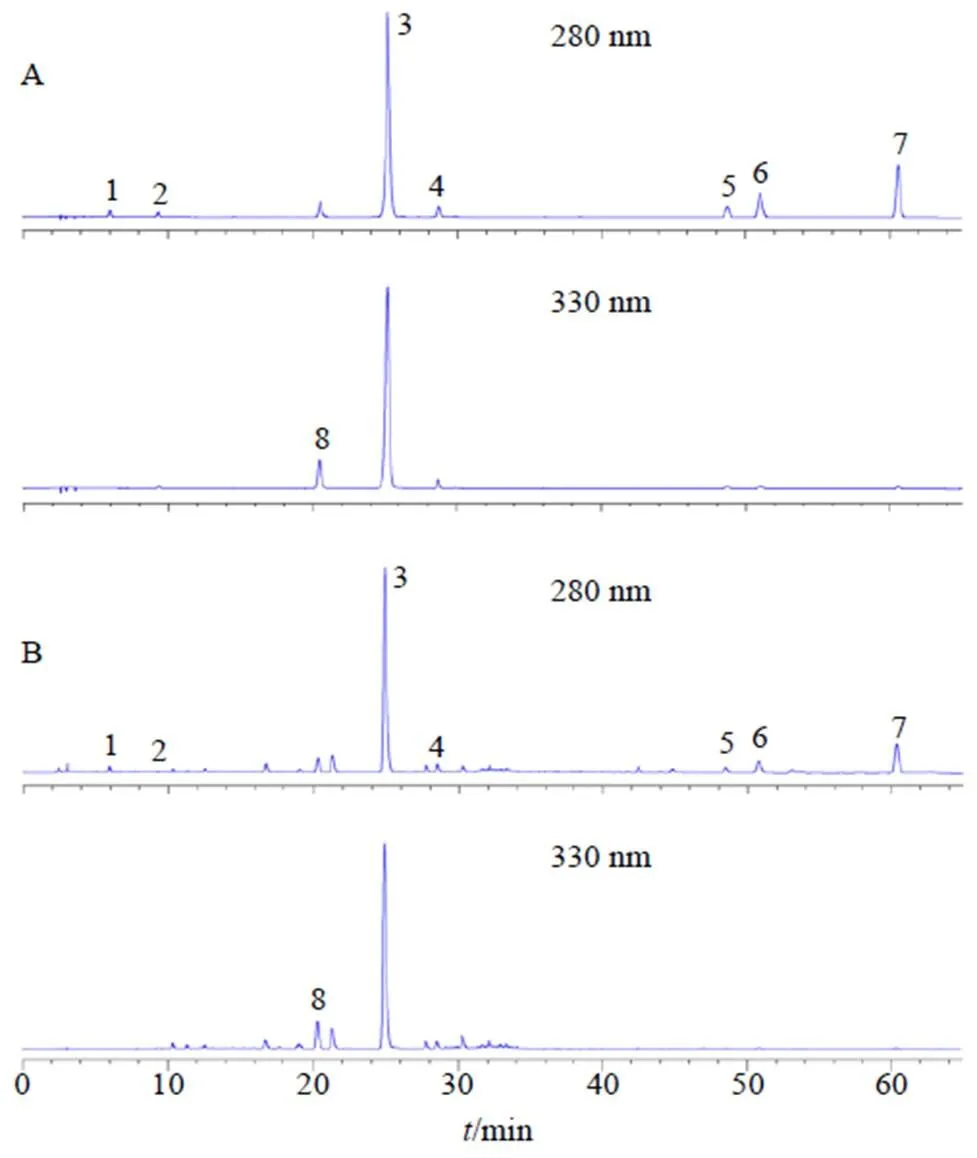
1-丹参素 2-原儿茶醛 3-丹酚酸B 4-丹酚酸A 5-丹参酮I 6-隐丹参酮 7-丹参酮IIA 8-迷迭香酸
2.2.6 稳定性试验 取同一供试品溶液(S20)分别于制备0、2、4、8、12、24 h后进样,按“2.2.3”项色谱条件检测,记录峰面积。结果丹参素、原儿茶醛、丹酚酸B、丹酚酸A、丹参酮I、隐丹参酮、丹参酮IIA、迷迭香酸8个组分峰面积的RSD值分别为2.80%、1.61%、1.73% 、1.98%、2.43%、1.29%、1.50%、1.62%,表明供试品溶液在24 h内稳定。
2.2.7 重复性试验 取相同批次的丹参粉末按“2.2.2”项方法平行制备6组供试品溶液,按“2.2.3”项色谱条件检测,结果丹参素、原儿茶醛、丹酚酸B、丹酚酸A、丹参酮I、隐丹参酮、丹参酮IIA、迷迭香酸8个成分的质量分数分别是0.730、0.016、32.013、0.306、0.470、0.527、1.043、2.038 mg/g,其RSD分别为2.73%、2.21%、2.02%、2.43%、2.36%、1.63%、2.55%、1.67%,说明该方法重复性良好。
2.2.8 加样回收率试验 取已测定8个成分质量分数的S20的丹参粉末0.5 g,精密加入与粉末中各成分等量的对照品溶液,按“2.2.2”项方法平行制备6份,按“2.2.3”项色谱条件检测,结果丹参素、原儿茶醛、丹酚酸B、丹酚酸A、丹参酮I、隐丹参酮、丹参酮IIA、迷迭香酸8个成分的平均加样回收率分别为98.10%、97.30%、99.30%、97.50%、96.70%、100.80%、103.50%、99.10%,RSD分别为2.98%、1.77%、1.81%、2.04%、2.77%、1.73%、2.01%、2.63%。
2.3 单因素实验
选取丹参药材中的丹参素、原儿茶醛、丹酚酸B、丹酚酸A、丹参酮I、隐丹参酮、丹参酮IIA、迷迭香酸共8种有效成分作为丹参醇提液的控制对象。通过预试验发现8种成分随提取条件变化的趋势不尽相同,因此本研究通过熵权法赋权求综合得分的方式来综合评价各项提取工艺参数在单因素实验中对这8种成分的影响[16]。熵权法是一种通过计算各指标信息熵反映其变异程度的赋权法,熵值越小,指标变异程度越大,其权重也就越大。通过熵权法求得的综合得分能反映出8种成分含量随单因素水平变化的趋势,进而对单因素水平进行筛选,其计算步骤如下。
第1步,将各项指标的数据标准化,标准化公式如下,其中x表示第个样品在第个指标下的数据(=1, 2, …,;=1, 2, …,)。
x'=(ij-min{1j,…,x})/(max{1j,…,x}-min{1j,…,x}) (1)
第2步,计算各样品在第各指标下的比重p。
(2)
第3步,计算各项指标的熵值e。
(3)
第4步,计算第项指标的信息冗余度d。
d=1-e(4)
第5步,计算第项指标的权重。
(5)
第6步,计算各单因素实验中的样品的总得分。
(6)
精密称取丹参粉末进行提取,保持其他提取条件不变,分别考察提取时间、提取温度、乙醇体积分数、料液比、浸泡时间5个因素对丹参中8种有效成分的影响,经熵权法计算后的综合得分见表4。由表4可知,各提取工艺参数的最优值分别为提取温度90 ℃,提取时间90 min,浸泡时间30 min,乙醇体积分数70%,料液比1∶30。
表4 各因素不同水平的综合得分
Table 4 Comprehensive scores of different levels in single factor experiment
提取时间/min总得分提取温度/℃总得分乙醇体积分数/%总得分料液比总得分浸泡时间/min总得分 300.267600.130500.3631∶100.03800.000 600.279700.180600.7591∶200.388300.910 900.783800.684700.8861∶300.755450.761 1200.700900.814800.5661∶400.739600.833 1500.4321000.308900.3651∶500.687750.860
2.4 不同批次丹参各成分含量的测定
选取单因素实验中各工艺参数的最优点为提取条件,测定不同批次丹参提取液在同一提取条件下各成分的含量。为了直观地反映不同批次丹参之间有效成分的含量差异,为后续实验设计选择批次提供依据,将丹参中水溶性成分和脂溶性成分两大类分别进行熵权法赋权,计算总得分,见图2。
图2横坐标代表丹参中水溶性成分经熵权法赋权后计算的总得分(丹参素、迷迭香酸、原儿茶醛、丹酚酸B、丹酚酸A),纵坐标代表丹参中脂溶性成分(丹参酮IIA、隐丹参酮、丹参酮I)经熵权法赋权后计算的总得分。
图2中不难看出S9(水溶性成分含量低而脂溶性成分含量极高),S22、S13(水溶性成分高而脂溶性成分极低),S11(水溶性成分极高)4个样本偏离中心区域较远。由于前馈控制是通过改变提取条件对提取液质量进行影响的,在提取液质量满足一定的条件下,前馈控制起到的效果是有限的,远不足以弥补这4个批次药材本身质量与其他批次的差异,因此这4个批次将不纳入代表批次的选择范围。选择分布较为分散但未与其他批次差异过大的4个批次S8、S10、S19、S21作为I-最优实验设计的分类变量进行后续实验设计。4个批次各成分含量见表5。
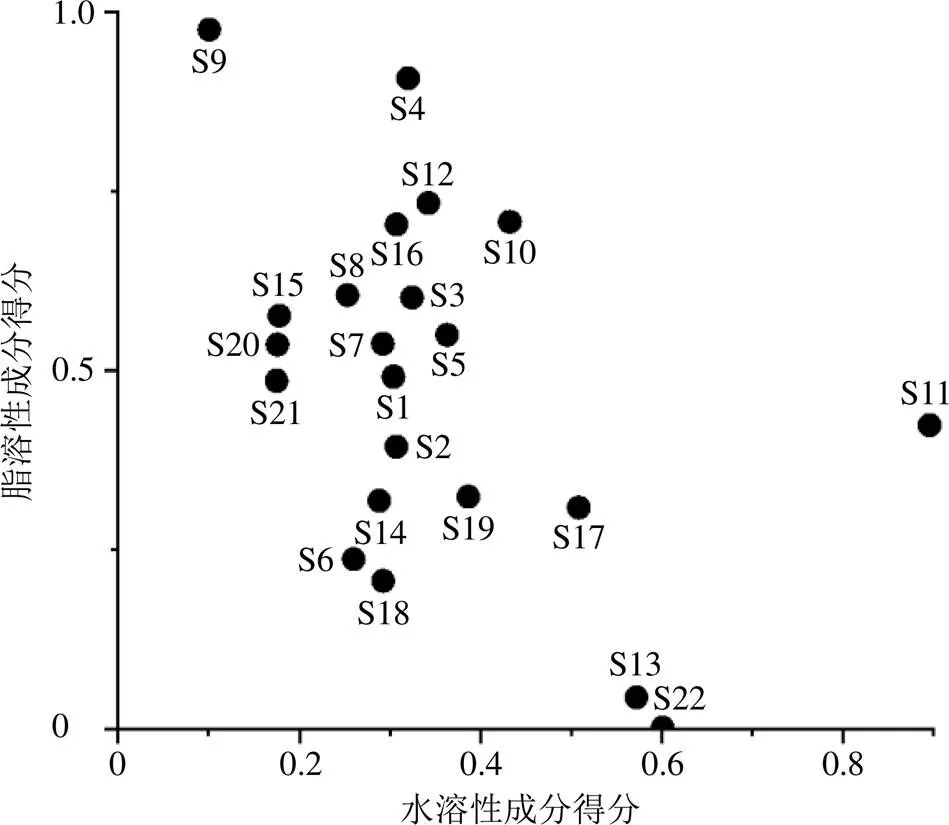
图2 各组丹参水溶性成分和脂溶性成分得分分布图
2.5 I-最优实验设计
最优实验设计是一种灵活的实验设计方法,可以用于不规则设计、含分类因素的设计和自定义模型设计[17]。本实验选用I-最优实验设计,依据单因素实验的结果选取提取温度、提取时间、乙醇浓度为变量,选择S8、S10、S19、S21 4个批次作为分类变量,以TOPSIS分析的结果为响应值进行I-最优实验设计,结果见表6。
表5 4个批次丹参的8种成分含量
Table 5 Contents of eight components in four batches of S. Miltiorrhiza
批次质量分数/(mg∙mL−1) 丹参素原儿茶醛丹酚酸B丹酚酸A丹参酮I隐丹参酮丹参酮IIA迷迭香酸 S81.1030.02034.6490.5140.5260.8860.9891.537 S101.3960.04035.9560.9530.3300.8231.6551.662 S191.4200.02931.5200.6320.3600.4260.9952.216 S211.0520.02729.0480.5140.2310.7241.2361.156 RSD/%15.4427.769.5031.8133.9228.4725.6526.72
表6 丹参提取过程的I-最优实验设计
Table 6 I-optimal design and results of extraction process of S. miltiorrhiza
试验号提取温度/℃提取时间/min乙醇/%批次Q值试验号提取温度/℃提取时间/min乙醇/%批次Q值 110012080S80.675178012080S210.584 28012070S190.661181006060S210.515 38012060S100.684198012070S80.606 41009080S210.616209012070S100.521 5909070S210.614211009060S190.583 6906070S100.5512210012080S190.593 7909080S210.57723806070S210.501 8909060S210.4902410012060S210.538 9909060S210.5502510012060S80.858 10809060S190.575261009070S80.719 11906080S80.52727806060S80.578 1210012070S210.59928906070S100.731 138012070S80.59529909070S190.651 141009060S100.60430809080S100.665 15906080S190.612311009070S80.693 161006080S100.604329012070S100.501
2.6 前馈控制
前馈控制作为一种开环的控制系统,其应用于中药领域首先需表征物料信息,将物料与物料之间的差异数值化,使得物料变化对关键质量属性的影响可以在建立的数学模型中表达出来[18]。然后在多个批次中收集工艺参数对最终产品关键质量属性影响的数据,建立生产参数、物料信息2部分数据为自变量,关键质量属性为因变量的回归模型。最终需要对某一批次的关键质量属性进行控制时,依据相应的物料信息,调整可控的生产参数,使得关键质量属性达到控制目标[19]。
中药中成分复杂,一旦需要关注的成分增多则构建相应设计空间的难度也随之增加。因此本研究采用TOPSIS法评价丹参提取液中8种成分含量,计算后的得分能综合反映提取液中各成分含量距离理想解的接近程度,该综合得分越大则该组提取液中各成分含量越接近于理想解。依据“2.1”项NIRS数据和“2.5”项I-最优实验设计数据建立以近红外数据,提取工艺为自变量,丹参提取液中各成分含量经TOPSIS法计算的综合得分为因变量的人工神经网络模型。将建立的模型用于前馈控制中,根据各批次丹参的近红外数据调整提取工艺,使得各批次的综合得分均有最大值,此过程中各批次丹参提取液成分的含量均向理想解靠近,进而减少各批次提取液之间的质量差异且满足一定的质量要求。本实验应用的TOPSIS法具体步骤如下[20]。
第1步,设定各成分的理想解(best),本研究best设定为所选择4个批次在“2.4”项下测得数据的平均值,根据控制目标将原始数据正向化,公式如下。
x'=1-|x-best|/,=max{|x-best|} (7)
第2步,将正向化的数据标准化,标准化公式如下。
x"=(x'-max)/(max-min) (8)
设共有个评价指标,个评价对象,则标准化后的数据矩阵为
(9)
第3步,确定最佳理想解+和最差理想解−,最佳理想解+由每列指标中的最大值组成,最差理想解−由每列指标中的最小值组成。
+=(max{11…x"1},…, max{1m…x"})=(1+…Z+)(10)
−=(min{11…x"1},…, min{1m…x"})=(1−…Z−)(11)
第4步,计算各评价对象最佳理想解+和最差理想解−的距离,其中D+和D−分别表示评价指标距离最佳理想解+和最差理想解−的距离。
(12)
第5步,计算接近程度(),为各评价对象距离最佳方案的贴近程度,值越贴近1表示评价对象距离理想解越近,值越贴近0表示评价对象距理想解远。
=D−/(D++D−) (13)
2.6.1 遗传神经网络模型的建立 遗传神经网络是利用遗传算法找出神经网络的权重和阈值的数学模型,同时具备神经网络非线性拟合能力强和遗传算法收敛速度快和全局性好的优点,在中药提取工艺优化方面已有较多的应用[21-22]。
本研究遗传神经网络模型由MATLAB(版本2016a,美国MathWorks公司)完成,采用提取工艺(乙醇体积分数、提取时间、提取温度)和物料信息(近红外主成分得分)为输入变量,最优实验设计中各组经TOPSIS法计算后的结果为输出变量,随机抽取I-最优实验设计中的29组为训练集,剩余3组为测试集训练模型。
隐藏层神经元数目是决定模型优劣的一个重要因素,隐藏层数目过少则拟合效果差,数目多则模型容易出现“过拟合”现象,因此采用与“2.1”项中筛选近红外数据预处理方法相同的方法即模型的MAE、2、值对神经元数目进行筛选,具体数据见表7,可知神经元数目为6个时最优。模型预测值与实测值误差分析如图3所示,由图可知模型的预测值和实测值基本一致,模型拟合效果良好。
表7 神经元数量对的训练集和验证集MAE、R2、r的影响
Table 7 Effect of number of hidden neurons on MAE, R and rof training data and testing data
神经元数目R2trainMAEtrainrtrainR2testMAEtestrtest 30.715 50.026 30.845 90.924 10.019 80.990 9 40.990 00.006 50.995 00.899 70.023 30.951 5 50.995 60.001 90.997 80.957 70.016 70.983 5 60.995 60.001 90.997 80.968 30.012 90.991 8 70.995 60.001 90.997 80.955 40.017 20.980 1 80.995 60.001 90.997 80.958 80.016 50.982 6
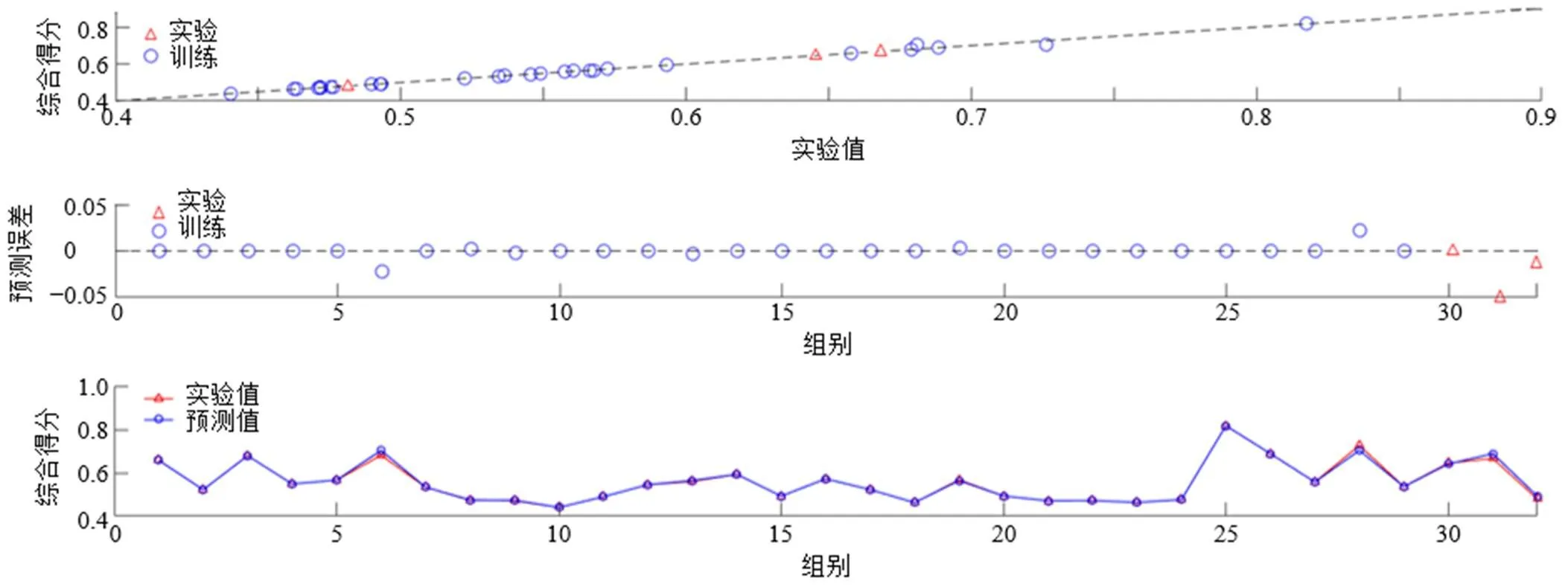
图3 模型预测值与实测值误差分析
2.6.2 前馈控制的实施及验证 基于所建立的遗传神经网络模型,采用遗传算法对设定的4个批次丹参的提取工艺参数进行优化[23-24],算法流程见图4。设定种群大小为1000,迭代次数为200,使得相应的醇提液的TOPSIS综合得分值最大,寻优结果为S8:提取温度98 ℃,提取时间115 min,乙醇体积分数73%;S10:提取温度81 ℃,提取时间120 min,乙醇体积分数60%;S19:提取温度80 ℃,提取时间120 min,乙醇体积分数79%;S21:提取温度99 ℃,提取时间94 min,乙醇体积分数79%,模型的预测值及实际测定值见表8。
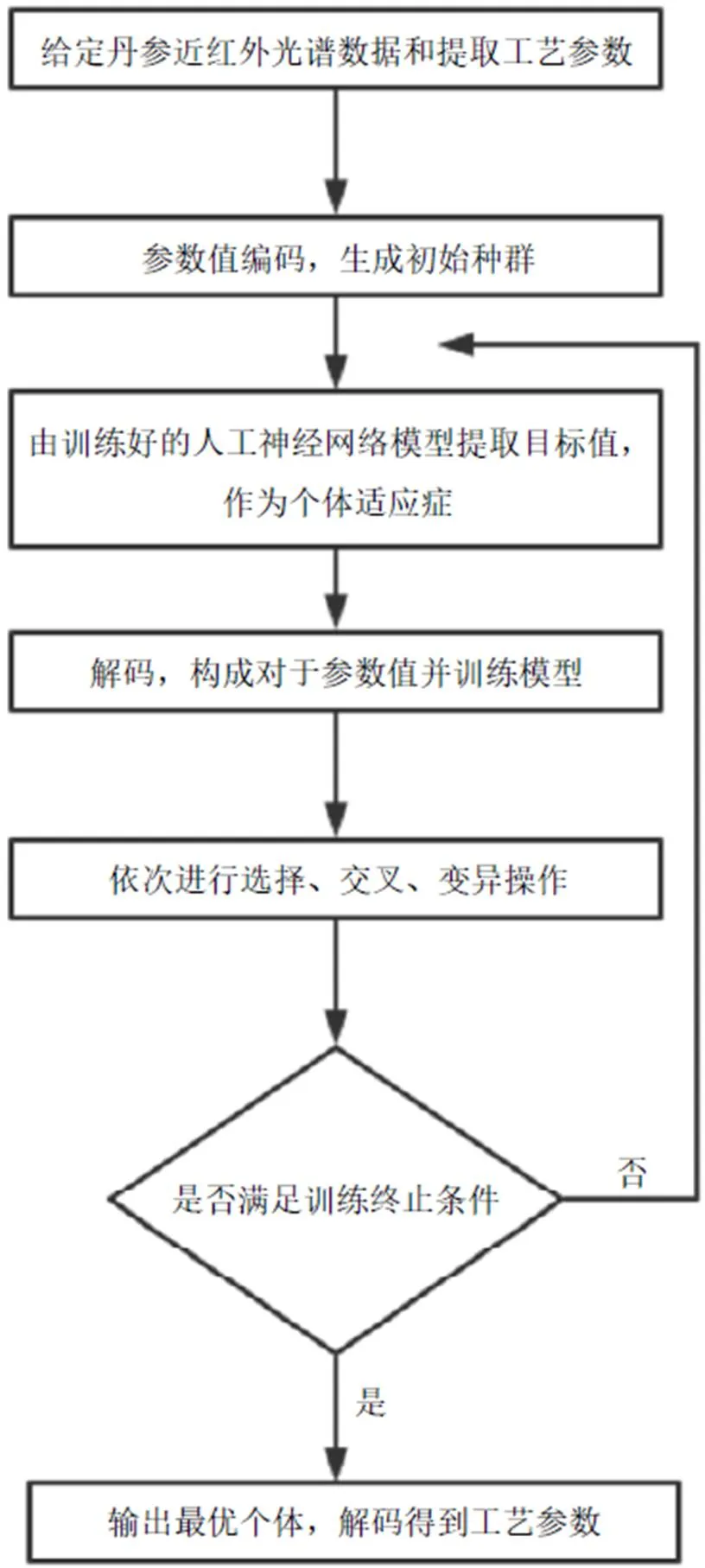
图4 遗传算法优化工艺流程图
为了直观地表示参与前馈控制前后批次有效成分含量的变化,仍将丹参分水溶性成分和脂溶性成分2大类进行按“2.4”项下权重赋权,计算各自总得分,以散点图的形式呈现,见图5。由图5不难看出4个批次丹参药材的醇提液经前馈控制后与未进行前馈控制的相比,水溶性成分和脂溶性成分得分分布明显更加集中,且向目标值靠拢。从具体数据方面分析,比较“2.4”项表5与“2.6.2”项表8可以看出,4个批次中8种有效成分的RSD值均有下降,RSD的平均值从24.9%降到了13.5%,表明前馈控制效果良好,提取液质量一致性得到了提升。若是按照理想解中各成分含量±10%作为可接受范围,则4个批次丹参中8种有效成分含量不达标百分比由“2.4”项中占总数的72%降到了38%,表明前馈控制对提取液中各成分含量起到了控制效果。
S8、S10、S21丹参提取液的最优值均达到0.7以上,表明已经与理想解较为接近,而S19的最优值最大仅为0.552,仍与理想解有一定距离。从图5可以看出S19前馈控制前后与理想解均有一定的差距,且主要差距是脂溶性成分方面。具体到成分来看,无论是前馈控制前的表6中还是前馈控制后的表8中S19批次提取液中隐丹参酮含量与理想解均有较大差距,可能是该批次药材本身隐丹参酮含量较低所致。
表8 验证性实验结果
Table 8 Results of experiments for verification
批次质量浓度/(mg∙mL−1)Q 丹参素原儿茶醛丹酚酸B丹酚酸丹参酮隐丹参酮丹参酮迷迭香酸实际值预测值 S81.2870.03130.7920.6570.4380.7541.1971.3870.7700.783 S101.1310.03232.2210.5970.2380.6911.2991.4860.7550.723 S191.3630.03028.9580.5940.4200.4031.0192.0540.5520.567 S211.2050.03530.4990.6330.4410.7541.3601.3750.7160.681 RSD/%8.066.754.374.7325.4925.7712.2420.68 xbest (1±10%)1.243±0.1240.029±0.00332.793±3.2780.653±0.0630.362±0.0360.715±0.7201.219±0.1221.643±0.164
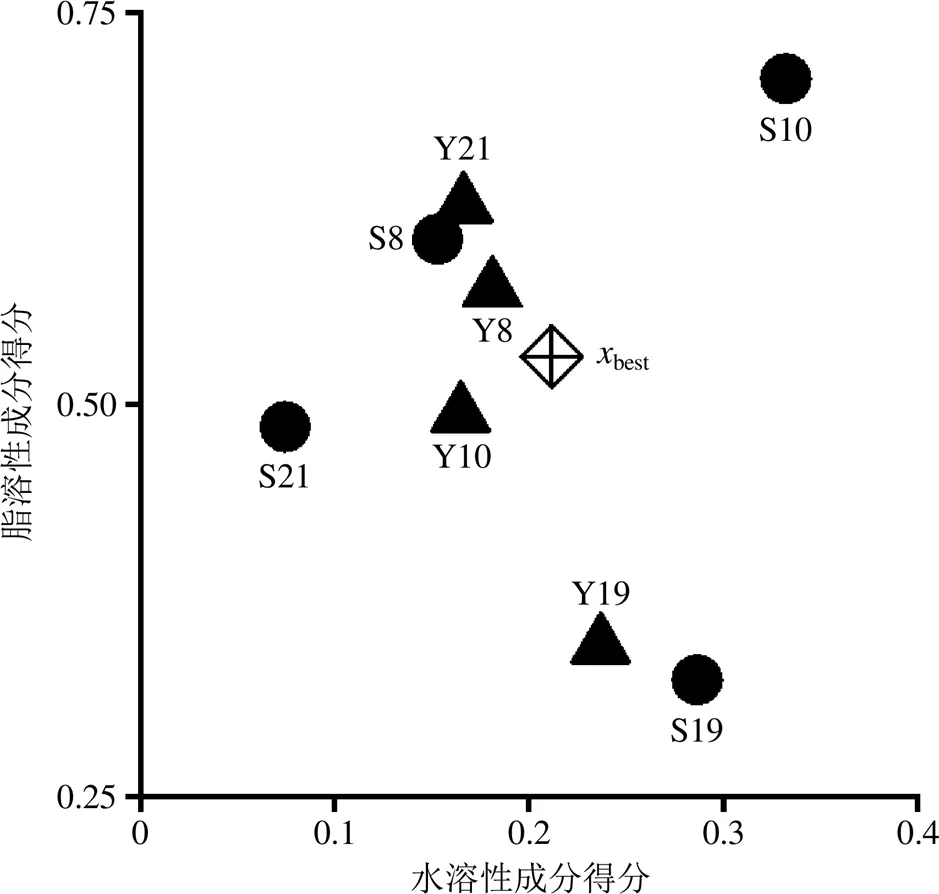
图5 前馈控制前后对比图
3 讨论
中药有多成分多靶点的特点,将前馈控制应用于中药提取过程中需要综合考量各有效成分,以达到减少批次变化带来的提取液质量浮动为目的。本研究使用TOPSIS法综合考量丹参提取液中8种有效成分的含量,建立了提取工艺和NIRS数据为自变量,提取液有效成分含量为因变量的人工神经网络模型,最终根据各批次丹参的近红外数据调整相应的提取工艺。结果表明此模式不仅减少了不同批次药材提取液之间有效成分的含量差异,且对它们的具体含量进行了一定的控制,实现了以中药提取液多种有效成分含量为目标的均化,为中药均化方面研究提供参考。
药材中有效物质的提取是中成药加工生产过程中的关键工序,提取物的质量优劣与最终产品质量休戚相关。但中药材质量往往难以保持一致,使得其相应的提取物质量也参差不齐。针对提取过程建立前馈控制模型,则可对中药材质量波动产生的提取物质量差异进行补偿,减少提取液之间的质量差异。前馈控制模型一旦建立,只需依据模型改变提取工艺,便可提升中药产品的质量一致性。但是需要注意的是前馈控制不能完全消除原料带来的产品质量差异,其仅可作为中药质量控制的一部分。在对原料进行一定筛选的前提下[25],通过前馈控制对提取物进行控制,才能得到具有较好质量一致性的中药产品。
利益冲突 所有作者均声明不存在利益冲突
[1] 黄赞扬, 王亚静, 祁东利, 等. 基于质量源于设计理念构建多糖组分干法制粒前馈控制模型 [J]. 中国实验方剂学杂志, 2022, 28(4): 130-137.
[2] 严斌俊, 郭正泰, 瞿海斌, 等. 前馈控制方法及其在丹红注射液醇沉工艺品质提升中的应用 [J]. 中国中药杂志, 2013, 38(11): 1667-1671.
[3] 李瑶瑶, 张凯旋, 熊皓舒, 等. 基于质量源于设计的复方丹参滴丸混合工艺前馈控制方法研究 [J]. 中国中药杂志, 2021, 46(11): 2816-2823.
[4] 王晓宇, 李文龙, 瞿海斌. 基于药材光谱数据的前馈控制技术在三七醇提过程中的应用研究 [J]. 中国中药杂志, 2018, 43(15): 3127-3134.
[5] Sun Y F, Kmonickova E, Han R L,. Comprehensive evaluation of wildfrom different geographical origins by TOPSIS method based on the macroscopic infrared spectroscopy (IR) fingerprint [J]., 2019, 214: 252-260.
[6] 周欣, 陈丽燕, 陈晓东, 等. 不同酸剂诱导人工沉香的分析与评价 [J]. 中国中药杂志, 2017, 42(16): 3159- 3166.
[7] 李运, 张霁, 徐福荣, 等. 多指标决策分析TOPSIS对三七的质量评价研究 [J]. 中草药, 2017, 48(22): 4764- 4771.
[8] 张志鹏, 邓李红, 李美洲, 等. 基于化学模式识别和熵权TOPSIS法分析槐角不同部位的差异 [J]. 中药材, 2021, 43(6): 1413-1419.
[9] 中国药典 [S]. 一部. 2020: 77.
[10] Yang N Z, Ju A C, Li X,. Salvianolate injection in the treatment of acute cerebral infarction: A systematic review and a meta-analysis [J].2018, 97(47): e12374.
[11] Du H X, He Y, Pan Y J,. Danhong Injection attenuates cerebral ischemia-reperfusion injury in rats through the suppression of the neuroinflammation [J]., 2021, 12: 561237.
[12] 宋侨. 近红外光谱技术在马应龙麝香痔疮膏质量控制中应用研究 [D]. 武汉: 湖北中医药大学, 2020.
[13] Ni L J, Zhang F F, Han M Y,. Qualitative analysis of the roots ofandbased on NIR, UHPLC and LC-MS-MS [J]., 2019, 170: 295-304.
[14] Henriksen H C, Næs T, Rødbotten R,. Simultaneous modelling of process variables and raw material properties as measured by NIR. A case study from cellulose production [J]., 2005, 77(1/2): 238-246.
[15] 李文龙, 刘绍勇, 薛东升, 等. 一种基于近红外光谱技术的熊胆粉粗提物洗涤工艺优化方法 [J]. 中国中药杂志, 2014, 39(1): 75-79.
[16] 陈光玮, 金伟锋, 许守超, 等. 球面对称设计结合遗传神经网络优选黄芪-红花药对水提工艺 [J]. 中草药, 2021, 52(8): 2257-2266.
[17] Smucker B, Krzywinski M, Altman N. Optimal experimental design [J]., 2018, 15(8): 559-560.
[18] 王晓宇, 李文龙, 瞿海斌. 前馈控制技术研究进展及其在中药质控中的应用展望 [J]. 中草药, 2017, 48(21): 4560-4564.
[19] Yan B J, Li Y, Guo Z T,. Quality by design for herbal drugs: A feedforward control strategy and an approach to define the acceptable ranges of critical quality attributes [J]., 2014, 25(1): 59-65.
[20] 刘书斌, 张宏武, 冯晓莉, 等. 基于AHP法优化的熵权TOPSIS模型对不同产地黄花菜药材质量的综合评价 [J]. 中国实验方剂学杂志, 2019, 25(6): 168-174.
[21] 黄鹏程, 金伟锋, 万海同, 等. 遗传神经网络与遗传算法优选黄芪皂苷微波提取工艺条件 [J]. 中草药, 2019, 50(16): 3815-3823.
[22] 吴思佳, 金伟锋, 王航, 等. 基于遗传神经网络的双目标甘草提取工艺优化 [J]. 中华中医药杂志, 2019, 34(4): 1719-1721.
[23] 石磊, 高卫红, 吕莉莉, 等. 基于BP人工神经网络和遗传算法的葛根总黄酮提取工艺优化研究 [J]. 中国中医急症, 2018, 27(2): 198-201.
[24] 尹斐, 杨洁红, 方雨晨, 等. 基于2种分析方法的补阳还五汤中有效成分提取工艺优化研究 [J]. 中草药, 2018, 49(1): 135-141.
[25] 钟文, 陈莎, 章军, 等. 重点是原料, 还是工艺?——以葛根芩连汤为例探讨中成药质量一致性控制方法 [J]. 中国中药杂志, 2016, 41(6): 1027-1032.
Application of feedforward control based TOPSIS method to homogenize alcohol extraction process of
CHEN Zhao-yu, JIN Wei-feng, WAN Hai-tong, HE Yu
College of Pharmaceutical Sciences, Zhejiang Chinese Medical University, Hangzhou 311402, China
The feedforward control based on the technique for order preference by similarity to an ideal solution (TOPSIS) method is used to homogenize alcohol extracts of different batches of Danshen ()Firstly, the near-infrared diffuse reflectance spectra ofwere obtained. Then a high-performance liquid chromatography method had been developed for the simultaneous quantification of eight active components (danshensu, protocatechualdehyde, salvianolic acid B, salvianolic acid A, tanshinone I, cryptotanshinone, tanshinone IIA, rosmarinic acid) contained in alcohol extracts ofOn the basis of single factor experiment and content determination experiment, extraction time, extraction temperature, ethanol concentration were take as numerical factors, the batch was take as categorical factors, eight control targets in the alcohol extract which were comprehensively evaluated by TOPSIS method was taken as response of I-optimal experimental design for the experiment. Finally, a genetic neural network model which reflected the relationship between near-infrared data, process parameters and the effective components was established. Based on the established model, the extraction process was adjusted according to the near-infrared data to decrease the difference in eight active components caused by batch change.Based on the established models, extraction conditions were optimized according to near-infrared data. The RSD value of each component content in alcohol extract ofwas reduced from 24.9% to 13.5%.The feedforward control based on the TOPSIS method has ability to improve the quality and consistency of the alcohol extract ofIt provides a reference for research on the homogenization of Chinese medicine extraction process.
feedforward control;TOPSIS method;Bge.; genetic neural network; near infrared spectroscopy; homogenization of traditional Chinese medicine; danshensu; protocatechualdehyde; salvianolic acid B; salvianolic acid A; tanshinone I; cryptotanshinone; tanshinone IIA; rosmarinic acid
R283.6
A
0253 - 2670(2022)08 - 2302 - 10
10.7501/j.issn.0253-2670.2022.08.006
2021-11-04
国家自然科学基金资助项目(81873226);国家科技重大专项重大新药创制(2019ZX09301101);浙江省“万人计划”科技创新领军人才项目(2019)
陈兆昱,硕士研究生,主要从事中药有效成分提取分离方面研究。E-mail: 13626535279@163.com
何 昱,教授,博士生导师。Tel: (0571)61768145 E-mail: heyu0923@sina.com
[责任编辑 郑礼胜]
