依帕司他与α-硫辛酸分别联合甲钴胺治疗对糖尿病周围神经病变患者氧化应激及神经电生理的影响
2022-04-18尹永锋李江涛王润青
尹永锋,李江涛,王润青
(郑州大学附属郑州中心医院神经内科,河南 郑州 450007)
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)为糖尿病(diabetes mellitus,DM)常见并发症,感觉和运动神经功能障碍是其主要表现。相关资料显示,DM患者中DPN发病率高达50%,其致糖尿病足的截肢率高达80%,以四肢末端原发性感觉病变最常见,严重影响患者生活质量[1-2]。DPN的发生与代谢紊乱、细胞因子异常、神经激素及氧化应激等密切相关[3-4]。临床关于DPN的治疗尚无统一方案,依帕司他为还原酶抑制剂,对机体代谢紊乱的改善作用强,α-硫辛酸为强抗氧化剂,可改善机体氧化应激,进而改善DPN[5]。目前临床针对二者联合甲钴胺对DPN的治疗效果尚存有争议。基于此,本研究探讨依帕司他与α-硫辛酸分别联合甲钴胺治疗对DPN患者氧化应激及神经电生理的影响,以期为DPN的治疗提供参考。
1 资料与方法
1.1 一般资料选取2019年12月至2020年12月郑州大学附属郑州中心医院诊治的96例DPN患者为研究对象,按照随机掷硬币法分为依帕司他组(n=50)及α-硫辛酸组(n=46)。两组一般资料差异无统计学意义(P>0.05)。见表1。本研究经医院医学伦理委员会批准,患者均签署知情同意书。
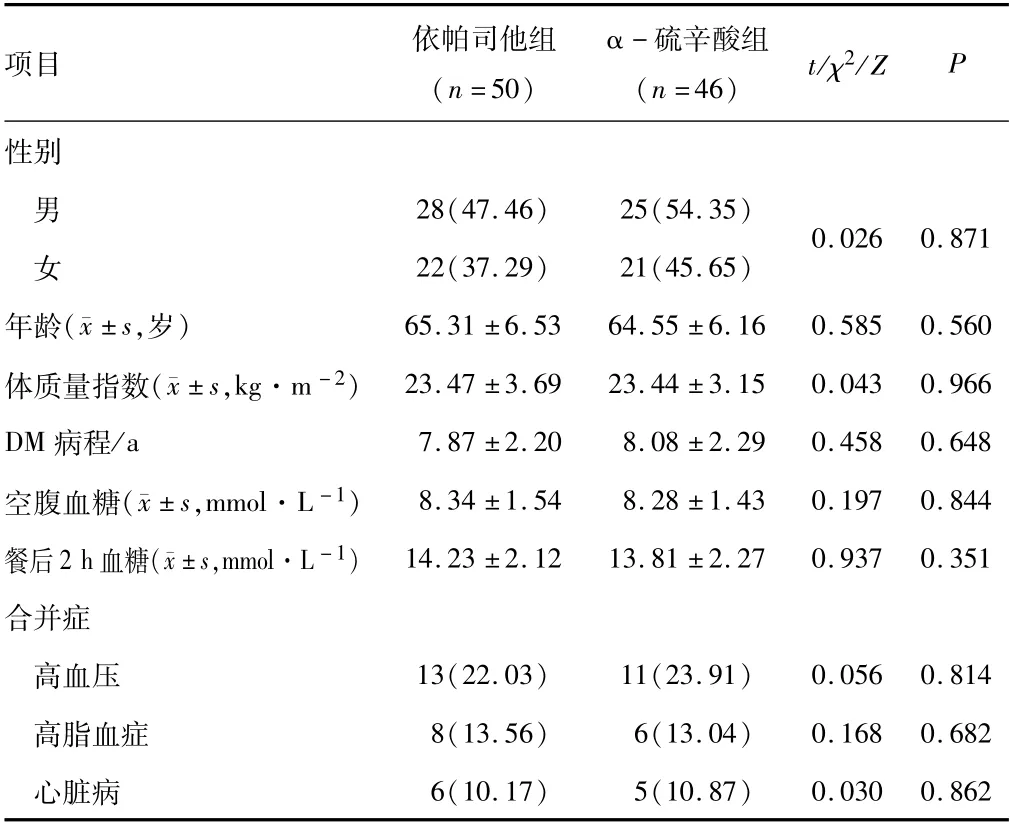
表1 两组一般资料比较
1.2 研究标准
1.2.1 诊断标准 DPN诊断标准[6]:存在DM病史,神经病变在DM确诊后出现,临床表现及体征与DPN症状一致,存在疼痛、麻木、感觉异常,且针刺痛觉、振动觉、温度觉、踝反射、压力觉5项检查中任意1项出现异常,诊断为DPN。
1.2.2 纳入与排除标准 (1)纳入标准:①符合DPN诊断标准;②年龄>18岁;③DM病程>1 a;④近期内未服用DPN药物治疗;⑤对研究药物耐受。(2)排除标准:①重要器官功能不全;②原发性神经供损伤;③恶性肿瘤;④其他疾病引起的的周围神经病变;⑤对治疗药物过敏;⑥治疗中途退出。
1.3 治疗方法给予所有患者降糖药物、饮食及运动指导,在治疗前控制空腹血糖<7.0 mmol·L-1,餐后2 h血糖<10.0 mmol·L-1,糖化血红蛋白(hemoglobin A1c,HbA1c)<7.0%,并针对性给予患者降脂、降压药物治疗。再给予甲钴胺(福建金山生物制药股份有限公司,国药准字H20044740)每次0.5 mg,每日1次,静脉注射。依帕司他组在此基础上加用依帕司他(扬子江药业集团南京海陵药业有限公司,国药准字H20040012)每次50 mg,每日3次,口服。α-硫辛酸组加用α-硫辛酸(德国史达德大药厂,国药准字J20090105)600 mg,每日1次,静脉滴注。治疗时间均为12周。
1.4 观察指标及评判标准(1)临床疗效:治疗12周后基于肌电图、感觉定量测定、压力觉等综合评估。①显效,即疼痛、麻木症状消失,腱反射张力恢复,肌电图显示神经传导速度提高>5 m·s-1以上;②有效,即疼痛、麻木症状缓解,腱反射张力逐渐恢复,肌电图显示神经传导速度提高<5m·s-1以上;③无效,即临床症状、腱反射未改善,肌电图显示神经传导速度未提高。总有效率为显效与有效例数之和占总例数的百分率。(2)神经电生理指标:分别于治疗前及治疗12周采用肌电图仪(NeuroExam M-800C)检测患者正中神经(median nerve,MN)及腓总神经(common perom ealnerve,CPN)的运动神经传导速度(motor nerve conduction velocity,MNCV)和感觉神经传导速度(sensory nerve conduction velocity,SNCV)。(3)氧化应激指标:分别于治疗前及治疗4、8、12周采集患者空腹肘静脉血3 mL,3 000 r·min-1离心10 min,离心半径为10 cm,分离血清,取上层血清于-80℃保存备测。采用酶联免疫吸附测定法检测血清还原型谷胱甘肽(reduced glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)水平。(4)多伦多临床周围神经评分量表(Toronto clinical scoring system,TCSS):分别于治疗前及治疗4、8、12周评估。该量表涉及神经反射(0~8分)、神经症状(0~6分)及感觉功能(0~5分)。得分越低表明症状越轻。
1.5 统计学方法采用SPSS 22.0统计软件行数据分析。计数资料以例数和百分数(%)表示,行χ2检验;计量资料以均数±标准差(±s)表示,行t检验或重复测量分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗效果治疗12周后,依帕司他组和α-硫辛酸组治疗总有效率分别为88.00%(44/50)、86.96%(40/46),差异无统计学意义(χ2=0.024,P=0.877)。
2.2 两组神经电生理指标治疗前,两组患者MN、CPN的MNCV及SNCV比较,差异无统计学差异(P>0.05);治疗12周后,两组MNCV及SNCV均升高,依帕司他组高于α-硫辛酸组(P<0.05)。见表2。
表2 两组神经电生理指标比较(±s,m·s-1)
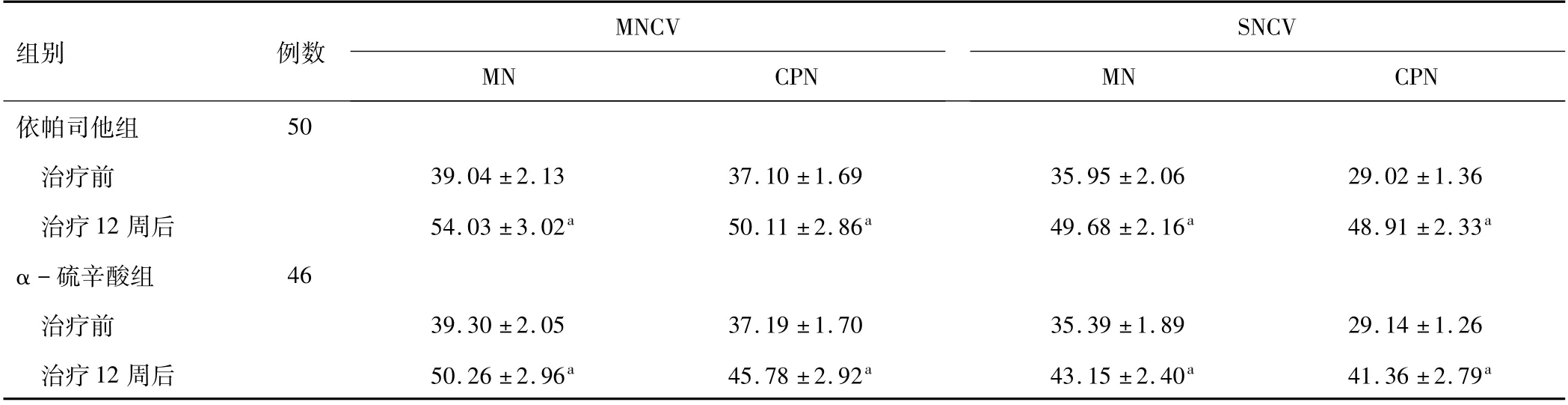
表2 两组神经电生理指标比较(±s,m·s-1)
注:与同组治疗前比较,a P<0.05;MNCV为运动神经传导速度;SNCV为感觉神经传导速度;MN为正中神经;CPN为腓总神经。
MNCV SNCV组别例数MN CPN依帕司他组MN CPN 50治疗前39.04±2.13 37.10±1.69 35.95±2.06 29.02±1.36治疗12周后54.03±3.02a 50.11±2.86a 49.68±2.16a 48.91±2.33a α-硫辛酸组46治疗前39.30±2.05 37.19±1.70 35.39±1.89 29.14±1.26治疗12周后50.26±2.96a 45.78±2.92a 43.15±2.40a 41.36±2.79 a
2.3 两组SOD、GSH水平两组血清SOD、GSH水平以时间因素为源、以时间与组别交互为源的主体内效应、以组别为源的主体间效应比较差异显著(P<0.05)。与治疗前比较,两组患者治疗4、8、12周的血清SOD、GSH水平均降低(P<0.05);治疗4、8、12周后,依帕司他组血清SOD、GSH水平均低于α-硫辛酸组(P<0.05)。见表3。
表3 两组SOD、GSH水平比较(±s)
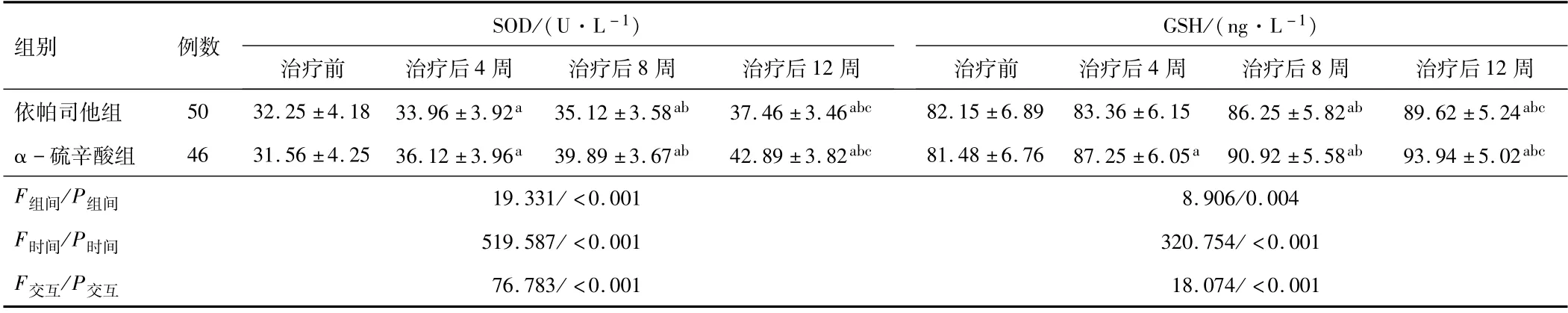
表3 两组SOD、GSH水平比较(±s)
注:与治疗前比较,a P<0.05;与治疗后4周比较,b P<0.05;与治疗后8周比较,c P<0.05;SOD为超氧化物歧化酶;GSH为还原型谷胱甘肽;1 U=16.67 nkat。
组别例数SOD/(U·L-1)GSH/(ng·L-1)治疗前治疗后4周治疗后8周治疗后12周治疗前治疗后4周治疗后8周治疗后12周依帕司他组50 32.25±4.18 33.96±3.92a 35.12±3.58ab 37.46±3.46abc 82.15±6.89 83.36±6.15 86.25±5.82ab 89.62±5.24 abc α-硫辛酸组46 31.56±4.25 36.12±3.96a 39.89±3.67ab 42.89±3.82abc 81.48±6.76 87.25±6.05a 90.92±5.58ab 93.94±5.02abc F组间/P组间19.331/<0.001 8.906/0.004 F时间/P时间519.587/<0.001 320.754/<0.001 F交互/P交互76.783/<0.001 18.074/<0.001
2.4 两组治疗前后TCSS评分重复测量分析结果显示,两组TCSS评分以时间因素为源的主体间效应比较差异有统计学意义(P<0.05)。与治疗前比较,两组患者治疗4、8、12周的TCSS评分均降低(P<0.05);治疗前及治疗4、8、12周后,两组TCSS评分比较,差异无统计学意义(P>0.05)。见表4。
表4 两组治疗前后TCSS评分比较(±s,分)
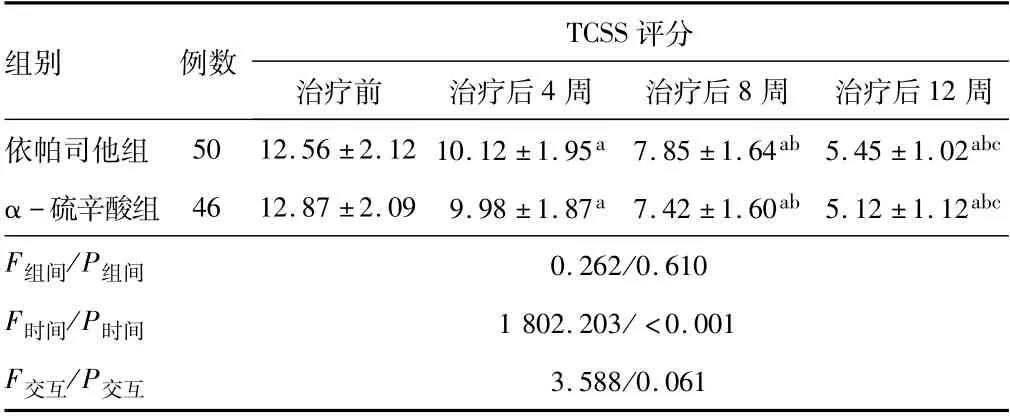
表4 两组治疗前后TCSS评分比较(±s,分)
注:与治疗前比较,a P<0.05;与治疗后4周比较,b P<0.05;与治疗后8周比较,c P<0.05;TCSS为多伦多临床周围神经评分量表。
评分治疗前治疗后4周治疗后8周治疗后12周TCSS组别例数依帕司他组 50 12.56±2.12 10.12±1.95a 7.85±1.64ab 5.45±1.02 abc α-硫辛酸组 46 12.87±2.09 9.98±1.87a 7.42±1.60ab 5.12±1.12abc F组间/P组间0.262/0.610 F时间/P时间1 802.203/<0.001 F交互/P交互3.588/0.061
2.5 两组不良反应发生率依帕司他组治疗期间不良反应发生率与α-硫辛酸组比较,差异无统计学意义(P>0.05)。见表5。
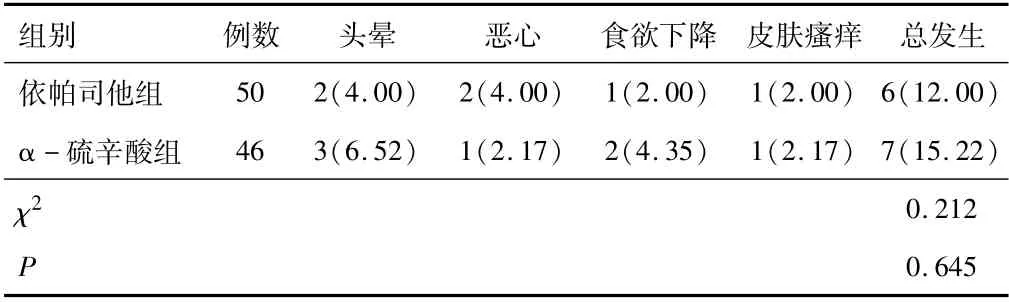
表5 两组不良反应发生率比较[n(%)]
3 讨论
DPN临床症状多表现为对称性远端多神经病变,并伴有疼痛、麻木、肌无力等症状,可造成DM患者生活质量下降甚至致残。临床资料显示,DPN的发病机制较为复杂,涉及代谢障碍、微循环、氧化应激、免疫损伤等多个方面,而临床缺乏针对DPN的特异性治疗方案[7]。因此,继续探讨DPN的有效治疗方案至关重要。
甲钴胺为DPN常规治疗药物,可通过甲基化反应参与核酸、蛋白及卵磷脂的合成,并促进轴索再生及髓鞘形成,避免轴突变性,进而对受损神经细胞进行修复,改善患者神经传导功能[8]。临床已证实甲钴胺治疗可改善DPN患者临床等症状及提高肌电图传导速度,但单一药物治疗效果不佳,易造成患者病情反复,迁延不愈,对患者的生活质量造成负担。研究指出,DM患者机体葡萄糖可在醛糖还原酶作用下转化为山梨醇及果糖,影响神经细胞功能,并使二者积聚于神经元内,造成神经功能异常及紊乱[9-10]。依帕司他为醛糖还原酶抑制药,可有效改善多元醇代谢异常情况,减少山梨醇及果糖的大量积聚,提高神经传导速度[10-11]。α-硫辛酸为脂溶性代谢抗氧化物,可对丙酮酸脱氢酶产生激活作用,促使ATP/ADP比值趋于正常,进而达到清除自由基、降低机体氧化应激反应目的[12]。同时α-硫辛酸可增加机体葡萄糖吸收,维持机体血糖平衡,并增加神经营养血流量,修复神经功能障碍[13]。本研究中,治疗后两组治疗总有效率均较高,且TCSS评分及不良反应发生率无明显差异,提示依帕司他与α-硫辛酸分别联合甲钴胺治疗DPN的有效性及安全性均较好。依帕司他组MN、CPN的MNCV及SNCV高于α-硫辛酸组,提示依帕司他对DPN患者神经传导速度的恢复效果更佳。原因在于,依帕司他可减少山梨醇的积聚,改善患者神经传导速度,α-硫辛酸可刺激抗氧化物质及神经纤维再生,更侧重于受损神经的修复。
DPN的发病机制中氧化应激损伤占有重要地位。DM高糖作用下自由基清除能力明显下降,加之大量游离自由基的产生,促使机体氧化及抗氧化失衡,进一步损伤神经元DNA、蛋白质及脂质,阻碍轴索信号传导,降低神经修复功能。SOD为抗氧化金属酶,可催化超氧阴离子自由基歧化生成氧与过氧化氢,维持机体平衡,与疾病发生发展关系密切[14]。GSH主要在肝脏中合成,可参与体内氧化还原过程,维持机体正常免疫功能[15]。本研究结果显示,治疗后两组血清SOD、GSH水平均升高,但α-硫辛酸组高于依帕司他组。原因可能为:α-硫辛酸为强抗氧化剂,对自由基清除、抗氧化物质的再生及氧化应激反应的减弱作用强,可加快神经损伤修复,而依帕司他侧重于神经传导速度的改善,故α-硫辛酸组患者血清SOD、GSH 水平高。
综上所述,依帕司他与α-硫辛酸分别联合甲钴胺治疗DPN的效果均显著,但依帕司他联合甲钴胺对DPN患者神经传导速度改善作用更强,α-硫辛酸联合甲钴胺侧重于氧化应激改善。本研究不足之处为研究样本较少,有待进一步行大样本数据研究验证。
