贝伐珠单抗联合FOLFOX4化疗对晚期结直肠癌患者的效果
2022-04-18张靖悦杨运芳郑光辉王福保
张靖悦,杨运芳,郑光辉,王福保
(1.平煤神马医疗集团总医院a.肿瘤科;b.普外科,河南 平顶山 467000;2.平顶山第一人民医院普外科,河南 平顶山 467000)
结直肠癌(colorectal cancer,CRC)是常见消化系统肿瘤,发病具有隐匿性,因此约25%患者确诊时已处于晚期阶段,出现病灶转移。近年我国CRC发病率年均升高3%~4%,且呈年轻化趋势;相关数据显示,在常见恶性肿瘤疾病中CRC发病率位居第4,在全部癌症中病死率位居第2,严重威胁患者生命健康[1]。现阶段,临床治疗早期CRC主要进行手术切除,但其5 a复发、转移率可达30%~40%,因此后期化疗等综合治疗方式对CRC患者预后改善意义重大[2]。FOLFOX4[5-氟尿嘧啶(5-fluorouracil,5-FU)、奥沙利铂(oxaliplatin,L-OHP)、亚叶酸钙(leucovorin,LV)]作为CRC一线化疗方案,整体有效率为25% ~50%,预后较差,因此探讨更为有效的治疗方案意义重大[3]。肿瘤病灶生长、转移均依赖于肿瘤新生血管,血管内皮生长因子(vascular endothelial growth factor,VEGF)参与肿瘤血管生成过程,是CRC患者病情进展重要生长因子。贝伐珠单抗属于单克隆抗体,可对VEGF发挥抑制作用,干扰其与相关受体结合,切断血管生成通路,进而发挥抗肿瘤作用。但临床关于贝伐珠单抗应用于CRC的相关研究较少,基于此,本研究选取平煤神马医疗集团总医院收治的98例晚期CRC患者,以研究贝伐珠单抗联合FOLFOX4化疗方案的应用效果。
1 资料与方法
1.1 一般资料选取2019年1月至2021年1月平煤神马医疗集团总医院收治的98例晚期CRC患者,按照随机数字表法分为观察组(n=49)和对照组(n=49)。对照组男26例,女23例;年龄52~86(68.74±8.32)岁;肿瘤位置结肠癌19例(38.78%),直肠癌30例(61.22%);低分化腺癌7例(14.29%),中分化腺癌34例(69.33%),高分化腺癌8例(16.33%);器官转移1个26例,其中肺转移7例,肝转移12例,阴道转移1例,肾上腺转移2例,盆腔转移4例,器官转移≥2个23例。观察组男24例,女25例;年龄51~85(67.86±8.25)岁;肿瘤位置结肠癌22例(44.90%),直肠癌27例(55.10%);低分化腺癌5例(10.20%),中分化腺癌37例(75.51%),高分化腺癌7例(14.29%);器官转移1个25例,其中肺转移9例,肝转移10例,阴道转移2例,肾上腺转移2例,盆腔转移2例,器官转移≥2个24例。两组患者一般资料比较,差异无统计学意义(P>0.05)。本研究经医院医学伦理委员会审批通过。
1.2 纳入及排除标准纳入标准:(1)符合中国结直肠癌诊疗规范(2017年版)中CRC相关诊断标准[4];(2)经病理诊断、CT等影像学确诊,存在可测量病灶;(3)处于晚期阶段;(4)预计生存期>3个月;(5)患者及家属均签署知情同意书。排除标准:(1)肝、心、肾等严重器质性病变;(2)存在除CRC外其他恶性肿瘤;(3)存在多发性脑转移;(4)存在化疗禁忌证,无法耐受本研究治疗方案;(5)伴有血液系统疾病;(6)1个月内曾接受相关化疗治疗;(7)伴有免疫功能障碍;(8)伴有认知障碍或精神疾病。
1.3 研究方法
1.3.1 常规治疗 两组均接受结直肠癌治疗及营养支持等常规干预措施。
1.3.2 对照组 接受FOLFOX4化疗方案。第1天给予患者85 mg·m-2奥沙利铂(远大医药黄石飞云制药有限公司,国药准字H20103130),静脉滴注2 h;第1、2天,给予患者200 mg·m-2亚叶酸钙(上海裕信生物制药有限公司,国药准字H20020575),静脉滴注2 h;第1、2天,静脉推注400 mg·m-25-FU(山东凤凰制药股份有限公司,国药准字H20051312,规格:每支0.25 g);持续静脉滴注600 mg·m-25-FU。以2周为一个周期,共治疗6个周期。
1.3.3 观察组 接受贝伐珠单抗[Roche Pharma(Schweiz)Ltd.,注册证号S20170035]联合FOLFOX4化疗,将10 mg·kg-1贝伐珠单抗加入100 mL 9 g·L-1氯化钠注射液,每两周1次,第1次持续静脉滴注1.5 h,自第2次起持续静脉滴注1 h。FOLFOX4化疗方案同对照组。以2周为一个周期,共治疗6个周期。
1.4 疗效判定标准治疗6个周期后进行疗效评估:病灶完全消失为完全缓解;病灶减小≥50%为部分缓解;病灶减小<50%或增大≤25%为稳定;出现新病灶或病灶增大>25%为进展;客观缓解率为完全缓解与部分缓解例数之和占总例数的百分率,疾病控制率为完全缓解、部分缓解与稳定例数之和占总例数的百分率。
1.5 观察指标(1)疗效。(2)病灶直径及生存质量。分别于治疗前、治疗6个周期后,比较两组病灶直径、Karnofsky功能状态(Karnofsky performance status,KPS)评分,KPS评分计0~100分,分值越高表示生存质量越好。(3)血清肿瘤标志物水平。分别于治疗前、治疗6个周期后,抽取两组5 mL空腹静脉血,离心(4 000 r·min-1,10 min)处理,采用酶联免疫吸附测定法检测血清肿瘤标志物水平,包括基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)、癌胚抗原(carcinoembryonic antigen,CEA)、VEGF、环氧化酶-2(cyclooxygenase-2,COX-2)、糖类抗原242(cancer associated antigen-242,CA242)。(4)毒副反应,包括血液毒性、口腔炎、神经毒性、消化道反应、高血压、肝功能异常、尿蛋白及其他。
1.6 统计学方法采用SPSS 22.0统计软件对数据进行分析。计量资料以均数±标准差(±s)表示,组间比较采用独立样本t检验,计数资料以例数和百分比(%)表示,组间比较采用χ2检验或Fisher确切概率法。P<0.05为差异有统计学意义。
2 结果
2.1 两组疗效观察组客观缓解率、疾病控制率高于对照组(P<0.05)。见表1。

表1 两组疗效对比[n(%)]
2.2 两组病灶直径、KPS评分治疗前两组病灶直径、KPS评分对比,差异无统计学意义(P>0.05);治疗6个周期后两组病灶直径较治疗前减小,KPS评分较治疗前升高,且观察组病灶直径小于对照组,KPS评分高于对照组(P<0.05)。见表2。
表2 两组病灶直径、KPS评分对比(±s)

表2 两组病灶直径、KPS评分对比(±s)
注:与同组治疗前对比,a P<0.05;KPS为Karnofsky功能状态。
病灶直径KPS评分/分组别例数/cm治疗前治疗6个周期后个周期后对照组 49 4.07±1.70 3.36±1.23a 73.06±3.40 75.62±4.87治疗前治疗6 a观察组 49 4.25±1.79 2.47±1.10a 72.33±3.49 80.57±4.92a t 0.510 3.776 1.049 5.005 P 0.611<0.001 0.297<0.001
2.3 两组血清肿瘤标志物治疗前两组血清MMP-9、CEA、VEGF、COX-2、CA242水平对比,差异无统计学意义(P>0.05);治疗6个周期后两组血清MMP-9、CEA、VEGF、COX-2、CA242水平均较治疗前下降,且观察组血清 MMP-9、CEA、VEGF、COX-2、CA242水平均低于对照组(P<0.05)。见表3。
表3 两组血清肿瘤标志物对比(±s)
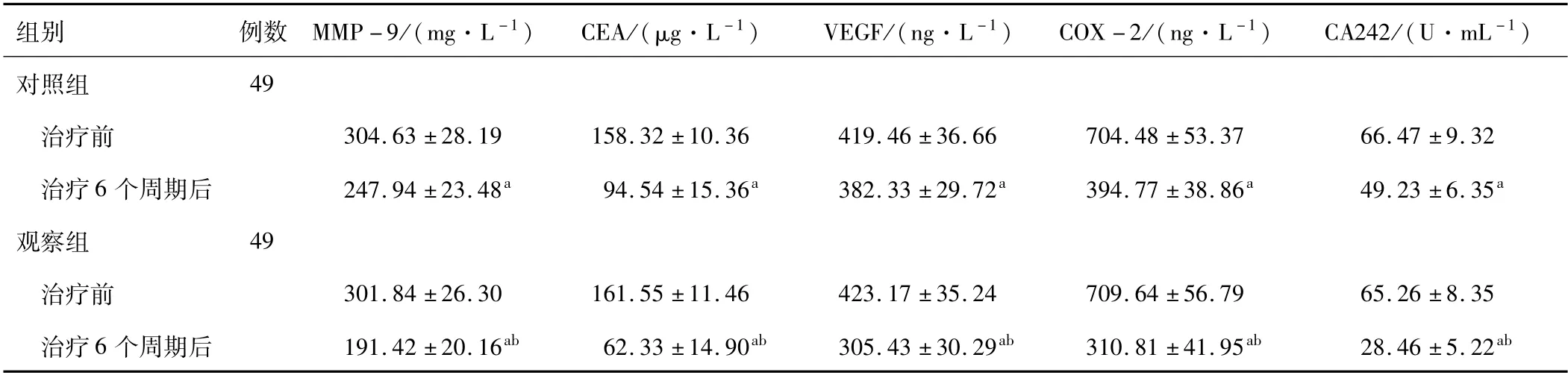
表3 两组血清肿瘤标志物对比(±s)
注:与同组治疗前对比,a P<0.05;与对照组治疗6个周期后比较,b P<0.05;MMP-9为基质金属蛋白-9;CEA为癌胚抗原;VEGF为血管生成因子;COX-2为环氧化酶-2;CA242为糖类抗原242;1 U=16.67 nkat。
组别例数 MMP-9/(mg·L-1) CEA/(μg·L-1)VEGF/(ng·L-1) COX-2/(ng·L-1)CA242/(U·mL-1)对照组49治疗前304.63±28.19 158.32±10.36 419.46±36.66 704.48±53.37 66.47±9.32治疗6个周期后247.94±23.48a 94.54±15.36a 382.33±29.72a 394.77±38.86a 49.23±6.35a观察组49治疗前301.84±26.30 161.55±11.46 423.17±35.24 709.64±56.79 65.26±8.35治疗6个周期后191.42±20.16ab 62.33±14.90ab 305.43±30.29ab 310.81±41.95ab 28.46±5.22 ab
2.4 两组毒副反应两组毒副反应(血液毒性、口腔炎、神经毒性、消化道反应、高血压、肝功能异常、尿蛋白及其他)对比,差异无统计学意义(P>0.05)。见表4。
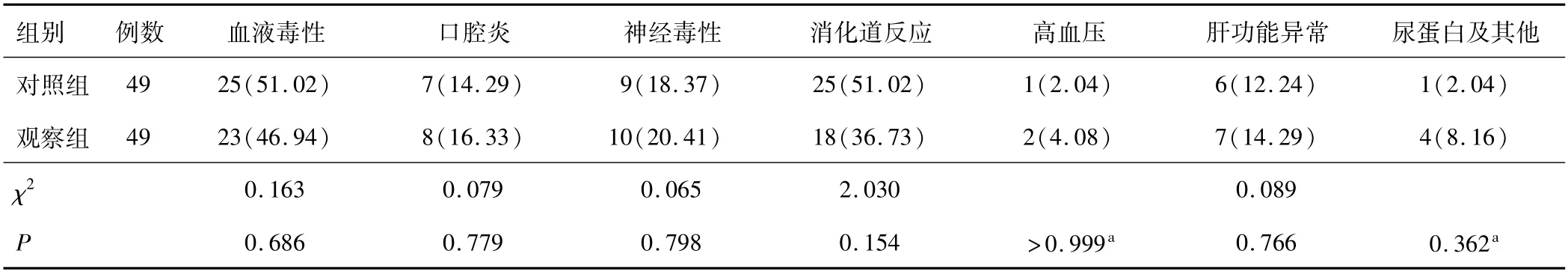
表4 两组毒副反应对比[n(%)]
3 讨论
CRC发病早期症状隐匿,且早期行切除术后复发、转移率较高,多数中晚期CRC患者已出现转移灶,累及其他组织器官,而CRC病灶转移是导致患者病死的重要因素。现阶段,FOLFOX4是晚期CRC一线化疗方案,可一定程度抑制肿瘤病灶侵袭,但其化疗效果已进入瓶颈,需探寻更为有效的治疗方案,改善患者预后,延长生存时间[5]。近年来靶向治疗联合化疗的治疗方案成为晚期CRC临床研究重点。
CRC发生、进展过程中肿瘤血管生成的作用极为重要[6]。VEGF属特异性多功能因子,直接参与肿瘤血管形成过程,具有促血管内皮细胞生长、促新血管形成的作用,是调节血管生成的关键因子[7]。贝伐珠单抗为针对VEGF的单克隆抗体,以VEGF为靶点,竞争性结合相关受体,抑制VEGF通路,干扰内肿瘤血管皮细胞生长分裂,同时减少新生血管,肿瘤细胞无法获取增殖所需养分而逐渐凋亡,进而控制晚期CRC病情[8]。此外有研究显示,贝伐珠单抗还可改善血管通透性、减小组织间隙压,提高肿瘤细胞内化疗药物浓度,进一步促使肿瘤血管正常化;贝伐珠单抗针对性结合CRC分子靶点,既可抑制癌细胞活性,又尽可能地降低机体正常细胞的毒副反应[9]。本研究结果显示,观察组客观缓解率、疾病控制率高于对照组,治疗6个周期后观察组病灶直径小于对照组,KPS评分高于对照组;两组毒副反应对比,差异无统计学意义。由此可见,贝伐珠单抗联合FOLFOX4化疗治疗晚期CRC患者疗效确切,可促进病灶减小,提高患者生存质量。原因可能为贝伐珠单抗与FOLFOX4化疗联用有利于调整病灶脉管系统,扭曲肿瘤组织结构,提高药物运输效率并促进药物吸收,进一步抑制肿瘤病灶进展、侵袭[10]。
相关研究显示,MMP-9属基质金属蛋白酶,可降解细胞外基质,参与肿瘤细胞生长、发育、转移等过程,在CRC病情进展中发挥重要作用;当CRC发生时,CEA呈高表达,是肿瘤病灶发生、侵袭系统性治疗过程中的重要监测指标[11]。COX-2属诱导性酶,在正常情况下表达极低,其水平与消化系统肿瘤联系密切,CRC发生时COX-2呈上升趋势,可反映CRC患者肿瘤情况;CA242属糖类抗原,其水平与CRC病情进展呈正相关,在CRC患者抗肿瘤免疫功能中发挥重要作用[12]。本研究结果显示,治疗6个周期后观察组血清MMP-9、CEA、VEGF、COX-2、CA242水平均低于对照组,提示贝伐珠单抗联合FOLFOX4化疗治疗晚期CRC可有效降低血清肿瘤标志物水平,对患者病情控制具有积极意义。原因可能在于,相对于单独化疗,加用贝伐珠单抗有利于提高肿瘤内部FOLFOX4化疗渗透作用,抑制血清MMP-9、CEA、VEGF、COX-2、CA242分泌,增强抗肿瘤效果[13]。
综上所述,贝伐珠单抗联合FOLFOX4化疗治疗晚期CRC患者疗效确切,可有效降低血清肿瘤标志物水平,促进病灶减小,提高患者生存质量。
