Toll样受体4、色素瘤核蛋白18、HMBOX1表达与子宫内膜癌病理分期、组织学分级的关系
2022-04-18张涛涛任志敏吕祥瑞
张涛涛,任志敏,吕祥瑞
(1.焦作市人民医院病理科,河南 焦作 454350;2.郑州市妇幼保健院病理科,河南 郑州 450000)
子宫内膜癌是女性最常见的生殖系统恶性肿瘤,严重威胁患者生命健康。目前关于子宫内膜癌发生机制尚未完全明确,可能与分子调控机制有关。Toll样受体4(toll-like receptor 4,TLR4)是最早发现的Toll样受体亚型之一,与炎症感染、组织纤维化疾病、恶性肿瘤发生和发展有关[1-2]。黑色素瘤核蛋白18(melanoma nuclear protein 18,Mel-18)是PcG家族重要成员之一,在恶性肿瘤发生和发展中起到重要作用。HMBOX1是2006年从人胰腺cDNA文库分离出来的新基因,是一种潜在的核转录因子,能发挥转录抑制活性[3-4]。目前我国关于HMBOX1研究较少,其与恶性肿瘤的研究尚处于探索中[5]。本研究选取子宫内膜癌患者作为研究对象,分析TLR4、Mel-18、HMBOX1表达与子宫内膜癌病理分期、组织学分级的关系,报告如下。
1 资料与方法
1.1 一般资料选取焦作市人民医院2018年6月至2020年1月收诊的42例子宫内膜癌患者。子宫内膜癌病理分期Ⅰ期23例,Ⅱ期10例,Ⅲ期7例,Ⅳ期2例。组织学分级G1级30例,G2级8例,G3级4例。年龄21~69岁,中位年龄为43.58岁。
1.2 选取标准纳入标准:(1)经病理诊断确诊为子宫内膜;(2)首次确诊;(3)未接受治疗;(4)既往病史清晰。排除标准:(1)合并其他恶性肿瘤;(2)抑郁症;(3)妊娠期、哺乳期或有计划妊娠;(4)全身免疫性疾病;(5)活动性出血。
1.3 研究方法
1.3.1 收集患者年龄、病理分期和组织学分级。
1.3.2 Mel-18表达 获取患者子宫内膜癌组织,常规处理标本,构建Mel-18过表达细胞系及对照组细胞系,PBS洗涤3次,更换培养基,使用Western blot法检测Mel-18在细胞中的表达量。
1.3.3 TLR4表达 石蜡包裹子宫内膜癌组织标本,进行4μm连续切片,室内孵育20 min,PBS洗涤3次,加入二抗,使用免疫组化法检测TLR4水平。
1.3.4 HMBOX1表达 子宫内膜癌组织常规处理后,建立HMBOX1细胞系(北京生物有限公司),使用免疫组化法和流式细胞仪检测HMBOX1表达。
1.3.5 TLR4、Mel-18、HMBOX1表达阳性标准 选择5个视野,每个视野计数100个肿瘤细胞,根据阳性细胞比例和着色情况积分[6]判断。1分为阳性细胞比例≤25%;2分为阳性细胞比例为26% ~50%;3分为阳性细胞比例>50%。着色程度:无为0分;淡黄色为1分;棕黄色为2分;深棕色为3分。二者乘积≥2分为阳性(+),≤1分为阴性(-)。
1.4 统计学方法采用SPSS 19.00统计软件处理数据。TLR4、Mel-18、HMBOX1、分期和分级以例数和百分数(%)表示,采用χ2检验;采用Spearman相关性分析进行相关性检验。P<0.05为差异有统计学意义。
2 结果
2.1 子宫内膜癌患者TLR4表达不同组织学分级和病理分期的子宫内膜癌患者TLR4阳性和阴性率表达比较,差异无统计学意义(P>0.05)。见表1。

表1 子宫内膜癌患者TLR4表达比较[n(%)]
2.2 子宫内膜癌患者Mel-18表达不同组织学分级的子宫内膜癌患者Mel-18表达阳性和阴性率比较,差异无统计学意义(P>0.05)。不同病理分期的子宫内膜癌患者Mel-18阳性和阴性表达率比较,差异有统计学意义(P<0.05)。见表2。

表2 子宫内膜癌患者Mel-18表达比较[n(%)]
2.3 子宫内膜癌患者HMBOX1表达不同组织学分级的子宫内膜癌患者HMBOX1阳性和阴性表达率比较,差异无统计学意义(P>0.05)。不同病理学分期的子宫内膜癌患者HMBOX1阳性和阴性表达率比较,差异有统计学意义(P<0.05)。见表3。
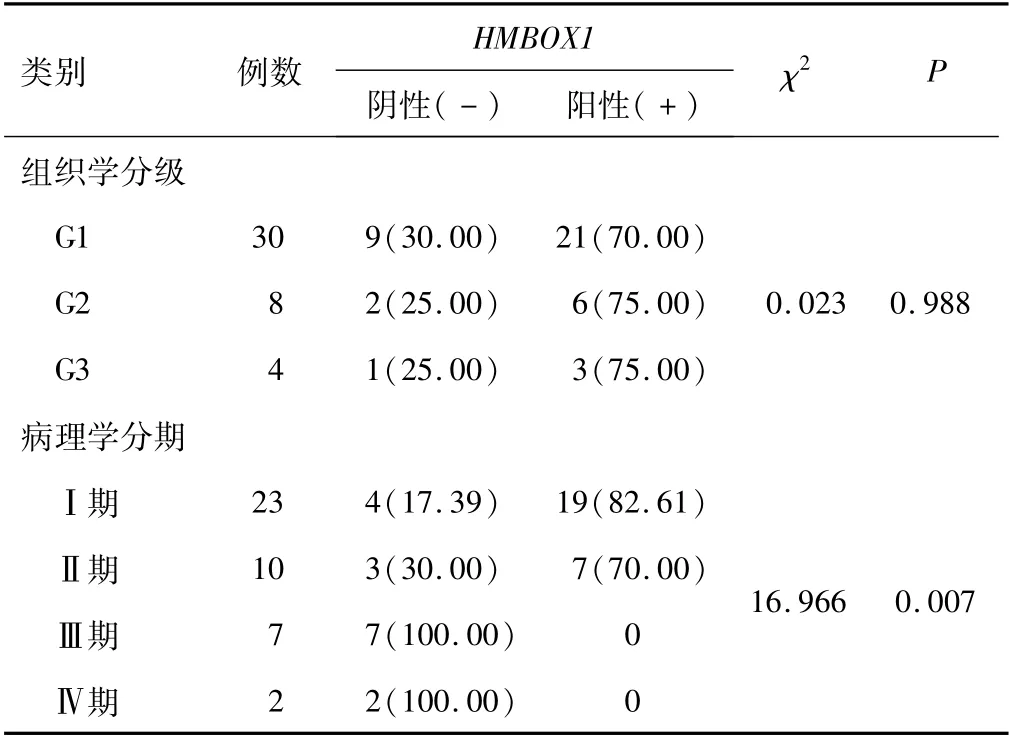
表3 子宫内膜癌患者HMBOX1表达比较[n(%)]
2.4 TLR4、Mel-18、HMBOX1表达与子宫内膜癌病理分期、组织学分级的关系TLR4表达与子宫内膜癌病理分期、组织学分级无关(P>0.05)。Mel-18表达与子宫内膜癌病理学分期关系密切(P<0.05),与组织学分级无关(P>0.05)。HMBOX1表达与子宫内膜癌病理分期、组织学分级关系密切(P<0.05)。见表4。

表4 TLR4、Mel-18、HMBOX1表达与子宫内膜癌病理分期、组织学分级的关系
2.5 TLR4、Mel-18、HMBOX1阳性表达相关性分析TLR4、Mel-18、HMBOX1两两分析结果显示,TLR4、Mel-18、HMBOX1之间呈正相关(P<0.05)。见表5。

表5 TLR4、Mel-18、HMBOX1阳性表达相关性分析
3 讨论
子宫内膜癌是临床常见恶性肿瘤,严重影响女性患者生命健康。子宫内膜癌的发生由多种因素共同导致[7-11]。HMBOX1基因通过同源分子共同来调节其他基因的转录,从而发挥其分子生物学效应,与器官发育关系密切。其作用机制是通过调控其他部位发育基因,包括细胞分裂和纺锤体等,并在恶性肿瘤中表达[12-13]。TLR是Ⅰ类跨膜受体,属病原相关分子模式受体,主要分布在中性粒细胞和单核吞噬细胞中。TLR4主要分布在各类免疫细胞,介导免疫和炎症反应,在多种恶性肿瘤中高表达[14]。Mel-18主要表达于各种来源的肿瘤细胞和转化细胞,其基因产物可能与细胞增殖有关,可能促进肿瘤细胞的增殖[15]。
本研究结果显示,不同组织学分级和病理分期的子宫内膜癌患者TLR4表达无差异。不同组织学分级的子宫内膜癌患者Mel-18表达无差异,但不同病理分期的子宫内膜癌患者Mel-18表达差异有统计学意义。不同组织学分级和病理分期的子宫内膜癌患者HMBOX1表达差异有统计学意义。Mel-18最初是由B16小鼠黑色素瘤细胞克隆而来,主要表达在各种来源肿瘤细胞和转化细胞中,参与细胞增殖和肿瘤发生及发展。随着对Mel-18研究的不断深入,发现Mel-18和Bmi-1基因在功能上存在重叠效应,均可发挥促癌、促炎作用[16-17]。在子宫内膜中单独抑制Mel-18表达可抑制肿瘤细胞增殖和克隆形成,进而影响病理分期。TLR4表达与子宫内膜癌病理分期、组织学分级无关,Mel-18表达与病理学分期关系密切。原因可能是Mel-18包含342个氨基酸,与Bmi-1基因产物结构高度相似,同源性高达93%,参与细胞增殖和肿瘤的发生发展,主要表达于肿瘤细胞和转化细胞中,能够促进肿瘤细胞的增殖。HMBOX1阳性表达与子宫内膜癌病理分期、组织学分级关系密切。TLR4主要介导内毒素的信号转导,外来刺激与靶细胞会促使其大量释放,进而引发炎症因子的“瀑链式”释放,进而加重病情。Mel-18、HMBOX1能促使子宫内膜癌细胞的生长,促使细胞浸润,故而与病理分期关系密切。TLR4可以介导病毒、炎症因子、肿瘤细胞的信号传导。本研究结果显示,TLR4、Mel-18、HMBOX1两两之间呈正相关。TLR4介导天然免疫,参与多种疾病发生和发展,其在部分恶性肿瘤组织及血清中高表达,能促使肿瘤细胞脱离本体,进行远处转移。Mel-18基因在恶性肿瘤组织中表达异常,其产物会促使癌细胞增殖能力增强。肿瘤细胞游走能力、增殖能力增强会促使病情进展,使得宫颈组织病变加重,HMBOX1表达随之升高。
综上所述,Mel-18、HMBOX1及TLR4表达协同影响子宫内膜癌病理分期、组织学分级,密切观察Mel-18、HMBOX1表达情况可预测病情。
