Ti3C2Tx/MnO2正极在水系锌电池中的电化学性能
2022-04-18杨贝贝杜妍妍张宇霖陈婷婷陆洪彬夏永姚
杨贝贝 杜妍妍 张宇霖 陈婷婷 宾 端*, 陆洪彬*,,2 夏永姚
(1南通大学化学化工学院,南通 226019)
(2南京大学海安高新技术研究院,南通 226634)
(3复旦大学化学系,上海 200433)
0 引言
自1994年加拿大科学家Dahn首次报道水系锂离子电池以来,水系电池逐渐受到人们的广泛关注[1]。水系电池的出现解决了传统锂离子电池面临的最重要的几个挑战,相比于易燃的有机电解质,它有以下几个优势[2⁃6]:(1)以水作为电解液溶剂能有效地避免火灾和爆炸等事故的发生;(2)水和水溶性电解质盐的成本相对较低且更环保;(3)水系电池的制备和操作流程相对简单,避免了复杂的生产工艺;(4)水溶液电解液的离子电导率比有机电解液提高了几个数量级,电池的功率密度有望得到提高。基于这些优势,水系电池从最初的水系锂离子电池拓展到可嵌入的钠、钾、氢、镁、锌和铝等水系离子电池。而在众多的离子中,锌元素储量丰富,在地壳中的含量占比约为0.013%,开发成本较低。此外,金属锌负极不仅具有较低的电极电位(−0.76 V vs SHE),而且具有足够高的质量比容量(820 mAh·g−1)和体积比容量(5 851 mAh·cm−3)[7⁃9]。基于以上优势,水系锌电池或将成为未来最有潜能的大型储能装置。
水系锌电池的正极材料主要是锰基材料、钒基化合物、有机物和普鲁士蓝等化合物[10⁃14]。其中二氧化锰(MnO2)的生产成本低廉且环境友好,同时由于锰元素的多种可变价态,其在传统的锂离子和钠离子电池以及超级电容器领域具备优异的离子储存性能。2012年,康飞宇课题组采用三电极体系发现α⁃MnO2在Zn(NO3)2电解液中能可逆地储存和释放锌离子[15]。随后报道的各种结构的MnO2,如隧道结构(α、β、γ和R型斜方锰矿型结构)、层状结构(δ型)、尖晶石结构(λ型)以及其他锰基氧化物等均可用作水系锌电池正极材料[16⁃21]。然而,MnO2正极在电化学反应过程中极易发生结构转化和锰的溶解,电化学循环过程中层状结构容易崩塌,造成电池循环寿命差。因此,MnO2用于水系锌电池正极材料还面临着诸多挑战。为抑制锰的溶解,刘俊团队通过在 2 mol·L−1ZnSO4电解液中添加 MnSO4,控制锰离子的溶解−沉积平衡,在一定程度上抑制了MnO2电极的溶解[22]。此外,夏永姚团队通过有机/无机界面反应的插层方法,在层状的MnO2之间构建一个聚苯胺的有机物支柱,这种聚苯胺插层的MnO2复合材料显著提高了MnO2电极材料的比容量和倍率性能,并有效抑制了锰的溶解[23]。胡勇胜团队近期构建了一种含惰性阳离子的22 mol·L−1三氟甲基磺酸四乙基铵(TEAOTf)和 9 mol·L−1三氟甲烷磺酸钠(NaOTf)超高盐浓度电解液用于水系钠离子电池体系,采用该电解液组装的NaMnHCF//NaTiOPO4全电池无论在低倍率(0.25C)还是高倍率(1C)条件下均表现出优异的电化学性能,明显地抑制了正极普鲁士蓝中锰的溶解[24]。除此之外,Zhang等使用一种高浓度的双三氟甲磺酰亚胺锂盐包水电解液(21 mol·L−1LiTFSI),MnO2正极在这种电解液中具有更高的工作电位和更好的稳定性,其在电解液中的溶解情况明显受到抑制[25]。但是目前LiTFSI的生产成本较高,且MnO2的储存机制和方式尚未探究清楚,对于通过嵌入机制储能的MnO2电极来说,如何提高MnO2结构稳定性仍然是当前水系锌锰电池需要解决的关键问题。
MXene是一种新型的二维层状结构材料,其高电导率和大比表面积特性使其在电催化、超级电容器以及二次电池电极材料等电化学储能领域中显示出重要的应用前景[26⁃28]。而Ti3C2Tx作为MXene材料的一种,可通过LiF+HCl溶液刻蚀法获得,经常被用作合适的赝电容电极材料。例如2016年,Raghavan等报道了一种MXene/MnO2纳米晶须状的复合材料,其用作赝电容正极材料获得了优异的法拉第电容和循环稳定性[29]。因此,Ti3C2Tx的引入在一定程度上可以增强MnO2的电子转移能力,提高其导电性,同时也可作为有效的载体来抑制MnO2在电化学反应过程中的结构崩塌[30⁃31]。基于Ti3C2Tx材料所表现的优异性能,可构建一种Ti3C2Tx/MnO2复合电极材料应用于水系锌电池。
我们通过两步法制备出一种花苞状结构的MnO2负载在Ti3C2Tx结构中,随后详细研究了Ti3C2Tx/MnO2电极材料在不同水系电解液中的电化学行为。结果表明,当采用一种新型的含惰性阳离子的超高浓度盐包水电解液(30 mol·L−1TEAOTf+1 mol·L−1ZnOTf)时,其对应电池的放电比容量虽然小于在微酸性的ZnSO4溶液中的比容量,但是Ti3C2Tx/MnO2电极的循环稳定性得到显著提升,说明该电解液的使用明显地抑制了电极反应过程中锰的溶解。此外,不同充放电状态下的X射线衍射(XRD)测试结果表明,Ti3C2Tx/MnO2电极在高浓度电解液中具有明显的可逆性,且没有伴随着碱式硫酸锌相的生成。
1 实验部分
1.1 主要仪器和试剂
主要试剂包括钛碳化铝(Ti3AlC2,分析纯,麦克林试剂有限公司)、LiF(分析纯,阿拉丁试剂有限公司)、浓盐酸(HCl,分析纯,国药试剂集团有限公司)、高锰酸钾(KMnO4,分析纯,国药试剂集团有限公司)、硫酸锰(MnSO4,分析纯,阿拉丁试剂有限公司)、七水合硫酸锌(ZnSO4·7H2O,分析纯,阿拉丁试剂有限公司)、ZnOTf(分析纯,麦克林试剂有限公司)、TEAOTf(优级纯,中科院兰州化物所)。
1.2 Ti3C2Tx的制备
为了制备Ti3C2Tx层状结构,采用HCl和LiF混合溶液来刻蚀去除Ti3AlC2前驱体的MAX相。首先将 1 g LiF缓慢加入 20 mL HCl(9 mol·L−1)溶液中,随后将混合溶液在35℃下搅拌0.5 h,直至刻蚀溶液完全透明。然后,将Ti3AlC2缓慢滴加到溶液中,在恒温下搅拌24 h,得到悬浮的黑色溶液,再将溶液用去离子水和乙醇分别离心洗涤3次,直至上清液的pH=6,最后真空烘干12 h得到干燥的Ti3C2Tx粉末。
1.3 Ti3C2Tx/MnO2复合材料的制备
将200 mg的Ti3C2Tx溶于50 mL水中超声搅拌2 h,再加入0.236 6 g MnSO4超声搅拌10 min,再转移到60℃下搅拌0.5 h,最后加入0.145 g KMnO4加热搅拌1 h,得到液体样品,进行抽滤,再将样品烘干12 h,最终取得固体粉末样品(Ti3C2Tx和MnO2的质量比为1∶1)。物质的量之比按以下化学方程式进行计算:
2KMnO4+3MnSO4+2H2O→5MnO2+2H2SO4+K2SO4
此外,单独MnO2正极材料合成过程与上述基本相同,不同的是没有加入Ti3C2Tx作为载体。
1.4 材料的表征分析和电化学性能测试
采用X射线粉末衍射仪测试材料的相结构,工作电压和电流分别为40 kV和40 mA,辐射源为CuKα,波长λ=0.154 06 nm,扫描范围为10°~70°,扫描速度为0.02(°)·s−1。采用Gemini SEM场发射扫描电镜(SEM,加速电压3 kV)和透射电子显微镜(TEM,Talos F200X,200 kV)分析材料的微观结构和形貌。采用Nicolet 6700傅里叶变换红外光谱(FT⁃IR)分析材料的结构,材料与KBr按照1∶1的质量比进行压片。采用日本JSM⁃6510型X射线光电子能谱仪(XPS)对复合材料的成分和价态进行分析。
电池极片的制备:正极材料的制备通过擀膜完成,将活性物质(粉末状材料)、乙炔黑(AB)和聚四氟乙烯(PTFE)黏结剂按照8∶1∶1的质量比在异丙醇中混合均匀,在对辊机上压制成一定厚度的膜,烘干后将得到的膜切片称量后压在钛网上制备成电极片,活性物质的质量为2~3 mg·cm−2。配制不同组分的电解液,组装成标准的CR2016纽扣电池,电池组装顺序由下至上完成,即制备好的电极片、隔膜、电解液、裁剪好的锌片,电池封装。循环伏安(CV)曲线是在CHI 660E电化学工作站上测试得到,扫描速率为0.2 mV·s−1,电压范围为1.0~1.8 V。所有恒电流充放电测试和循环稳定性测试均是在CT2001电池测试系统(武汉蓝电电子股份有限公司)上进行。所有电化学测试均在25℃恒温箱中进行。
2 结果与讨论
2.1 材料的物理表征
首先我们将第一步制备的Ti3C2Tx材料进行形貌表征,结果如图S1(Surpporting information)所示。SEM结果表明Ti3C2Tx具有片状的二维层状结构(图S1a),TEM图显示其表面平整,分布均匀,纳米片层间空隙较大,形成了丰富的孔隙结构(图S1b)。另外,由图1a和1b可以看出,复合后的Ti3C2Tx/MnO2是由纳米片层重叠和组装形成的三维花苞形状。图1c和1d中的TEM图显示晶须状结构的MnO2嵌在Ti3C2Tx的层状结构中并且分布良好。为了分析三维花苞结构的元素组成,对Ti3C2Tx/MnO2复合材料进行元素能谱分析,结果如图1e所示,复合材料中C、Ti、Mn和O四种元素都均匀分布在整个花苞结构中。

图1 Ti3C2Tx/MnO2复合材料的(a、b)SEM图、(c、d)TEM图和(e)元素映射图Fig.1 (a,b)SEM images,(c,d)TEM images,and(e)element mappings of Ti3C2Tx/MnO2composite
随后,采用XRD和XPS手段来表征Ti3C2Tx/MnO2复合材料的晶体结构、成分和价态分布。由图2a可知,相比于Ti3C2Tx,Ti3C2Tx/MnO2的特征峰略微偏移且MnO2的部分特征峰与原来的Ti3C2Tx相重叠。对照MnO2的PDF卡片可知,在34.4°、37.7°、41.4°和65.1°处出现的衍射峰,分别对应MnO2的(301)、(400)、(211)和(020)晶面(PDF No.42⁃1316),而 44.7°处出现的峰为原本的Ti3C2Tx特征衍射峰。图2b显示的是Ti3C2Tx/MnO2复合材料的XPS全谱图,从图中观察到材料中C、Ti、Mn和O四种元素的峰。图2c为Ti3C2Tx/MnO2复合材料中Ti2p高分辨XPS谱图,图中可以发现位于463.3和457.6 eV处的2个明显的拟合峰,分别对应 Ti—C(Ti2p1/2)和 Ti—C(Ti2p3/2)的振动峰[32]。在C1s的高分辨XPS谱图中观察到,结合能位于288.1、285.7、284.4 eV的峰分别来自Ti3C2Tx结构中的C—O、C—Ti和C=C键。Mn2pXPS谱图如图2e所示,其结合能在653.1和641.7 eV处的2个拟合峰分别对应Mn2p1/2和Mn2p3/2,来自MnO2中+4价的Mn。图2f的O1sXPS谱图显示了MnO2结构中Mn—O—Mn键和Mn—O—H键在530.7和529.3 eV处的结合能特征峰[33]。此外,我们采用红外光谱来验证MnO2和Ti3C2Tx的分子振动特征,如图S2所示。Ti3C2Tx/MnO2、Ti3C2Tx和MnO2均在1 624和3 432 cm−1处出现夹层或吸附水分子的弯曲振动和O—H收缩振动峰[34⁃35]。在 Ti3C2Tx中出现了Ti—O和Ti—C键的伸缩振动峰,而且在Ti3C2Tx/MnO2复合材料中出现了Mn—O键的弯曲振动峰。这些结果进一步说明了Ti3C2Tx/MnO2的成功复合[36]。

图2 (a)Ti3C2Tx和Ti3C2Tx/MnO2复合材料的XRD图;Ti3C2Tx/MnO2复合材料的(b)XPS全谱图及(c~f)高分辨XPS谱图Fig.2 (a)XRD patterns of Ti3C2Txand Ti3C2Tx/MnO2composite;(b)XPS survey spectra and(c⁃f)high⁃resolution XPS spectra of Ti3C2Tx/MnO2composite
2.2.1 Ti3C2Tx/MnO2电极在4种电解液中的CV曲线
以Ti3C2Tx/MnO2复合材料为正极,匹配锌负极组装成水系锌电池,测试其在不同电解液中的电化学性能差异。图3为Ti3C2Tx/MnO2电极前3圈的CV曲线。从图中可以看到,在 2 mol·L−1ZnSO4和 2 mol·L−1ZnSO4+0.1 mol·L−1MnSO4电解液中(图 3a和 3b),第2圈的还原过程中均在1.4 V左右出现一个明显的还原峰,这是由于弱酸性的环境中质子较多,发生了明显的质子嵌入,这与之前文献报道的MnO2嵌入反应相一致[21⁃22]。而在1.2 V左右出现的另一个还原峰是由于电解液中锌离子嵌入到MnO2结构中。同时在第2圈的氧化过程中,也出现了锌离子和质子的可逆脱出(对应2个氧化峰,1.60和1.63 V)。在偏中性的 3 mol·L−1ZnOTf电解液中(图 3c),溶液中同样存在电离产生的质子,当第2圈的电位继续负向扫描时,同样也在1.4 V左右出现一个较弱的还原峰,这可能也对应质子的嵌入,而在扫描至1.15 V时出现了锌离子的嵌入还原峰[37]。而当以30 mol·L−1TEAOTf+1 mol·L−1ZnOTf作 为电解液时,Ti3C2Tx/MnO2电极在电位的扫描过程中氧化峰向高电位正向移动,还原峰向低电位负向移动,这是由于高浓度电解液使得电解液中的嵌入脱出电位发生变化。而通过图3d可以看到,使用高浓度电解液时较难产生质子嵌入MnO2结构中。
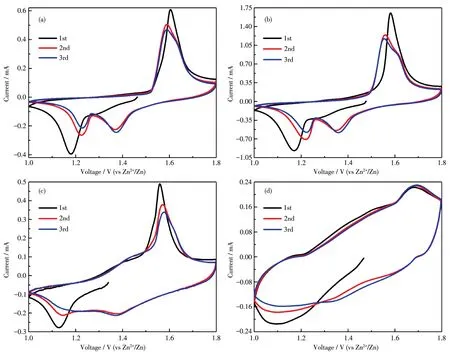
图3 Ti3C2Tx/MnO2电极在不同电解液中的前3圈CV曲线Fig.3 CV curves of initial three cycles on Ti3C2Tx/MnO2electrode
图4是Ti3C2Tx/MnO2正极构建的水系锌电池在1.0~1.8 V电压区间的充放电性能测试,电流密度为0.2 A·g−1。可以看到,放电平台与之前的CV曲线出现的还原峰位置一致。在 2 mol·L−1ZnSO4和 2 mol·L−1ZnSO4+0.1 mol·L−1MnSO4电解液中,首圈的放电过程中均出现了2个放电平台,对应锌离子和质子的共嵌入过程(图4a和4b)。随后的2圈充放电过程中继续发生共嵌入反应。而在第2圈的充放电曲线中,2 mol·L−1ZnSO4电解液中的Ti3C2Tx/MnO2电极可产生236.3 mAh·g−1的放电比容量,而充电比容量达到282.9 mAh·g−1,说明副反应的产生导致电极的可逆性较差。而在2 mol·L−1ZnSO4+0.1 mol·L−1MnSO4电解液中,Ti3C2Tx/MnO2电极第2圈的放电比容量为231.7 mAh·g−1,随后充电比容量可达到 245.8 mAh·g−1,说明以MnSO4作为添加剂在一定程度上提高了电极的可逆性。此外,通过测试电极在2种电解液中的循环稳定性(图S3a和S3b),发现添加MnSO4的电解液中电极的循环稳定性(容量保持率为41.8%)明显好于仅有ZnSO4的电解液(容量保持率为23.1%)。事实上,之前的研究报告证明了采用这种可溶性的MnSO4作为添加剂加入到ZnSO4电解液中,可以在一定程度上抑制MnO2在电化学反应过程中的溶解[22⁃23]。在中性的 3 mol·L−1ZnOTf电解液中(图4c),Ti3C2Tx/MnO2电极第2圈的放电比容量为201.2 mAh·g−1,充电比容量为222.5 mAh·g−1,其放电比容量明显少于微酸性的ZnSO4电解液,这可能是由于在这种电解液中质子嵌入的比容量贡献较少。而且小电流循环100圈后(图S3c),Ti3C2Tx/MnO2具有更好的循环稳定性,其比容量保持率为47.3%。考虑到Ti3C2Tx/MnO2电极的循环稳定性仍然较差,我们构建了一种含有惰性阳离子的盐包水电解液(30 mol·L−1TEAOTf+1 mol·L−1ZnOTf),以期改善其稳定性。由于TEA+阳离子的半径较大且浓度较高,电极材料不易在高浓度电解液中发生质子的嵌入和其他阳离子的嵌入,导致质子的比容量贡献很少。所以,电极在第2圈充放电过程中充放电比容量均有所降低,放电比容量和充电比容量分别为151.9和156.1 mAh·g−1(图 4d)。虽然其比容量明显低于上述3种电解液,但其电极的可逆性明显增强,库仑效率可达到97.3%,表明Ti3C2Tx/MnO2电极发生的副反应更少。通过对该电池体系循环稳定性测试,可以发现,经过100圈的充放电测试之后,其比容量保持率高达78.3%,且整个过程中的库仑效率可达90%以上(图S3d)。上述结果表明惰性盐包水电解液的使用能够明显抑制Ti3C2Tx/MnO2电极其他副反应的发生以及锰的溶解,从而提高电极材料的稳定性。
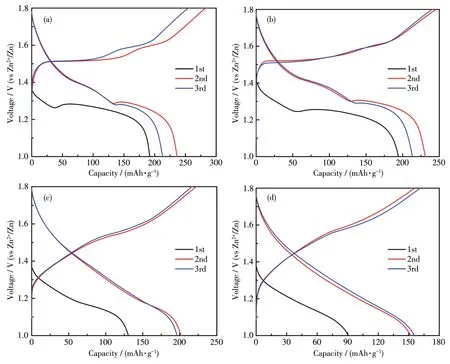
图4 Ti3C2Tx/MnO2电极以0.2 A·g−1电流密度在不同电解液中的前3圈的恒流充放电曲线Fig.4 Galvanostatic charge⁃discharge profiles of Ti3C2Tx/MnO2cathode at a current density of 0.2 A·g−1in different electrolytes
为了评估单独Ti3C2Tx材料是否具备储锌能力,我们测试了 Zn/Ti3C2Tx在 2 mol·L−1ZnSO4电解液中的充放电曲线,结果如图S4所示。单独的MXene的可逆性很差,且比容量极低,由于MXene可能对氧析出反应具有一定的电催化效果,其充电比容量较高,而放电比容量很低,说明单独MXene几乎不能作为正极储锌,这与之前文章报道的结果相一致,即其可逆比容量不到20 mAh·g−1[38]。此外,我们还测试了Ti3C2Tx/MnO2正极在1 A·g−1电流密度下的长循环稳定性,结果如图S5所示,在 30 mol·L−1TEAOTf+1 mol·L−1ZnOTf电解液中经过长达 2 000圈的循环后,Ti3C2Tx/MnO2电极保持着64.1%的比容量(比容量从 82.4 mAh·g−1衰减到 52.8 mAh·g−1),明显高于2 mol·L−1ZnSO4电解液中的34.6%,2 mol·L−1ZnSO4+0.1 mol·L−1MnSO4电解液中的 38.3% 和 3 mol·L−1ZnOTf电解液中的43.5%。为了研究Ti3C2Tx/MnO2正极材料形貌结构的稳定性,我们分别测试了Ti3C2Tx/MnO2在 30 mol·L−1TEAOTf+1 mol·L−1ZnOTf电解液中循环1 000和2 000圈后的TEM图,结果如图S6所示。从图中可观察到,无论是循环1 000圈还是2 000圈,其形貌还是维持整体的花苞结构,没有发生明显坍塌,说明其在这种电解液中具有较好的循环稳定性。为了进一步验证高浓度电解液对MnO2电极的影响,进一步测试其在2 mol·L−1ZnSO4电解液和 30 mol·L−1TEAOTf+1 mol·L−1ZnOTf电解液中的循环稳定性(电流密度为1 A·g−1),其结果如图S7所示。由图可知,在ZnSO4溶液中MnO2电极开始具有较高的放电比容量,可是循环500圈之后,其比容量保持率仅为24.2%。而 在 30 mol·L−1TEAOTf+1 mol·L−1ZnOTf电解液中,MnO2电极初始的放电比容量为64.0 mAh·g−1,循环500圈后的容量保持率为58.1%。说明即使没有Ti3C2Tx作为载体,这种高浓度电解液依然能够在一定程度上抑制锰的溶解,而通过与Ti3C2Tx复合后,其稳定性进一步提升。
随后我们测试了Ti3C2Tx/MnO2电极在4种电解液中的倍率性能,结果如图5所示。在2 mol·L−1ZnSO4溶液中(图5a和5b),该水系锌电池在0.2 A·g−1电流密度下的放电比容量为201.6 mAh·g−1,当电流密度依次增大到0.3、0.5、1和2 A·g−1时,其放电比容量分别为 160.0、123.8、88.5和 59.5 mAh·g−1,2 A·g−1电流密度下的比容量保持为0.2 A·g−1时的29.5%。在 2 mol·L−1ZnSO4+0.1 mol·L−1MnSO4溶液中(图 5c和 5d),Ti3C2Tx/MnO2电极在 0.2、0.3、0.5、1和 2 A·g−1电流密度下的比容量分别为197.0、157.8、124.1、92.3 和 67.4 mAh·g−1,其在 2 A·g−1电流密度下的比容量为 0.2 A·g−1时的 34.7%,说明添加 MnSO4一定程度上增加了锌离子扩散速率,提升了其倍率性能。此外,在 3 mol·L−1ZnOTf溶液中(图 5e 和 5f),Ti3C2Tx/MnO2电极在0.2、0.3、0.5、1和2 A·g−1电流密度下的比容量分别为 183.6、155.2、122.8、89.7和61.7 mAh·g−1,其在 2 A·g−1电流密度下的比容量为0.2 A·g−1时的 33.6%。Ti3C2Tx/MnO2电极在 30 mol·L−1TEAOTf+1 mol·L−1ZnOTf电解液中的倍率性能如图5g和5h所示,在0.2 A·g−1的电流密度下,其放电比容量可达169.3 mAh·g−1。同时,在电流密度为0.3、0.5、1和 2 A·g−1时,放电比容量分别为 146.3、114.5、78.3和50.5 mAh·g−1,其在2 A·g−1电流密度下的比容量保持为0.2 A·g−1时的29.8%。结果表明,高浓度惰性电解液的使用并没有改善Ti3C2Tx/MnO2电极的倍率性能,这可能是由于高浓度电解液的电导率较低和溶液黏度较高,导致离子扩散速率慢[39]。

图5 Ti3C2Tx/MnO2电极以不同电流密度在不同电解液中的(a、c、e、g)恒流充放电曲线和(b、d、f、g)倍率性能Fig.5 (a,c,e,g)Galvanostatic charge⁃discharge profiles and(b,d,f,g)rate performance of Ti3C2Tx/MnO2cathode at different current densities in different electrolytes
为了探究Ti3C2Tx/MnO2电极在稀ZnSO4和高浓度电解液中的结构变化,我们通过非原位XRD表征了电极前2圈充放电过程中的晶体结构变化。如图6所示,在2 mol·L−1ZnSO4电解液中,首次放电到1.0 V时(图6a),电极表面出现了大量Zn(OH)2)3(ZnSO4)(H2O)5相的特征衍射峰(图6b)。这是由于稀ZnSO4电解液呈弱酸性,容易发生质子的嵌入,而电解液中的OH−随后与ZnSO4发生反应生成Zn(OH)2)3(ZnSO4)(H2O)5。当充电到1.8 V时,Zn(OH)2)3(ZnSO4)(H2O)5的峰也随着消失,而再次放电时,又重新出现。这些结果再一次表明,质子的嵌入和脱出是发生在整个充放电过程中且高度可逆。此外,我们也研究了Ti3C2Tx/MnO2电 极 在 30 mol·L−1TEAOTf+1 mol·L−1ZnOTf电解液中不同充放电状态下的XRD图。如图7所示,相比于原始的电极,Ti3C2Tx/MnO2在随后的放电和充电过程以及再放电过程中(图7a),均没有明显新相的产生(图7b)。而通过局部放大的XRD图可知(图7c),当首次放电至1.0 V时,位于44.5°左右的MnO2特征峰相比于未发生电化学反应的原始电极略微负向移动,这是由于溶液中锌离子嵌入,MnO2晶面间距增大。当充电到1.8 V后,嵌入的锌离子又脱出使晶面间距减小,从而使衍射峰正向移动,第2次放电到1.0 V后,Ti3C2Tx/MnO2电极几乎又负向移动到首次放电状态的位置。这些结果表明锌离子在Ti3C2Tx/MnO2上的嵌入和脱出过程是高度可逆的,而且没有其他新相的生成,推测出高浓度电解液中很少发生质子的嵌入脱出。

图6 Ti3C2Tx/MnO2电极在2 mol·L−1ZnSO4电解液中的(a)前2圈恒流充放电曲线和(b)非原位XRD图Fig.6 (a)Galvanostatic charge/discharge profiles and(b)ex⁃situ XRD patterns of Ti3C2Tx/MnO2electrode in 2 mol·L−1ZnSO4electrolyte

图7 Ti3C2Tx/MnO2电极在30 mol·L−1TEAOTf+1 mol·L−1ZnOTf电解液中的(a)前2圈恒流充放电曲线和(b)不同状态的非原位XRD图及(c)局部放大XRD图Fig.7 (a)Galvanostatic charge⁃discharge profiles,(b)ex⁃situ XRD patterns and(c)partial enlarged XRD patterns of Ti3C2Tx/MnO2electrode in 30 mol·L−1TEAOTf+1 mol·L−1ZnOTf electrolyte
事实上,在稀溶液的水系电池体系中,H+与碱性金属离子的共嵌入现象很容易发生。早在2006年,夏永姚团队就已经证实了LiNi1/3Co1/3Mn1/3O2水系锂电正极材料在低pH条件下H+的共嵌入现象,在强碱性溶液中,H+较难嵌入,因此LiNi1/3Co1/3Mn1/3O2具有更好的稳定性[40]。此外,在水系锌电池早期的研究工作中,王春生等发现纳米MnO2经历了连续的H+和Zn2+嵌入过程,其反应动力学有明显的差异,这与2种放电平台有关。由于H+的反应动力学比Zn2+快得多,H+嵌入发生在高电位的放电平台,Zn2+嵌入发生在低的放电平台[41]。近期曹余良团队研究了Na0.44MnO2正极材料在碱性水溶液中的放电机制,证实了H+在Na0.44MnO2隧道结构中的共嵌入现象,过量H+的嵌入引起隧道结构破坏,严重影响了其循环稳定性[42]。由于在ZnSO4电解液中,溶液的pH值约为4,很容易产生质子共嵌入到电极材料中,同时溶液中的OH−会与溶液中剩余的Zn2+和SO42−结合生成碱式ZnSO4。然而在高浓度电解液中,由于其具有较高浓度惰性阳离子盐,因而质子很难竞争过其他阳离子,所以很少发生质子嵌入。通过测试Ti3C2Tx/MnO2电极在 30 mol·L−1TEAOTf+1 mol·L−1ZnOTf电解液中循环1 000圈后的XRD结果(图S8)发现,电极表面没有明显的碱式盐,大部分为钛网基底峰和原有的MnO2的峰,几乎与初始电极相一致。
3 结论
通过一系列电化学性能测试,结合非原位XRD表征技术详细研究了Ti3C2Tx/MnO2水系锌电池正极材料在不同电解液中的比容量、循环稳定性和储存机制。结果表明,在稀ZnSO4电解液中,正极材料具有明显的质子嵌入平台,而这种质子可逆脱嵌的比容量贡献使Ti3C2Tx/MnO2电极相比于其他电解液具有更高的比容量,然而这种质子的共嵌入同时也引起了材料的结构破坏,严重影响了电极材料的循环稳定性。最后,我们设计了一种新型的含惰性阳离子的超高盐浓度电解液(30 mol·L−1TEAOTf+1 mol·L−1ZnOTf),该电解液中的 TEAOTf浓度较高,且TEA+阳离子半径较大,很难嵌入电极材料,可有效抑制电解液中的质子竞争反应,从而提高了Ti3C2Tx/MnO2电极的可逆性,并且可有效抑制材料在循环过程中的溶解和结构崩塌。因此,为了提高电极材料在水系锌电池中的稳定性和可逆性,需要有效控制电解液中质子的共嵌入反应和析氢等其他副反应。
Supporting information is available at http://www.wjhxxb.cn
