蜂毒肽与CT⁃DNA的相互作用
2022-04-18张文龙胡颖媛王颖莉李建丽杨斌盛
张文龙 胡颖媛 王颖莉 李 睿 李建丽 杨斌盛
(1山西中医药大学中药与食品工程学院,晋中 030619)
(2山西大学分子科学研究所,化学生物学与分子工程教育部重点实验室,太原 030006)
蜂毒肽(Mel)是蜂毒的主要活性成分,包含26个氨基酸残基(GIGAVLKVLTTGLPALISWIKRKRQQ),具有两亲性[1⁃2],氨基端主要由疏水氨基酸残基(resi⁃dues 1⁃20)组成,而羧基端则由大部分亲水氨基酸残基(residues 21⁃26)构成。在生理pH条件下,羧基端4个正电残基(KRKR)及Lys7使得Mel带5个正电荷。在水溶液中,低浓度(μmol·L−1)的Mel作为单体以无规卷曲状态存在[3];高浓度(mmol·L−1)或在高盐溶液中,Mel形成四聚体以α⁃helix状态存在[3];在磷脂双分子层中,Mel作为单体以α⁃helix状态存在[4]。其α⁃helix结构如图1所示。Mel通过各种构象以不同方式调节其活性,参与细胞内信号传递。

图1 Mel(PDB∶2MLT)的结构Fig.1 Structure of Mel(PDB∶2MLT)
作为抗菌肽,Mel由于可以与细胞内多种成分反应,故而常作为模型肽来了解细胞内过程。例如,其可以与磷脂结合,引起膜融合[4];与核苷酸结合,调控基因表达[5];作为钙调蛋白的抑制剂,研究钙调蛋白的性质[6];可以作为药物传递肽;另外,Mel对革兰氏阴/阳性菌及真菌表现出显著的抗菌活性[7⁃8];具有显著的抗过敏和抗炎症特性[9];可以抑制某些癌细胞的生长[10];诱导人白血病细胞的凋亡[11];并表现出显著的抗病毒活性[12]。多项报告还表明,Mel对于糖尿病及动脉粥样硬化也有一定的治疗作用[13]。总之,Mel具有广泛的生物学及药理学效应[14]。
Mel与核酸的反应研究主要集中在Mel对DNA的损伤及所选基因的表达[15⁃16]。对于DNA与Mel的结合过程以及结合后构象改变仍然是未知的。我们采用多种光谱方法以及量热法研究了小牛胸腺DNA(CT⁃DNA)与Mel的相互作用,为今后研究抗菌肽的药理作用、了解抗菌肽与核酸的结合机制以及设计新型高效药物分子提供了依据。
1 实验部分
1.1 试剂与仪器
N⁃2⁃羟乙基派嗪⁃N′⁃乙磺酸(HEPES,AR)购于Sigma公司。CT⁃DNA(纯度98%)、溴化乙锭(EB)购于索莱宝。Mel(纯度达到98%)由中国武汉Fine peptide公司合成,其它试剂均为分析纯。
主要仪器:Biologie Mos 450型圆二色谱仪(法国Bio⁃logic公司)、F⁃2500型荧光光谱仪(日本Hitachi公司)、Cary 50 Bio UV⁃Visible型紫外吸收光谱仪(美国Varian公司)、ITC200型等温滴定量热仪(英国Malvern 公司)、Edinburgh Analytical Instrument type nF⁃900荧光光谱仪(英国爱丁堡公司)。
1.2 实验方法
1.2.1 溶液的配制
Mel溶液:取少量Mel固体,溶解于 10 mmol·L−1pH=7.4的HEPES缓冲液,测量其在280 nm处的吸光度,确定其浓度(ε=5 500 L·mol−1·cm−1[17])。
CT⁃DNA溶液:参照文献[18]进行配制。
1.2.2 光谱测试
所有实验均在10 mmol·L−1pH=7.4的HEPES缓冲溶液中进行,光谱数据均为3次扫描的平均值。
UV⁃Vis吸收光谱:T=25℃,使用1 cm比色皿测定不同溶液在200~800 nm范围的光谱。
CT⁃DNA解链温度(Tm)的测量:样品以5℃的升温间隔从15℃连续加热至90℃,使用1 cm比色皿,监测不同溶液在不同温度下260 nm处吸光度。
圆二色光谱(CD):T=25℃,步长0.2 nm,带宽1 nm,使用1 mm比色皿记录不同溶液在190~320 nm范围的光谱。
荧光寿命:T=25℃,用Ludox HS⁃30硅胶溶液作为空白,使用280 nm的激光器作为激发光源,测定不同溶液的荧光寿命,荧光衰减曲线参照文献[19]进行拟合。
荧光光谱的测定:T=25℃,使用1 cm比色皿。其中在红边激发荧光位移法(REES)实验中,激发波长以5 nm的波长间隔从280 nm逐渐增加至305 nm,记录不同激发波长下样品的发射波长;在丙烯酰胺荧光猝灭实验中,激发波长为295 nm,逐步加入丙烯酰胺溶液(5 mmol·L−1)到样品中,记录不同溶液最大发射波长所对应的荧光强度;对于稳态荧光光谱,激发波长为295 nm,狭缝为5 nm,扫描速度为100 nm·min−1,逐渐滴加CT⁃DNA到Mel溶液中,收集300~550 nm的发射光谱;对于EB荧光竞争实验,激发波长为488 nm,记录500~750 nm范围的发射光谱。
1.2.3 等温滴定量热法
T=25℃,采用MicraoCal ITC200进行等温滴定量热测试。将 3.0 mmol·L−1CT⁃DNA 和 0.08 mmol·L−1Mel分别放置于注射池与样品池中,进行滴定。第一次滴加0.4 μL,以后每次滴加1 μL CT⁃DNA到样品池中,反应时间为3 min,共滴加31次,搅拌速度为750 r·min−1。数据处理时去除第一滴,扣除稀释热,利用仪器自带的软件来拟合,得到结合常数(Ka)及结合焓变(ΔH),ΔG与ΔS参考文献[19]得到。
2 结果与讨论
2.1 CD光谱
图2为室温下10 mmol·L−1pH=7.4的HEPES 缓冲溶液中,Mel与CT⁃DNA混合前后的CD光谱。由图可见,Mel在203 nm有一较强负信号,同时在222 nm处有一弱的肩峰(图2A),表明在缓冲溶液中Mel基本以无规卷曲的状态存在。这与文献报道的结果一致[20]。CT⁃DNA由于碱基堆积在275 nm出现一个正峰,由于右手螺旋在245 nm出现负峰(图2B),这是B型DNA的特征峰[21]。为了更好的观察Mel与CT⁃DNA混合后构象的变化,用混合物的光谱数据减去单一成分的光谱数据,分别得到反应后的Mel与CT⁃DNA的光谱。从图中可以看到,Mel与CT⁃DNA反应后,在208与222 nm分别出现了负峰(图 2A),这是典型的α⁃helix特征峰[20,22],表明 Mel与CT⁃DNA反应后以α⁃helix状态存在,与文献报道的结果一致,即Mel遇到疏水模拟物,如胶束、膜环境或者脂质体,会采用α⁃helix[23]。与Mel反应后,CT⁃DNA位于275 nm处的正峰及245 nm处的负峰强度与位置均发生变化(图2B),表明CT⁃DNA的双螺旋结构发生变化[21]。
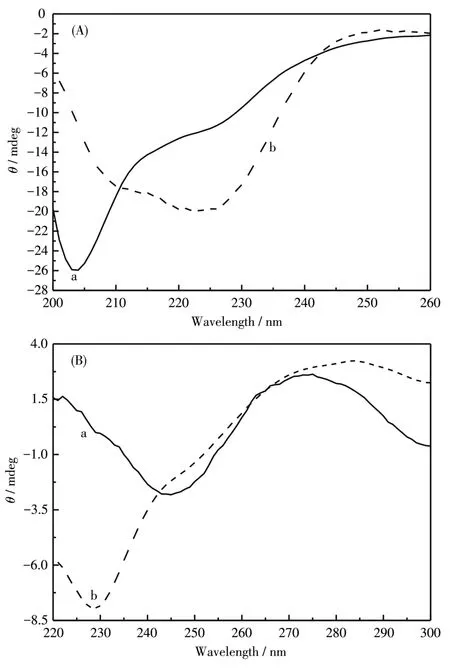
图2 (A)Mel与(B)CT⁃DNA的CD光谱Fig.2 CD spectra of(A)Mel and(B)CT⁃DNA
2.2 紫外光谱
图3为Mel与CT⁃DNA反应后的紫外可见吸收光谱。由于Mel的19位含有色氨酸残基,其最大吸收峰位于280 nm处。CT⁃DNA的最大吸收峰位于258 nm,将CT⁃DNA与Mel混合后,最大吸收峰位于267 nm处,而将CT⁃DNA与Mel的光谱加和所产生的最大吸收峰位于261 nm。紫外光谱的变化表明Mel与CT⁃DNA形成了复合物,Mel中色氨酸的环境可能发生了变化[24]。同时推测可能由于与Mel作用,使得CT⁃DNA双链间的氢键断裂,双螺旋解开[25]。
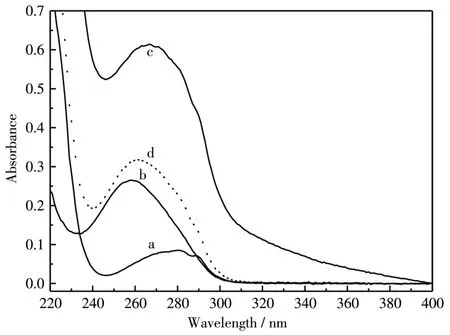
图 3 Mel(a)、CT⁃DNA(b)、CT⁃DNA⁃Mel(c)以及 Mel与CT⁃DNA光谱加和的(d)UV⁃Vis光谱Fig.3 UV⁃Vis absorption spectra of Mel(a),CT⁃DNA(b),CT⁃DNA⁃Mel(c)and calculated sum spectrum of Mel with CT⁃DNA(d)
2.3 色氨酸残基微环境的变化
2.3.1 荧光寿命
色氨酸的荧光寿命对于所处微环境极为敏感[26]。图4A为Mel在不同溶液中的荧光寿命。如图所示,CT⁃DNA的加入改变了Mel的荧光寿命。其中Mel在缓冲溶液中的平均寿命为3.77 ns,与文献报道的结果一致[27],表明色氨酸残基暴露在溶剂中。当Mel与CT⁃DNA结合后,平均寿命减少了68%,变为1.22 ns,色氨酸残基微环境的极性降低,进入疏水环境,这可能对应了Mel的构象由无规卷曲向α⁃helix的转变,与CD测得的结果一致。
2.3.2 丙烯酰胺猝灭实验
使用丙烯酰胺来进一步探究Mel的构象变化,尤其是色氨酸微环境的变化。丙烯酰胺作为中性猝灭剂,既能猝灭位于蛋白质表面的荧光基团的荧光,也能猝灭位于蛋白质内部疏水腔的荧光基团的荧光,因此常用来分析蛋白质荧光基团的微环境[28]。丙烯酰胺猝灭实验的结果,采用Stern⁃Volmer方程[28](式1)进行拟合分析:

其中F0、F是丙烯酰胺不存在或存在时溶液的荧光强度,Ksv是Stern⁃Volmer猝灭常数,cQ是丙烯酰胺的浓度。图4B即为丙烯酰胺猝灭不同溶液所产生的光谱图,由斜率测得Ksv,其中Mel在缓冲溶液中的Ksv为 17.30 L·mol−1,表明 Mel在缓冲溶液中经历了较大的猝灭,色氨酸残基暴露在溶剂中[28]。当Mel与CT⁃DNA结合后,Ksv减少为4.87 L·mol−1。Ksv的减少表明,一旦Mel与CT⁃DNA形成配合物,Mel中色氨酸残基对溶剂中丙烯酰胺的可接近性减少,色氨酸残基处于更疏水的内部环境[28],这与荧光寿命得到的结果一致。
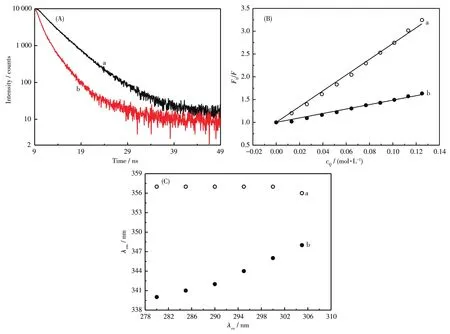
图4 Mel及其与CT⁃DNA混合物的荧光分析:(A)荧光衰减曲线;(B)丙烯酰胺猝灭实验的Stern⁃Volmer分析;(C)激发波长的变化对最大发射波长的影响Fig.4 Fluorescence analysis for Mel and the mixture of Mel with CT⁃DNA:(A)fluorescence decay curves;(B)representative data for Stern⁃Volmer analysis of acrylamide quenching;(C)effect of changing the excitation wavelength on the maximum emission wavelength
2.3.3 REES法
采用REES法来进一步检测CT⁃DNA对Mel中色氨酸残基微环境的影响[29]。REES是指由于激发波长向长波方向移动而导致荧光基团的最大发射波长也向长波方向移动。REES上升是由荧光基团激发态周围溶剂的弛豫速率较慢引起。图4C为CT⁃DNA对Mel的红边激发荧光位移影响。由图中可以看到,随着激发波长的逐渐增加,从280 nm增加到305 nm,处于缓冲液中的Mel最大发射波长几乎没有变化,表明缓冲溶液中Mel的色氨酸基团处于一个可移动的水环境中。当Mel与CT⁃DNA结合后,最大发射波长值随着激发波长的增加而发生红移,从 340 nm(λex=280 nm)移到 348 nm(λex=305 nm),位移8 nm。REES研究表明,Mel与CT⁃DNA形成复合物后,使得Mel中的色氨酸残基活动受到限制,这与荧光寿命及荧光猝灭实验得到的结果一致,Mel与CT⁃DNA的结合使得Mel的色氨酸残基的微环境发生变化,由亲水区进入更疏水的内部。
2.4 CT⁃DNA构象的变化
2.4.1 EB荧光
EB在水溶液中荧光较弱,通过内插结合到CT⁃DNA的碱基对中后荧光显著增强,故而可以作为监测CT⁃DNA构象变化的荧光探针[30]。如图5所示,EB在缓冲溶液中或者Mel溶液中的荧光很弱,最大发射波长位于612 nm,当EB插入到CT⁃DNA分子中,荧光显著增强,最大发射波长移至599 nm,当向EB⁃CT⁃DNA溶液中逐渐加入Mel后,EB荧光强度逐渐减弱,最终荧光强度(曲线g)强于EB在缓冲溶液中的强度(曲线 a),而弱于 EB⁃CT⁃DNA的荧光强度(曲线c),推测Mel与CT⁃DNA的作用使得CT⁃DNA的构象发生变化,EB的结合位点减少,部分EB分子被释放,这与紫外光谱及CD光谱得到的结果一致。
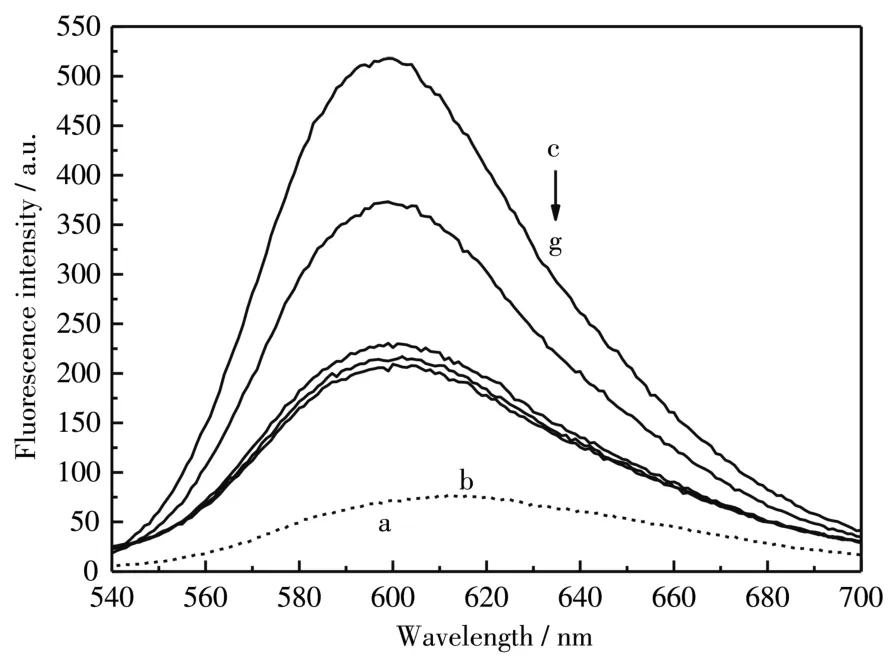
图5 EB⁃CT⁃DNA在加入Mel前后的荧光光谱Fig.5 Fluorescence spectra of EB⁃CT⁃DNA before and after the addition of Mel
2.4.2Tm测定
Tm是指50%的双链DNA变成单链的温度[31]。图6为CT⁃DNA在不同溶液中的热变性曲线,经拟合得到Tm,其中缓冲溶液中CT⁃DNA的Tm值为64.3℃。而与Mel结合后,CT⁃DNA的Tm值为66.2℃。Tm升高可能是由于Mel中的带正电荷的氨基酸残基与CT⁃DNA反应,改变了CT⁃DNA的电荷排列,从而起到稳定双螺旋结构的作用[31],此外,氨基酸疏水侧链与CT⁃DNA的疏水部分接触,也可能使复合物更稳定[31]。
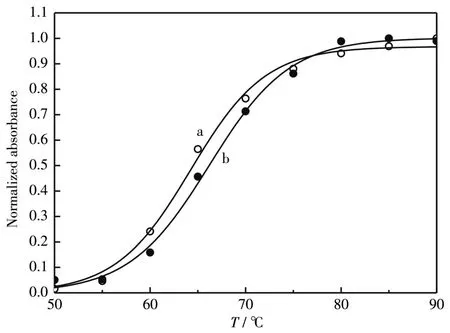
图6 CT⁃DNA(a)和CT⁃DNA⁃Mel(b)的热变性曲线Fig.6 Thermal denaturation curves of CT⁃DNA(a)and CT⁃DNA⁃Mel(b)
2.5 结合常数
2.5.1 荧光光谱
Mel与CT⁃DNA亲和力通过CT⁃DNA滴定Mel实验来测定。图7A是CT⁃DNA滴定Mel的荧光光谱,从图中可以看出,Mel由于含有色氨酸,最大荧光发射峰位于357 nm,表明色氨酸残基暴露在缓冲溶液中。随着CT⁃DNA逐渐滴加到Mel中,Mel的荧光强度逐渐减弱,减弱约53%,最大发射波长发生蓝移,由357 nm蓝移到342 nm,Mel与CT⁃DNA形成复合物,Mel的构象发生变化,色氨酸残基进入更加疏水的内部,这可能对应了Mel由无规卷曲向α⁃helix的转变。荧光猝灭可能是由于Mel所带的正电荷与CT⁃DNA磷酸骨架所带的负电荷的静电作用使得Mel的表面电荷发生重排[32],另外CT⁃DNA与色氨酸残基吲哚基附近氨基的氢键形成也可能会引起Mel荧光的猝灭[33]。
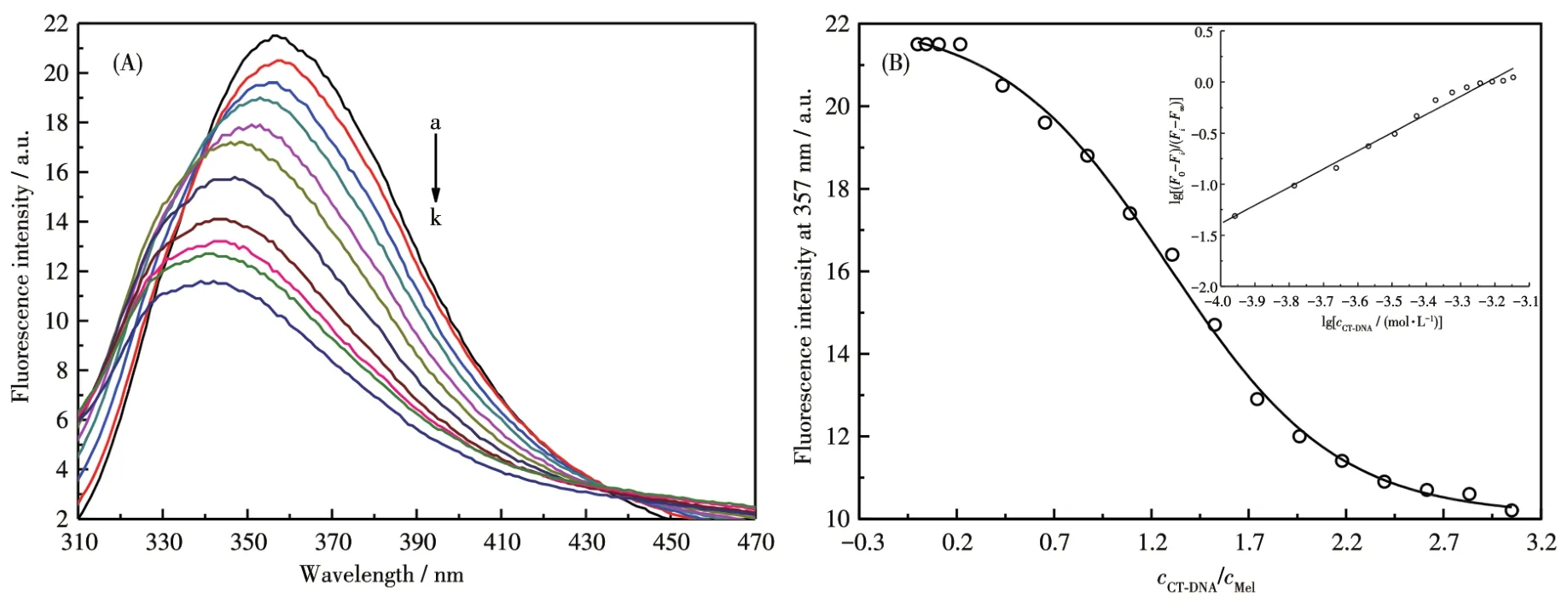
图7 (A)CT⁃DNA的加入对Mel(1.2 μmol·L−1)荧光光谱的影响;(B)随cCT⁃DNA/cMel变化的荧光强度滴定曲线Fig.7 (A)Effect of adding CT⁃DNA on fluorescence spectrum of Mel(1.2 μmol·L−1);(B)Titration curve for fluorescence intensity as a function of cCT⁃DNA/cMel
将 Mel在 357 nm 处的荧光强度对cCT⁃DNA/cMel作图,得到图7B。从图7B可以看出,Mel在357 nm处的荧光强度随着cCT⁃DNA/cMel的增大而逐渐减小。Mel与CT⁃DNA的结合常数可由式2得到:
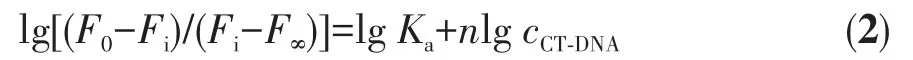
其中F0为CT⁃DNA不存在时,Mel在357 nm处的荧光强度;Fi为任一滴定点的荧光强度;F∞为CT⁃DNA与Mel完全结合后Mel在357 nm处的荧光强度;Ka为CT⁃DNA与Mel结合的条件结合常数;n为结合位点数;cCT⁃DNA为任一滴定点时CT⁃DNA的游离浓度。根据文献[19],使用CT⁃DNA的总浓度代替CT⁃DNA的游离浓度,用 lg[(F0−Fi)/(Fi−F∞)]对 lgcCT⁃DNA作图可得Ka和n,数据处理过程中扣除滴定过程中产生的稀释效应。如图7B插图,得到CT⁃DNA与Mel的结合常数为(5.39±0.04)×105L·mol−1。
当CT⁃DNA与Mel反应的缓冲液中NaCl浓度达到 500 mmol·L−1时(图 8),Mel与 CT⁃DNA 混合物的最大荧光发射峰从342 nm移回357 nm(曲线b到曲线c),表明Mel与CT⁃DNA的结合高度依赖静电作用。
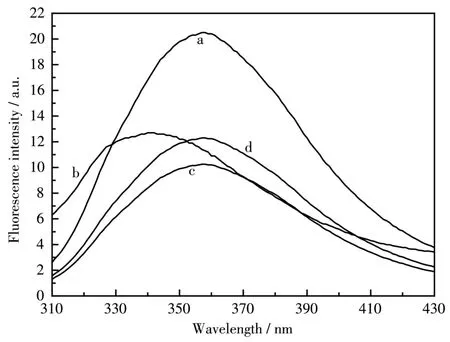
图8 (a)Mel在HEPES中、(b)CT⁃DNA⁃Mel在HEPES中、(c)CT⁃DNA⁃Mel在500 mmol·L−1NaCl中和(d)ssDNA⁃Mel在HEPES中的荧光光谱Fig.8 Fluorescence spectra of(a)Mel in HEPES buffer,(b)CT⁃DNA⁃Mel in HEPES buffer,(c)CT⁃DNA⁃Mel in 500 mmol·L−1NaCl,and(d)ssDNA⁃Mel in HEPES buffer
此外,我们还观察了单链DNA(ssDNA)对Mel荧光的影响,ssDNA包含磷酸骨架,可以为反应提供静电作用。CT⁃DNA于100℃孵化30 min,再快速转移至冰水浴中冷却30 min,得到ssDNA。将ssDNA加入到Mel中,荧光仅仅发生猝灭(曲线a~d),表明CT⁃DNA与Mel的反应过程中除静电作用外,还存在疏水作用,CT⁃DNA双螺旋中的疏水成分可能在这个过程中起到了作用。
2.5.2 等温滴定量热法
为了进一步研究Mel与CT⁃DNA之间的相互作用,我们选用等温滴定量热法进行分析。图9为CT⁃DNA滴定Mel所得到的代表性热谱图和相应的滴定曲线。由图可知,Mel和CT⁃DNA之间的反应是吸热反应。采用“one set of sites”模型进行拟合,得到Ka为(4.44±0.12)×105L·mol−1,与荧光光谱得到的结合常数接近。所有的热力学参数列于表1。由表可知,焓变对自由能的贡献较小,Mel与CT⁃DNA的相互作用是熵驱动的,表明静电作用与疏水作用在复合物形成的过程中都起作用,静电作用来源于CT⁃DNA磷酸骨架与Mel带正电的氨基酸残基之间的作用,疏水作用可能来源于CT⁃DNA双螺旋与Mel的疏水氨基酸残基[34]。
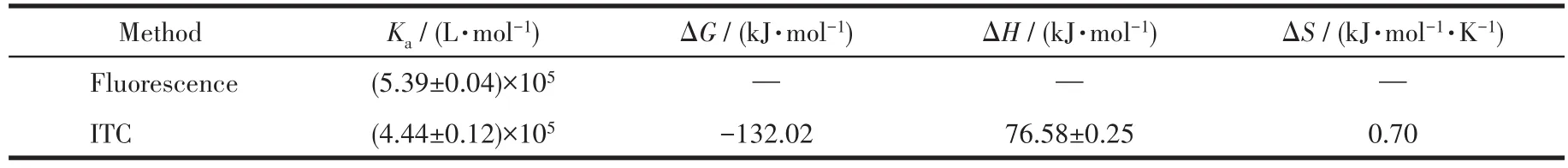
表1 在25℃时通过荧光光谱和ITC测量CT⁃DNA⁃Mel复合物的热力学参数Table 1 Thermodynamic parameters of CT⁃DNA⁃Mel complex by spectrofluorimetric methods and ITC at 25 ℃
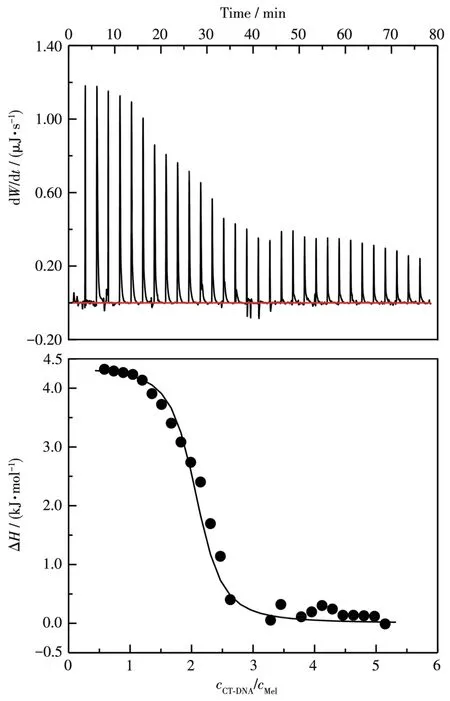
图9 在25 ℃时CT⁃DNA(3.0 mmol·L−1)滴定Mel(0.08 mmol·L−1)的等温量热滴定曲线Fig.9 Calorimetric titration of CT⁃DNA(3.0 mmol·L−1)to Mel(0.08 mmol·L−1)at 25 ℃
综上所述,Mel与CT⁃DNA可以形成复合物,这与文献中报道的具有多个疏水氨基酸残基的阳离子肽可与核酸形成复合物类似[34⁃35]。复合物的形成存在多种相互作用,Mel中带正电荷的氨基酸残基与CT⁃DNA带负电荷的磷酸骨架之间存在静电作用;CT⁃DNA双螺旋能与Mel中的疏水氨基酸残基之间发生疏水作用,尤其是缬氨酸与亮氨酸,它们还有与CT⁃DNA双螺旋配位的趋势[34];此外,Mel中带质子的氨基和羧基还可能与CT⁃DNA中腺嘌呤和鸟嘌呤的氮原子之间形成氢键。离子强度实验表明,Mel在与CT⁃DNA相互作用的过程中,静电作用在初始的结合中占主导地位,类似于Mel与膜的结合[23]。二者的相互作用会诱导Mel构象发生变化,由无规卷曲变为α⁃helix,色氨酸残基由亲水的表面进入更疏水的内部环境,CT⁃DNA结构亦发生变化。根据短肽与DNA结合的互补作用模型[36]以及Wilkins等提出的基于X射线衍射研究的作用模型[35],结合实验数据,推测Mel可能以α⁃helix结合到CT⁃DNA的沟槽中。这种结合模型不仅能拓宽双螺旋的沟槽,而且增加了反应物局部的刚性,从而使得CT⁃DNA更稳定,Tm升高。
3 结论
综上所述,在 10 mmol·L−1pH 7.4 HEPES 溶液中,Mel可以与CT⁃DNA形成复合物,复合物的形成使得Mel由无规卷曲转向α⁃helix,Mel中的色氨酸残基由亲水环境向疏水环境转变,吲哚环不能独立于Mel自由转动,并且CT⁃DNA的结构发生变化,该研究提供了对阳离子肽在核酸结合中作用的重要见解,不仅有助于更深入地了解抗菌肽的作用机制,而且有助于更深入地了解抗菌肽与核酸的作用机制,也为构建具有一定理化特性和生物学特性的多肽以及潜在药用制剂的研发提供了线索。
