振腹环揉法对PCPA失眠大鼠脑、肠组织中SP及GAL蛋白表达的影响
2022-04-18郅晓宇张红石
郅晓宇,刘 鹏,董 娜,张 野,张红石*
(1.长春中医药大学,长春 130117;2.长春中医药大学附属医院,长春 130021)
课题组在腹部推拿治疗失眠的机制研究中,发现了脏腑推拿治疗失眠存在脑肠互动现象,且与人体脑肠肽调节密切相关。因此,本研究通过前期实验筛选,确定了两种与睡眠密切相关的脑肠肽SP与GAL,通过Western blot检测二者在下丘脑及小肠中的蛋白表达,验证腹部推拿治疗失眠存在脑肠互动现象。
1 材料与仪器
1.1 实验动物与分组
64只SPF级雄性Wistar大鼠,由长春市亿斯实验动物技术有限责任公司提供[动物许可证号:SCXK(吉)-2020-0002],7周龄,体质量(200±20)g左右。大鼠随机分成空白组、模型组、推拿组、药物组,每组16只。
1.2 实验材料
戊巴比妥钠(Merck公司),PCPA(美国Sigma公司),戊巴比妥钠(国药集团化学试剂有限公司),碳酸氢钠(成都市科龙化工试剂厂),阿拉伯胶(天津市光复精细化工研究所),RIPA裂解液(碧云天生物技术公司),BCA蛋白浓度测定试剂盒(碧云天生物技术公司),PBS磷酸盐缓冲液(北京中杉金桥生物技术有限公司),人参归脾丸(北京同仁堂股份有限公司同仁堂制药厂)。
1.3 实验仪器
电泳系统(型号:Mini-ProteanTetra,美国Bio-Red公司),转膜仪(型号:170-4150,美国Bio-Rad公司),成像分析系统(型号:FluorChemQ,美国Proteinample公司),离心机(ESCO MCR-88-8)。
2 方法
实验方案经长春中医药大学动物实验伦理审查委员会审核通过(No:2021248),具体方法如下。
2.1 PCPA失眠模型大鼠制作
将加入阿拉伯胶的PCPA粉末研磨至泡沫状,以氯化钠溶液和碳酸氢钠溶液配制成100 mg·mL-1混悬液,备用,于注射前震荡摇匀。模型组、推拿组以及药物组采用PCPA腹腔注射制作失眠大鼠模型,大鼠适应性饲养1周后,按大鼠体质量400 mg·mL-1计算PCPA使用量。每日上午8:00-10:00时对大鼠进行腹腔注射,每日1次,连续注射2 d。以30 mg·mL-1戊巴比妥钠进行腹腔注射对造模后大鼠进行翻正反射实验,记录翻正反射消失时间与睡眠持续时间,如与空白组出现统计学差异(P<0.05),则证明模型复制成功。
2.2 干预方法
1)空白组:不做任何处理。2)模型组:造模成功后正常饲养。3)推拿组:造模成功后行振腹环揉治疗,将每只大鼠套装于干净袜子中,以震动按摩器环揉腹5 min,并以震动按摩器于腹部振动5 min,每日1次,连续治疗5~10 d。4)药物组:按照人:大鼠=1:30的比例灌服人参归脾丸(将药物剂量按照体质量转化为毫升数),连续5~10 d。
2.3 实验动物取材
治疗5 d后每组处死8只大鼠,治疗10 d后处死剩余大鼠。使用异氟烷进行气麻后进行断头处理,在冰盘上剥离下丘脑,并迅速放入液氮中;截取小肠5 cm,于预冷过的生理盐水中清洗后,立即放入-80 ℃冰箱保存。
2.4 Western blot测定
1)取大鼠下丘脑以及小肠组织,称重后加入预冷的RIPA 裂解缓冲液研磨。2)4℃ 12 000 r·min-1,离心15 min,提取上清液。3)BCA检测法测蛋白浓度。4)聚丙烯酰胺凝胶电泳,根据各目的蛋白从SDS聚丙烯酰胺凝胶转移PVDF膜。5)5%脱脂奶粉封闭1 h后,加入一抗后过夜。6)将取出的膜在PBS溶液中洗涤5 min,重复3次,随后将膜放入封闭的盒子中,加入合适浓度的二抗,室温孵育1 h。7)将β-actin作为内参,化学发光法显影,观察拍照。8)采用Image Pro Plus图像分析软件测算出SP、GAL蛋白表达条带的光密度值,进行蛋白表达水平分析。
2.5 统计学方法
数据使用SPSS 22.0统计软件进行分析。数据以均数±标准差(±s)表示,组间多重比较采用t检验,以P<0.05为差异有统计学意义。
3 结果
3.1 各组翻正反射实验
见表1。
表1 各组造模后翻正反射消失时间及睡眠持续时间比较(±s,n = 16)min
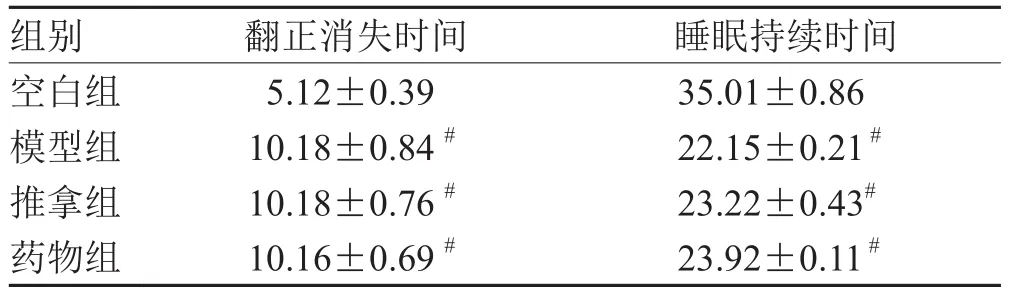
表1 各组造模后翻正反射消失时间及睡眠持续时间比较(±s,n = 16)min
注:与空白组比较,# P<0.05
组别 翻正消失时间 睡眠持续时间空白组 5.12±0.39 35.01±0.86模型组 10.18±0.84 # 22.15±0.21 #推拿组 10.18±0.76 # 23.22±0.43#药物组 10.16±0.69 # 23.92±0.11 #
3.2 各组蛋白水平变化
振腹环揉法干预后,各组蛋白印迹图(见图1);大鼠下丘脑中GAL的蛋白表达量上升(见表2、图2),小肠中GAL的蛋白表达量下降(见表3、图3);下丘脑、小肠中SP的蛋白表达量上升(见表2、表3、图2、图3)。
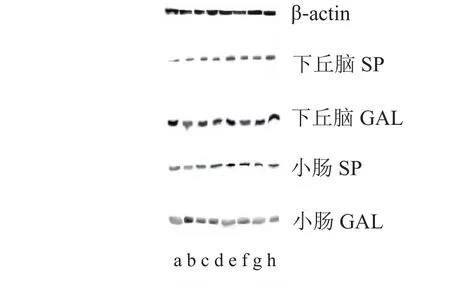
图1 各组蛋白印迹图

图2 下丘脑中SP、GAL蛋白表达量

图3 小肠中SP、GAL蛋白表达量
表2 各组下丘脑SP、GAL蛋白水平变化比较(±s )pg·mL- 1
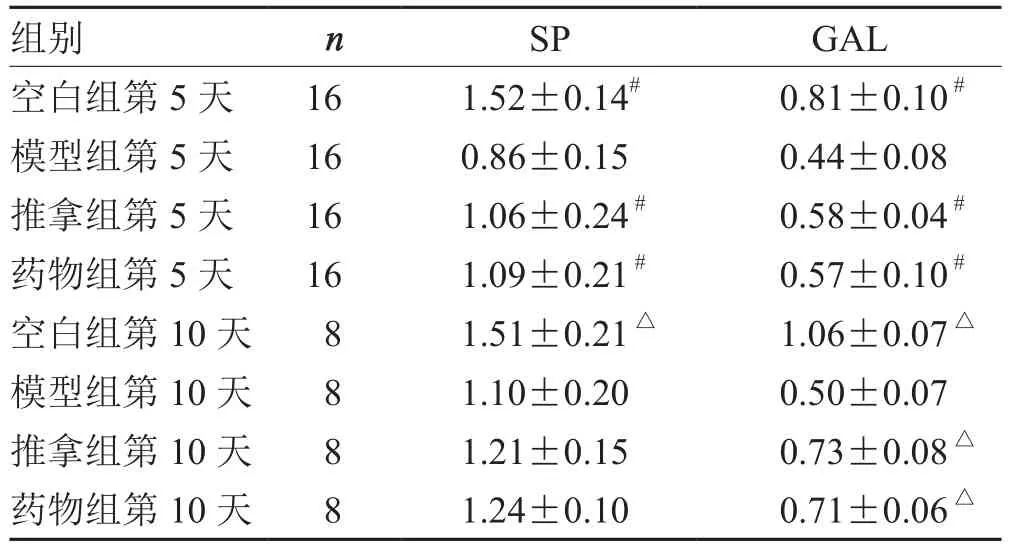
表2 各组下丘脑SP、GAL蛋白水平变化比较(±s )pg·mL- 1
注:与模型组第5天比较,# P<0.05;与模型组第10天比较,△P<0.05
组别 n SP GAL空白组第5天 16 1.52±0.14# 0.81±0.10 #模型组第5天 16 0.86±0.15 0.44±0.08推拿组第5天 16 1.06±0.24 # 0.58±0.04 #药物组第5天 16 1.09±0.21 # 0.57±0.10 #空白组第10天 8 1.51±0.21△ 1.06±0.07△模型组第10天 8 1.10±0.20 0.50±0.07推拿组第 10 天 8 1.21±0.15 0.73±0.08 △药物组第 10 天 8 1.24±0.10 0.71±0.06 △
表3 各组小肠SP、GAL蛋白水平变化比较(±s )pg·mL- 1
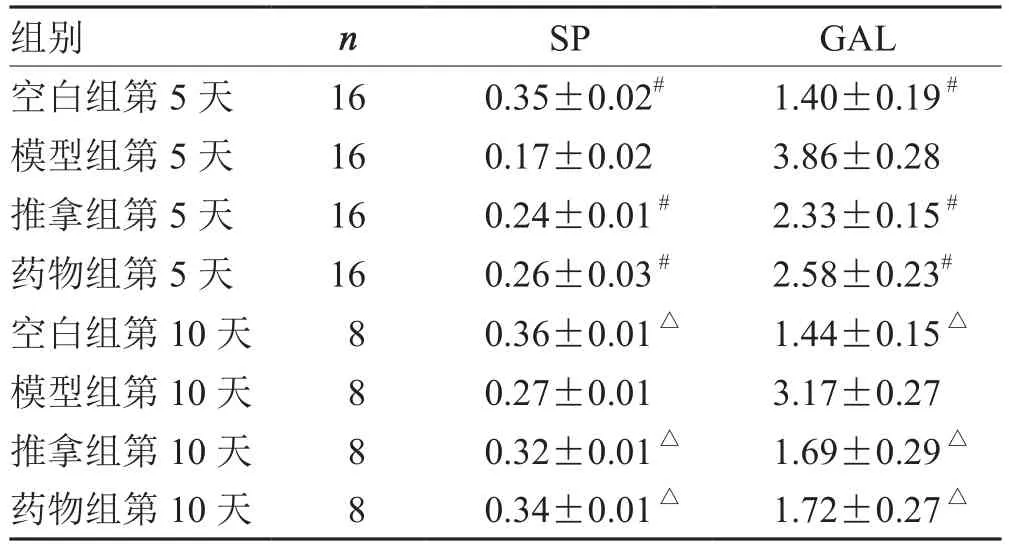
表3 各组小肠SP、GAL蛋白水平变化比较(±s )pg·mL- 1
注:与模型组第5天比较,# P<0.05;与模型组第10天比较,△P<0.05
组别 n SP GAL空白组第5天 16 0.35±0.02# 1.40±0.19 #模型组第5天 16 0.17±0.02 3.86±0.28推拿组第5天 16 0.24±0.01 # 2.33±0.15 #药物组第5天 16 0.26±0.03 # 2.58±0.23#空白组第10天 8 0.36±0.01 △ 1.44±0.15 △模型组第10天 8 0.27±0.01 3.17±0.27推拿组第10天 8 0.32±0.01 △ 1.69±0.29 △药物组第10天 8 0.34±0.01 △ 1.72±0.27 △
4 讨论
现代神经生物学与心理学观点认为,失眠与大脑的生理功能改变,遗传因素及情感因素密切相关[1]。随着神经生物学的发展,很多神经肽类物质被发现参与了睡眠—觉醒调节[2],如神经肽Y(NPY),SP,胆囊收缩素(CCK)等,它们统称为脑肠肽。作为既存在于脑中又存在于肠道中的双重分布肽类[3],目前已被发现60余种,大致分为神经肽、胃肠肽、胃肠神经肽3类[4]。脑肠肽在大脑与胃肠之间起着双向调节作用,与睡眠—觉醒的调节有关[5],是证明腹部推拿治疗失眠存在脑肠互动现象的首选物质。脑肠肽是脑肠轴的桥梁性介质,在中枢神经系统和肠神经系统相互作用中起到双向调节作用,其整合了肠道和大脑之间的神经、激素和免疫信号[6]。因此,微生物—肠道—大脑轴(microbiota-gut-brainaxis,MGBA)的确立[7],为腹部推拿治疗失眠的机制研究开辟了新的研究思路。
SP可以通过神经激肽受体发挥作用,从而改变非快速眼动(NREM)睡眠,因此靶点在其受体的药物可以被用作睡眠医学的新疗法[8]。SP是神经激肽-1受体(NK-1R)的主要配体,遍布了包括皮层在内的整个大脑。NK-1R存在于睡眠活跃的皮质神经元上,其活性与慢波睡眠相关[9]。SP在外周主要存在于交感神经末梢,其变化水平可以在一定程度上反映中枢的变化[10]。它与胃肠运动密切相关,当胃肠运动受到抑制时,机体会分泌大量的SP来促进胃肠运动[11]。
GAL与睡眠、认知、情感行为等密切相关[12]。其主要存在于延髓腹侧表面、孤束核、三叉神经尾核等。GAL可与DA、5-HT、NE等脑区神经递质共存,对神经活动具有较强的调节功能[13]。腹外侧视前区在慢波睡眠的维持和产生中具有重要作用,有研究发现存在于腹外侧视前区的甘丙肽能神经元通过表达结节乳头体核组胺能神经元上的GalR1增加慢波睡眠[14]。GAL在消化道中也有分布,对消化道具有调控作用,它可以抑制胃酸的分泌以及抑制进食后的胃部运动,并且对小肠的收缩活动具有抑制作用[15]。
本实验结果显示,振腹环揉法干预后,PCPA失眠大鼠下丘脑及小肠中SP表达量均升高,表明振腹环揉法提高了两个部位的SP蛋白活性,促进了SP维持睡眠慢波状态的生理作用,促进了胃肠运动。而GAL在下丘脑内表达升高,在肠道内表达下降,表明腹部推拿对不同部位的GAL表达调控出现了差异性。其可使下丘脑内GAL蛋白活性升高,维持睡眠周期内脑电波慢波效应,使肠道内GAL蛋白活性下降,改善胃肠道的抑制状态。振腹环揉法通过调节PCPA失眠大鼠SP及GAL的表达,改善失眠大鼠睡眠状态及肠道蠕动,这种现象验证了腹部推拿治疗失眠存在脑肠互动现象。
