芍药苷靶向钙激活氯通道TMEM16A减少NFκB活化治疗急性胰腺炎
2022-04-18王清华魏新智鞠业涛闵冬雨
王清华,姚 旭,魏新智,鞠业涛,闵冬雨
(辽宁中医药大学附属医院,沈阳 110033)
钙激活氯通道(CaCCs)很早就已被人们研究,直到2008年才证明跨膜蛋白16A(transmembrane protein 16A,TMEM16A,也被称为anoctamin1)是钙激活氯通道的分子基础。该通道的特征是:一方面受细胞膜电压调节,表现为电流的外向整流特性;另一方面它与细胞浆的钙离子浓度相关,表现为钙离子浓度依赖性激活。TMEM16A通道受钙离子结合位点变构调节来控制通道的开关。课题组前期研究发现,在AP动物和细胞模型中,TMEM16A蛋白表达上调;TMEM16A高表达促进胰腺炎的发生发展,提示TMEM16A可能成为治疗AP新靶标[1]。
芍药苷是芍药的主要药效成分,具有广泛的抗炎抗免疫作用[2]。研究[3]发现,芍药苷对AP模型大鼠具有治疗作用。然而芍药苷治疗急性胰腺炎的机制不清。课题组前期研究发现,芍药苷可抑制AP时腺泡细胞内的TMEM16A蛋白,据此本研究以TMEM16A为切入点,研究芍药苷抑制TMEM16A治疗AP的可能作用机制,为芍药苷治疗AP提供理论基础。
1 材料
1.1 细胞
大鼠胰腺腺泡细胞AR42J购于美国ATCC公司。
1.2 药品与试剂
芍药苷(北京索莱宝科技有限公司,批号为SP8030);雨蛙肽(美国Sigma公司,批号为C9026);大鼠TNF-α和IL-6 ELISA试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号分别为 E-ELR2856c和 E-EL-R0015c);TMEM16A抗体(美国abcom公司,批号为ab191040);山羊抗兔二抗(美国abcom公司,批号为ab205718); Lipofectamine 2000转染试剂(美国Invitrogen公司,批号为11668-019);CCK8细胞增殖和毒性检测试剂盒(北京索莱宝科技有限公司,批号为CA1210);胎牛血清(fetal bovine serum,FBS)(美国Gibco公司,批号为10270-106)、RPMI1640培养基(美国Gibco公司,批号为12633012);RIPA裂解液(强)(上海碧云天生物技术有限公司,批号为P0013B);BCA蛋白浓度测定试剂盒(增强型) (上海碧云天生物技术有限公司,批号为P0010S)。
1.3 仪器
Axopatch 2008膜片钳放大器/Digidata1322A/pClamp9(美国AXON公司);P-2000 微电极拉制仪(美国Sutter公司);Bio-Rad Mini-Protean 小型垂直电泳转印系统(美国伯乐);二氧化碳培养箱(美国Thermo 公司);Epoch酶标仪(美国BioTek公司);Bio-rad chemidoc xr+凝胶成像系统(美国伯乐)。
2 方法
2.1 细胞培养
大鼠腺泡细胞AR42J购买于ATCC公司,采用含10% 胎牛血清及1% 的100 nm青链霉素的1640细胞培养液,于37 ℃,5% CO2培养箱中进行细胞培养,每天观察细胞生长状态,3 d换液1次。
2.2 芍药苷对细胞活力的影响
将指数生长的AR42J以1×104个/孔接种在96孔细胞培养板内,用不同浓度的芍药苷(0 μmol·L-1、1 μmol·L-1、5 μmol·L-1、10 μmol·L-1、20 μmol·L-1、50 μmol·L-1)分别处理细胞,每组设8个复孔,24 h后,每孔加入10 μL 的CCK8试剂,避光孵育2 h,在490 nm 波长时测定各孔的吸光度,观察不同浓度芍药苷对细胞活力的影响。
2.3 细胞分组及给药
将对数生长的AR42J细胞分为对照组、模型组及芍药苷治疗组,芍药苷预处理30 min后,模型组和芍药苷治疗组细胞用雨蛙肽(10-8mol·L-1)作用24 h。取细胞上清液用于ELISA检测,细胞用PBS清洗后,提取细胞总蛋白用于Western blot 蛋白检测。
2.4 ELISA检测
细胞上清液于4℃,3000 rpm·min-1离心15 min,取上清液,放置在-80℃冰箱保存,用于TNF-α和IL-6的含量检测。实验过程严格按照试剂盒说明书操作,最终在450 nm 波长处测定各孔的吸光度,计算细胞因子的含量。
2.5 Western blot蛋白印记
细胞总蛋白用RPIA裂解液提取,BCA法进行蛋白定量,采用10% SDS凝胶进行电泳,转膜,封闭后在4℃冰箱中进行一抗孵育过夜(TMEM16A一抗稀释比例为1:2 000,p-NFκB为1:1 000)。二抗于室温孵育1 h,用ECL化学发光法进行成像分析。实验重复3次。
2.6 膜片钳记录TMEM16A钙激活氯电流
将带有EGFP的TMEM16A质粒用Lipofectamine 2000转染到HEK293细胞中,转染48 h后,在荧光显微镜下定位转染成功的细胞进行全细胞膜片钳方法记录电流,电极电阻为2~4 MΏ。细胞电压钳制在0 mV,刺激电压为100 mV~+100 mV,步阶电压20 mV,刺激时间为700 ms。在1 μmol·L-1细胞内钙离子时记录不同电压和不同时间点电流值。
2.7 分子模拟对接
利用分子对接技术方法,以TMEM16A为受体,采用 MOE (Molecular Operating Environment)2015.1001 软件包中的 DOCK 模块分析芍药苷分子与TMEM16A通道蛋白间的相互作用,及其作用的空间作用模式。找出芍药苷与TMEM16A通道蛋白作用可能的关键氨基酸位点。
2.8 统计学方法
采用SPSS 17.0统计软件对数据进行统计学分析。统计结果用均数±标准差(±s)表示,2组组间比较采用t检验;以P<0.05为差异具有统计学意义。
3 结果
3.1 芍药苷对细胞活力影响
应用CCK8对芍药苷处理的AR42J细胞进行细胞活力检测。结果显示<20 μmol·L-1的芍药苷对细胞生长明显没有影响(P>0.05),当浓度为50 μmol·L-1,出现了细胞活力下降(P<0.05),因此将20 μmol·L-1作为后续实验浓度。
3.2 芍药苷减少AP细胞炎性水肿,减少上清液中的炎症细胞因子生产
AR42J细胞用芍药苷预处理30 min 后,再经雨蛙肽10-8mol·L-1作用24 h,镜下可见,对照组AR42J细胞呈纤维状或卵圆形生长,聚集状增殖,细胞周围能合成分泌少量胰酶颗粒,模型组经雨蛙肽处理后,细胞出现显著变圆,体积增大,亮度增加,细胞团周围可见大量颗粒状分泌物的炎症改变;经芍药苷治疗后,与雨蛙肽模型组相比较,细胞水肿形态显著减轻,细胞周围分泌颗粒减少,提示芍药苷能减少AR42J炎性水肿,减少细胞酶原颗粒的分泌,减轻细胞的炎症反应(见图1)。对细胞培养上清液中的炎症因子检测结果显示,与对照组相比,雨蛙肽模型组作用24 h后,细胞上清液中TNF-α和IL-6的含量显著上升,差异有统计学意义(P<0.05)。与模型组相比,经芍药苷治疗后,TNF-α和IL-6的含量明显降低,差异有统计学意义(P<0.05)(见表1)。
表1 芍药苷可减少腺泡细胞炎症时TNF- α 和IL-6 生成比较(±s )

表1 芍药苷可减少腺泡细胞炎症时TNF- α 和IL-6 生成比较(±s )
注:与对照组比较,# P<0.05;与模型组比较,△P<0.05
组别 给药剂量/μmol·L-1 TNF-α/pg·mL-1 IL-6/pg·mL-1对照组 — 72.23±5.46 79.17±6.81模型组 — 97.65±7.64# 103.25±7.62#芍药苷治疗组 20 88.57±5.49△ 91.64±6.46△

图1 芍药苷可减轻腺泡细胞的炎症反应
3.3 芍药苷对胰腺炎性腺泡细胞TMEM16A具有抑制作用
AR42J细胞用芍药苷预处理30 min后,再经雨蛙肽10-8mol·L-1作用24 h,检测细胞蛋白中TMEM16A蛋白表达。结果显示,与对照组相比,雨蛙肽诱导腺泡细胞炎症时,TMEM16A蛋白表达明显升高;经芍药苷治疗后,与模型组相比,TMEM16A蛋白表达明显下降。提示芍药苷具有抑制TMEM16A蛋白作用(见图2)。
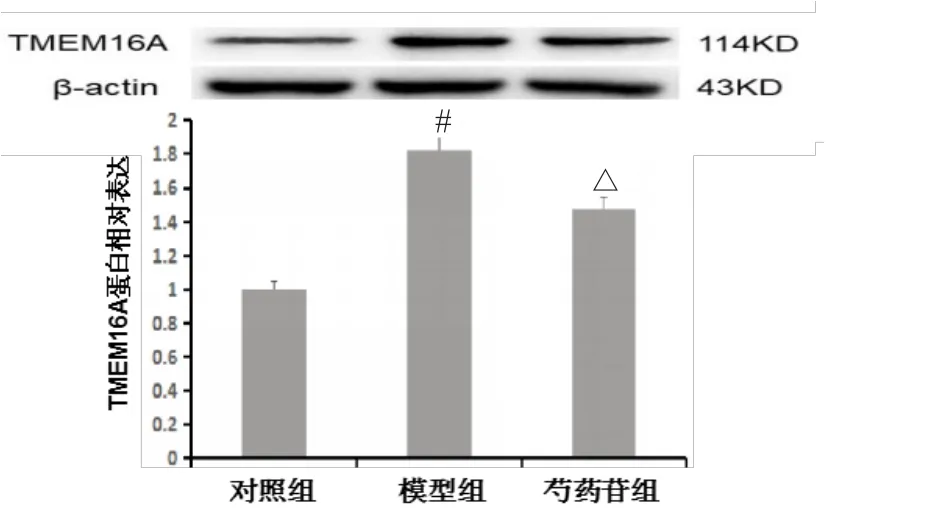
图2 芍药苷能抑制急性胰腺炎细胞中TMEM16A蛋白表达
3.4 芍药苷通过TMEM16A抑制腺泡细胞内NFκB的活化
过表达TMEM16A质粒用lipofectine 2000转染到AR42J细胞中,转染24 h后,用芍药苷(20 μmol·L-1)处理转染的细胞 24 h后,提取细胞总蛋白,进行Western blot 检测细胞内NFκB的活化程度。结果显示,在AR42J细胞中过表达TMEM16A后,NFκB磷酸化程度增加;再经芍药苷处理后,抑制了TMEM16A 促NFκB磷酸化程度(见图3)。

图3 芍药苷通过TMEM16A抑制NFκB磷酸化
3.5 芍药苷对TMEM16A通道电流的抑制作用
将带有EGFP的过表达TMEM16A质粒用lipofectine 2000 转染到HEK293细胞中,转染48 h后,在荧光显微镜下定位转染成功的细胞进行电流记录。1 μmol·L-1细胞内钙离子时记录不同电压和不同时间点电流值。结果显示,100 mV电压下记录的不同时间TMEM16A电流值进行均一化处理,Inormalized=It/Imax(It 为不同时间点的电流值,Imax为记录最大电流值)。芍药苷处理后,TMEM16A电流明显被抑制,抑制率约为55%(见图4 A)。给药前不同电压不同时间点所记录的电流图,与之相比,给芍药苷(20 μmol·L-1)后再次记录,在相同电压的TMEM16A电流值明显减小(见图4 B)。

图4 芍药苷对TMEM16A电流的抑制作用
3.6 芍药苷分子与TMEM16A蛋白的分子模拟对接
利用 MOE(Molecular Operating Environment)2015.1001 软件包中的 DOCK 模块,以 TMEM16A(PDB ID:6BGI)为受体,与芍药苷进行分子模拟对接(见图5)。结果显示,芍药苷分子能与TMEM16A蛋白通过不同的化学键进行紧密结合。根据构象分析和分子对接模拟技术,初步筛选出芍药苷与TMEM16A蛋白结合的三个重要氨基酸残基为Arg373、Leu627和Asp812。

图5 芍药苷与TMEM16A分子模拟对接
4 讨论
近年来的研究发现,钙激活氯通道TMEM16A具有广泛的生理功能,如TMEM16A参与唾液腺、胰腺、呼吸道及肠道上皮细胞的氯离子分泌,调节心肌等兴奋性细胞的动作电位形成和血管平滑肌细胞的收缩功能[4]等。关于TMEM16A参与疾病的病理生理功能的研究亦成为研究热点,TMEM16A异常会导致哮喘、高血压、胃肠道运动障碍和癌症等多种疾病[5]。深入研究其病理生理功能,可能成为很多疾病病理机制研究的重要靶标蛋白,也可能成为治疗疾病的潜在靶标分子。
在炎性疾病中研究发现,TMEM16A作为阴离子通道,参与了很多炎症的发病过程:1)中慢性鼻窦炎伴鼻息肉(CRSwNP)患者中TMEM16A通过EGF-PI3K-TMEM16A信号通路上调MUC5AC表达参与该病的病变进展[6];2)在心肌细胞中特异性抑制TMEM16A可抑制NLRP3炎性小体炎症信号的激活,从而保护小鼠心肌缺血再灌注损伤[7];3)哮喘及其他过敏性炎症中,TMEM16A可导致黏液高分泌和支气管收缩,特异性抑制TMEM16A减少粘液的产生和分泌,以及支气管收缩,同时可减轻炎症介质的释放[8]。AP是常见的胰腺病变,本课题组前期研究发现,TMEM16A参与了急性胰腺炎的病理进程。研究发现腺泡细胞中TMEM16A在嘌呤能刺激下,从胞质重新定位到腔膜,产生分泌电位[9];其过程受到钙调蛋白调节,参与胰腺管腔内酸性化,此过程可能参与急性胰腺炎的发生发展[10]。
芍药苷具有广泛的抗炎抗免疫作用,通过多种机制参与炎症的发生发展:如芍药苷通过抑制NLRP3炎症小体激活,改善LPS诱导的炎症和神经性疼痛[11];芍药苷可部分通过肠道微生物群—上皮细胞自噬轴来缓解结肠炎[12]。本研究发现,芍药苷能够抑制急性胰腺炎腺泡细胞上TMEM16A通道蛋白,抑制NFκB磷酸化程度,减少炎症因子的生产作用;同时发现芍药苷可抑制TMEM16A钙激活氯电流作用,通过分子模拟对接方式发现芍药苷与TMEM16A蛋白具有直接结合位点,其中TMEM16A蛋白的Arg373,Leu627和Asp812是其结合的三个关键氨基酸残基。下一步将通过位点定向突变方法,对关键氨基酸残基进一步研究。
