后生元及其在乳制品中的应用研究进展
2022-04-15赵烜影王国骄雍靖怡
赵烜影,杨 扬,王国骄,雍靖怡,李 楠
(乳业生物技术国家重点实验室,上海乳业生物工程技术研究中心,光明乳业股份有限公司乳业研究院,上海 200436)
在过去的几十年里,益生菌的概念一直在发展,目前公认的定义将益生菌描述为“当摄入足够数量时,对宿主产生健康益处的活性微生物”[1]。有大量证据支持益生菌对健康的益处,大量研究成果表明,这些微生物在治疗腹泻、乳糖不耐症、结肠炎、肠易激综合征、某些类型的癌症、胰岛素抵抗、肥胖症和降低胆固醇、降低血压等方面能够发挥作用[2-8]。虽然益生菌的定义表明微生物应该是具有活力的才能提供有益作用,但最近的研究表明,微生物的活力并不是产生益处所必需的[9-10]。有研究发现,双歧杆菌属和乳杆菌属的提取物具有体外肿瘤抑制活性[11-12]。目前已有研究提出灭活或无活力的益生菌,以及它们的代谢副产物均能够为宿主的健康提供益处的观点[13]。目前可以通过益生菌、益生元、后生元3 种方式调节微生物群,这为功能性食品领域发展提供了潜在的机会[14]。
后生元又称代谢物、生物源或无细胞上清液(cellfree supernatant,CFS),是指“活细菌分泌的或细菌裂解后释放的可溶性因子”[12]。这些可溶性因子可以是短链脂肪酸(short-chain fatty acid,SCFA)、微生物组分、功能性蛋白质/酶、胞外多糖、细胞裂解物、胞壁肽(磷壁酸、脂磷壁酸、肽聚糖等)[15-17]。后生元发挥特定功效的确切作用机制尚未完全阐明[18]。但已有科学数据表明,后生元具有不同的功能特性,包括但不限于抗菌、抗氧化和免疫调节[19-22]。这些特性可以对菌群稳态、宿主代谢和信号通路产生积极影响,从而影响特定的生理、免疫、神经激素生物学调节和代谢反应[23]。最近的研究表明,后生元的功能特性可能与增强肠道屏障功能和黏膜免疫有关,进而能够预防免疫疾病,调节肠道菌群组成及活性[24-28]。还有研究认为,后生元具有抑制病原体、控制肥胖、维持葡萄糖稳态等功能特性[29]。尽管后生元的重要性还未得到普遍重视,研究内容主要来源于常见的乳杆菌,但有关其功能特性的研究正在逐步增加[19,21-22,30]。
1 后生元的分类
后生元主要来源于肠道菌群,少部分由可发酵的膳食纤维受刺激而代谢产生,主要存在于结肠和盲肠中,包括蛋白质、肽、有机酸和其他小分子[31]。它们具有不同的功能特性,如用作抗菌剂、抗氧化剂和免疫调节剂[12,32]。此外,它们对微生物群的内环境稳定以及代谢、免疫和神经通路等具有积极影响[23]。图1显示了由肠道细菌代谢形成的主要后生元[31]。
1.1 蛋白质和肽
已经从包括干酪乳杆菌、副干酪乳杆菌和鼠李糖乳杆菌在内的许多乳杆菌中分离出了蛋白质p40和p75[33],它们是含有羧基(C)端CHAP片段或NlpC/P60超家族结构域的胞壁质酶,分子质量分别约为40 kDa和75 kDa,来自鼠李糖乳杆菌GG的蛋白质p40在小鼠实验中显示出免疫调节作用[34]。有研究认为,p40能够诱导肠上皮细胞表皮生长因子受体的磷酸化,抑制细胞凋亡并保护结肠的屏障功能,从而改善肠道损伤和炎症[31,35-37]。此外,从鼠李糖乳杆菌GG和干酪乳杆菌BL23中纯化的p75通过诱导表皮生长因子/蛋白激酶B途径具有抗凋亡活性[33]。而且p40和p75蛋白能够通过蛋白激酶C和促分裂素原活化蛋白激酶依赖性机制保护肠上皮紧密连接和屏障功能[38]。
1.2 聚集促进因子(assemble-promoting factor,APF)
乳杆菌可以分泌多种APF蛋白,是一类负责连接接合对、自聚集、维持细胞形状及与其他共生菌或病原菌共聚集的胞外蛋白[39-40]。分泌自乳酸杆菌的APF功能主要涉及定植于宿主内和排斥病原体,APF使乳酸杆菌能够在胃肠道中定植,并通过竞争性排斥或与病原体共聚集来抑制病原体的黏附[41-42]。来自格氏乳杆菌ATCC 9857菌株的APF-2蛋白有助于抑制阴道毛滴虫对人阴道外宫颈细胞的黏附[43-44]。嗜酸乳杆菌GGDEF蛋白和来自植物乳杆菌NCIMB 8826中富含丝氨酸/苏氨酸的APF蛋白能够提升胞外聚合物产量,增强其共聚能力[45]。
1.3 细菌素
细菌素是某些细菌在代谢过程中通过核糖体合成机制产生的一类具有抑菌活性的多肽或前体多肽[46]。乳酸杆菌可以分泌多种细菌素,如来自嗜酸乳杆菌和约氏乳杆菌的乳酸菌素B、来自干酪乳杆菌的乳酸菌素、来自干酪乳杆菌的乳酸菌素705、来自乳酸杆菌的乳酸菌素G和来自植物乳杆菌的乳酸菌素[47-48]。
乳杆菌分泌的细菌素可以抑制病原体。瑞士乳杆菌PJ4分泌的细菌素PJ4可以抑制肠道病原体的活性;阴道短乳杆菌DT24产生的细菌素DT24对泌尿病原体大肠杆菌有拮抗作用[49-50]。罗伊氏乳杆菌产生的罗伊氏蛋白通过修饰硫醇基团和诱导细菌细胞中的氧化应激发挥抗菌作用[51]。此外,来自不同乳杆菌属的纯化细菌素在小鼠模型中显示出抗感染功能,证明细菌素有望成为对抗胃肠道感染药物的替代品[52]。除了抗菌作用外,乳酸菌产生的细菌素也能够影响宿主免疫,从嗜酸乳杆菌中分离的细菌素提高了巨噬细胞的吞噬活性[53]。
1.4 SCFA
SCFA是由肠道微生物群通过不同的代谢途径从纤维、寡糖和多糖等难消化的食物成分中产生的[54]。研究表明,益生菌可以产生不同类型的SCFA[55]。鼠李糖乳杆菌GG和格氏乳杆菌PA16/8能够产生丙酸[56]。Dhaliwal等[57]证实,给小鼠补充植物乳杆菌会增加小鼠盲肠中乙酸和丁酸水平,并降低肠道通透性,同时还会增加大脑中的单胺氧化酶活性。植物乳杆菌CECT 7529可产生丙酸和丁酸,显示出降低胆固醇水平的优异特性[58]。此外,唾液乳杆菌FP25、FP35及罗伊氏乳杆菌NCIMB产生的SCFA能够抑制结肠癌细胞的增殖[59]。
1.5 神经递质
肠道细菌通过产生如γ-氨基丁酸(γ-aminobutyric acid,GABA)、谷氨酸、血清素、多巴胺、去甲肾上腺素、组胺和乙酰胆碱等神经递质促进肠-脑轴的正常功能[60]。副干酪乳杆菌、瑞士乳杆菌、植物乳杆菌和鼠李糖乳杆菌等可以产生GABA、血清素、儿茶酚胺、多巴胺和乙酰胆碱等多种神经递质[57,61-64]。据报道,乳杆菌作为“心理生物”对心理健康有益处[65]。除此之外,肠道共生乳酸菌产生的组胺和多巴胺在睡眠相关的疾病中发挥重要作用,还能调节抑郁症、焦虑症中的神经元信号传导,这表明益生菌对心理健康的影响可能归因于神经递质的产生[66]。
1.6 CFS
从不同微生物培养物中获得的含有由细菌和酵母分泌到周围液体中的生物活性代谢物CFS具有不同的活性[14]。嗜酸乳杆菌和干酪乳杆菌CFS通过抑制促炎性肿瘤坏死因子α及增加抗炎细胞因子白细胞介素10(interleukin-10,IL-10)的分泌表现出抗肿瘤活性[67]。来自乳酸杆菌属和双歧杆菌属细菌培养物的上清液最近也在体外实验中被证明能够通过阻止大肠杆菌侵入肠细胞,从而显示出抗菌活性,尽管这些抗菌特性可能是由于抑制病原菌株的黏附,但CFS也可能对肠道环境、细胞屏障和基因的表达产生部分影响[68]。
1.7 细胞壁碎片
细菌细胞壁的许多成分具有免疫原性(即引发特定的免疫反应),包括细菌脂磷壁酸[14]。脂磷壁酸存在于革兰氏阳性菌的细胞壁中,可以自发释放到环境中[69]。尽管脂磷壁酸已被证明具有免疫刺激作用,但关于其活性的数据尚不明确。部分研究表明,脂磷壁酸可减少IL-12的产生并诱导具有免疫调节活性的细胞因子(如IL-10)的产生[70]。脂磷壁酸还可以增强非特异性防御机制,释放β-防御素和导管素等抗感染肽,以及刺激皮肤肥大细胞对某些细菌和病毒感染的反应[71]。
1.8 胞外多糖
益生菌在生长过程中会产生具有不同化学性质的生物聚合物。这些生物聚合物可以释放到细菌细胞壁外,形成一组异质的物质,称为胞外多糖[14]。从植物乳杆菌产物中分离出的胞外多糖在体外模型中诱导一氧化氮分泌,进而增强巨噬细胞的吞噬能力,还能显著增加肠黏膜中的免疫球蛋白A(immunoglobulin A,IgA)含量(P<0.05)并极显著刺激淋巴细胞增殖(P<0.01)[71]。从瑞士乳杆菌中获得的胞外多糖糖醛酸能够结合铁离子,而具有抗氧化潜力[72]。β-葡聚糖是另一类胞外多糖,可以通过激活巨噬细胞表面的Dectin-1受体,增强针对细菌、病毒、寄生虫和癌细胞的细胞免疫反应[73]。
1.9 酵素
微生物具有针对活性氧破坏的防御机制,谷胱甘肽过氧化物酶、过氧化物歧化酶、过氧化氢酶和还原型辅酶Ⅰ等抗氧化酶在对抗活性氧中起着关键作用[14]。研究发现,2 种具有高含量谷胱甘肽过氧化物酶的发酵乳杆菌菌株,在体外具有强大的抗氧化活性[74]。在炎症性肠病小鼠模型中,具有高过氧化氢酶活性的乳酸杆菌菌株比产生过氧化物歧化酶的相同菌株能更有效地缓解炎症,与对照组相比,2 种菌株均显著降低了体温(P<0.05)[75]。
2 后生元的分离制备
制备后生元需要先将微生物灭活[10]。不同的灭活方法会对微生物的细胞结构或其生理功能产生不同的影响,但都要保证制备的后生元能够保持有益功效[12]。
一般来说,后生元是通过细胞破碎技术制备的,包括热处理、化学品(如福尔马林)、超声处理、酶处理和溶剂提取等[10,12,20,76]。此外,离心、透析、冻干和柱纯化等额外的提取和净化步骤也可用于获得后生元[10,12,77]。热处理是最常见的制备方法,加热的时间和温度取决于影响微生物热阻的因素(如微生物生长的培养基、微生物的生长阶段、微生物的水分活度等)[77]。在Kamilya等[78]的一项研究中,解淀粉芽孢杆菌FPTB16和枯草芽孢杆菌FPTB13经60 ℃加热2 h灭活后对细胞免疫的刺激效果优于活菌。Sañudo等[79]通过121 ℃、20 min加热处理唾液乳杆菌CECT 5713制备的无活力细胞能够抑制与龋齿形成相关的病原体变形链球菌,临床研究显示,志愿者体内的变形链球菌唾液含量从治疗的第3天开始显著降低。
另一方面,非热和新兴技术虽然报道较少,但也已用于制备后生元(表1)[77]。与热处理相比,这些技术具有提高微生物的灭活率、减少有机废物的产生和能源消耗等多种优势[77]。研究发现,通过紫外线照射肠球菌L-1灭活处理2.5 h获得的后生元在刺激4 种不同细胞免疫系统的过程中能提高白细胞的吞噬活性、呼吸爆发和过氧化物酶含量[80]。Dunand等[81]通过喷雾干燥的方法制备5 种商业菌株(Delvo-Add 100-HDSF、LH-B02、Lb-12、Cheestart H 2085和Cheestart H 2087)和11 种本地乳杆菌菌株(瑞士乳杆菌、德氏乳杆菌保加利亚亚种、德氏乳杆菌)的后生元。结果表明,与对照组(活细胞)相比,喷雾干燥制备的后生元刺激了小鼠粪便中分泌性IgA的产生,并保护小鼠免受沙门氏菌感染。Rakhuba等[82]通过超临界流体技术(以超临界CO2为流体)从植物乳杆菌B-01中提取糖脂,糖脂定量测定结果表明,在25 MPa、40 ℃、超临界CO2流速为5 mL/min、以供氢甲醇作为助溶剂(体积分数9.3%)的条件下提取9 h,可在每毫克提取物中得到620 μg糖脂。
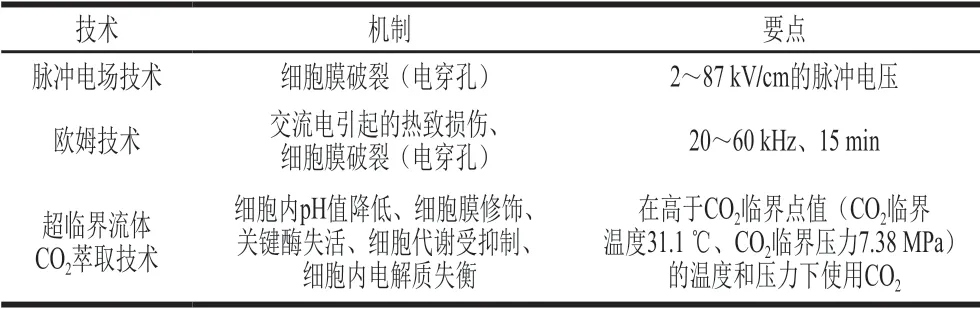
表 1 后生元制备技术[77]Table 1 Postbiotic preparation techniques[77]
3 后生元的鉴定
从根本上讲,后生元是否能够抑制与食品安全相关的有害微生物,主要通过分析其化学成分和进行体外拮抗实验来验证[83]。后生元和具有拮抗活性分子的定量和质量应使用分析程序进行测试[12]。鉴于具有不同聚合度和糖苷键的生物化合物的复杂性,后生元的定性、定量分析通常需要具有多个浓缩/净化步骤的复杂设备[83]。对于后生元的定性、定量分析已经应用了大量仪器技术和创新方法,常见的方法有色谱法(气相、液相、薄层色谱等)、光谱法(核磁共振、傅里叶变换红外吸收光谱)及分光光度法[18]。通常根据分析目标和所追求的表征类型选择适当的方法[18,83]。
尽管所有这些技术都可用于检测、识别和量化后生元,但需要对提取方案和分析工具进行更多研究,以便于发现和表征新型后生元、了解作用机制及调节信号通路[83]。还需要进一步研究优化培养基和培养条件以及分析方法[84]。一旦实现了实验室规模优化,就需对其进行放大和优化,提高工业后生元产量[12]。
4 后生元在乳制品中的潜在应用
在过去的几年里,消费者对营养和健康的重要性有了更多的认识和关注,使得包含益生菌在内的功能性食品迅速崛起,据估计,到2023年全球益生菌市场将达到693 亿美元[18]。乳制品具有与高缓冲能力和脂肪球、酪蛋白胶束和乳糖这些牛乳成分相关的理想特性,这些特性能为益生菌通过胃肠道期间提供保护[85]。同时,由于乳粉、酸乳等食品具有低水分活度和低pH值等特性,对益生菌在贮藏期间的存活率几乎没有限制。这些因素使得乳制品(发酵乳、乳饮品、冰淇淋、奶酪)成为最常见的益生菌载体,占据了益生菌市场的最大份额[86]。
受限于益生菌的活力是其发挥生物功效的必要条件,乳制品在加工、贮藏甚至人体消化过程中,添加的益生菌浓度需达到106~109CFU/g(mL)来保持活力[18]。而乳制品载体的理化指标(pH值、蛋白质、脂肪和碳水化合物含量、水分活度、天然抗生素的存在)、加工和贮藏条件(时间、温度、接种率、pH值、氧含量、包装材料)等应激因素可能对其存活率和功能产生不利影响[18,87]。相比之下,后生元在工业使用中更稳定、更安全。因此,与相同的活微生物相比,其在乳制品中的应用可能提供多项技术优势[18]。
与益生菌产品相比,添加后生元的乳制品在生产加工和商业化方面更加简单和方便。它们与食品基质或成分的化合物相互作用很少或没有相互作用,从而延长保质期[77]。它们在很宽的pH值和温度范围内保持稳定,在不影响后生元功能的前提下能够在热处理之前添加到具有较高酸度的食品中,最大限度减少加工后微生物污染[12,77]。根据产品的不同,后生元产品在贮运过程中可能摆脱冷链运输范围的限制,除了有利于功能性乳制品下沉至欠发达地区,还节省了产品成本及损耗[18]。另一巨大优势是后生元不会改变产品的感官特性,含有后生元的酸乳发酵后会避免发生高酸化[12,18,77]。因此,后生元除了在乳制品的生产和商业化过程中提供便利性和实用性以外,还可能在不适合益生菌生存的食品中应用,扩大功能性产品的市场。
除了上述优点外,由于其功能特性,后生元对最终产品的理化和感官特性也会产生积极影响,提供更好的稳定性、质地和适口性,从而用作功能性辅料进行添加[18]。Ali等[88]发现,嗜热链球菌和德氏乳杆菌产生的胞外多糖能够克服脱水收缩问题,减少乳清析出,可以作为合成食品添加剂(增稠剂和乳化剂)的替代品在酸乳生产过程中提供更好的质地和感官特性。该研究发现,后生元被机体适当地吸收和代谢后,具有与各种组织和器官显著的信号传导潜力,鉴于其良好的抗菌作用,它们很有可能成为抗生素替代品[89]。由于其独特的特性(保质期长、无毒、易于运输和维护成本低),后生元可作为抗菌物质用于食品工业中防止食品腐败[13,90]。Lactis菌株的后生元成分可用作奶酪中的防腐剂[91]。此外,作为一种天然化合物,后生元还能够帮助实现乳制品的“清洁标签”要求,满足消费者对健康和天然食品的需求[18,83]。抗微生物剂作为一种后生元可通过抑制食源性病原体和腐败微生物的生长来延长食品的保质期,运用在酸乳中可达到“清洁标签”的效果[92]。
5 结 语
后生元可能有助于改善宿主健康。本文对于后生元特性的概述使我们能够确定:1)它们可以由多种益生菌菌株制成;2)它们可以通过多种灭活方法获得/生产;3)它们可以通过多种分析方法进行定性和定量表征;4)后生元在乳制品行业中具有潜在应用价值。
未来后生元的发展方向应侧重于机制研究,需要更多的证据来支持后生元作为健康补充剂的主张。肠道菌群是未来临床研究的重要参数,可以通过应用宏转录组学、宏蛋白质组学和代谢组学等方法来更好地了解后生元影响健康的潜在机制和信号通路。
后生元对于开发具有功能性成分的生物技术产品来说具有宝贵的潜力,但首先需要解决安全和监管问题,而且需要在工业水平上设计用于规模化生产后生元的工艺,以及发现并表征新型后生元的新技术,以保证它们在生产过程中和在潜在的预防及治疗中保持一致性与有效性。
